应用分子对接方法筛选桑椹红色素微胶囊壁材
2020-10-15杨文宇詹茂玲陈祥贵刘茂祥
杨文宇 ,王 萌,肖 阳,李 飞,詹茂玲,陈祥贵,刘茂祥
(1.西华大学食品与生物工程学院,四川 成都 610039;2.四川黑金椹阳光农业有限公司,四川 成都 610064)
桑椹红色素是桑椹所含花色素类成分的通称,含量丰富,在桑椹汁中的含量为147.68~2 725.46 mg/L[1],在桑椹汁冻干粉中的含量为2.53%~4.78%[2],在桑椹干果中的含量为0.09%~2.33%[3],与品种及产地有关。桑椹红色素中所含花色苷包括矢车菊素3-O-(6″-O-α-鼠李糖基-β-半乳糖苷)、矢车菊素3-O-(6″-O-α-鼠李糖基-β-葡萄糖苷)、矮牵牛素-3-O-葡萄糖苷、矢车菊素3-O-葡萄糖苷、矢车菊素3-O-芸香糖苷等,其中,主要成分是矢车菊素3-O-(6″-O-α-鼠李糖基-β-半乳糖苷),占41.3%[4]。桑椹红色素具有多种保健活性,包括抗氧化、抗糖尿病、抗肿瘤等,在食品和药品领域有着广泛的用途[5]。但是,桑椹红色素的稳定性较差[6-7],光、热、氧、金属离子等多种因素可导致其降解,这对其功能性应用产品的开发带来了挑战。有研究[8]表明,将花色素类成分制成微胶囊对提高其稳定性有益。近年来,蛋白质壁材在花色素微胶囊中的应用前景受到了较多关注[9-10],这为桑椹花色素微胶囊的开发提供了启示。目前,微胶囊蛋白质壁材的筛选仍主要依靠经验和大量实验,在一定程度上具有盲目性,且效率较低。分子对接是一种通过计算机模拟预测分子间相互作用的研究方法,最初主要用于评价药物对有关作用靶点的适配性,能够深入揭示药物与靶点之间的氢键、范德华力、静电势等相互作用。近年来,分子对接方法已被拓展应用于配方研究领域,如槲皮素-环糊精包合物[11]、虾青素-β-乳球蛋白-壳聚糖纳米复合物[12]、叶黄素-海藻酸钠微球[13]等,在辅料筛选和复合物分子机制分析等方面的应用潜力逐渐得以展示。分子对接具有快速、准确、高通量、低成本等优势[14],以分子对接为导向,针对特定化合物筛选制备微胶囊的蛋白质壁材,不仅能够节省实验时间,提高研究效率,而且还能初步揭示微胶囊壁材和芯材成分之间的相互作用机制,值得深入探讨。
1 材料与方法
1.1 材料、试剂、仪器与软件
样品:桑椹(Morus albaL.),干品,四川黑金椹阳光农业有限公司产品,产自四川盐边县惠民乡。
试剂:无水乙醇、磷酸二氢钾、冰乙酸、三水乙酸钠、浓盐酸、氢氧化钠、D101型大孔树脂、β-环糊精,均为分析纯;大豆分离蛋白,食品级。
仪器:UV-2600A型紫外可见分光光度计,上海尤尼柯公司;Concentrator plus真空离心浓缩仪,德国艾本德;DMi8 A光学显微镜,德国Leica;TDZ5-WS台式低速自动平衡离心机,上海卢湘离心机仪器有限公司;KQ2200型超声波清洗器,昆山市超声仪器有限公司;SHZ-D(ш)循环水式多用真空泵,河南省予华仪器有限公司;TB-214电子天平,成都世纪方舟科技有限公司;HNY-2102C恒温培养振荡器,成都世纪方舟科技有限公司;SFG-0.2.400电热恒温鼓风干燥箱,黄石市恒丰医疗器械有限公司;Phs-430型pH计,成都世纪方舟科技有限公司;BUCHI旋转蒸发器R-210和HH-S数显恒温水浴锅,瑞士BUCHI公司;LyoQuest-85实验型冷冻干燥机,西班牙Telstar公司。
软件:ChemSketch 12.0,美国Advanced Chemistry Development公司;Molegro Virtual Docker 5.0(MVD),丹麦Molegro ApS公司。
1.2 方法
1.2.1 分子对接方法
1.2.1.1 目标蛋白质的准备
分别选择来源于大豆、鸡蛋、牛奶的主要蛋白质各两种进行对接研究,大豆蛋白:碱性7S球蛋白、H-2铁蛋白;鸡蛋蛋白:未裂解卵清蛋白、S-卵清蛋白;牛奶蛋白:β-乳球蛋白、α-乳清蛋白。拟对接的目标蛋白质的X线衍射晶体结构下载自美国罗格斯大学等建设的蛋白质晶体结构数据库(RCSB PDB,http://www.rcsb.org/)(表1)。
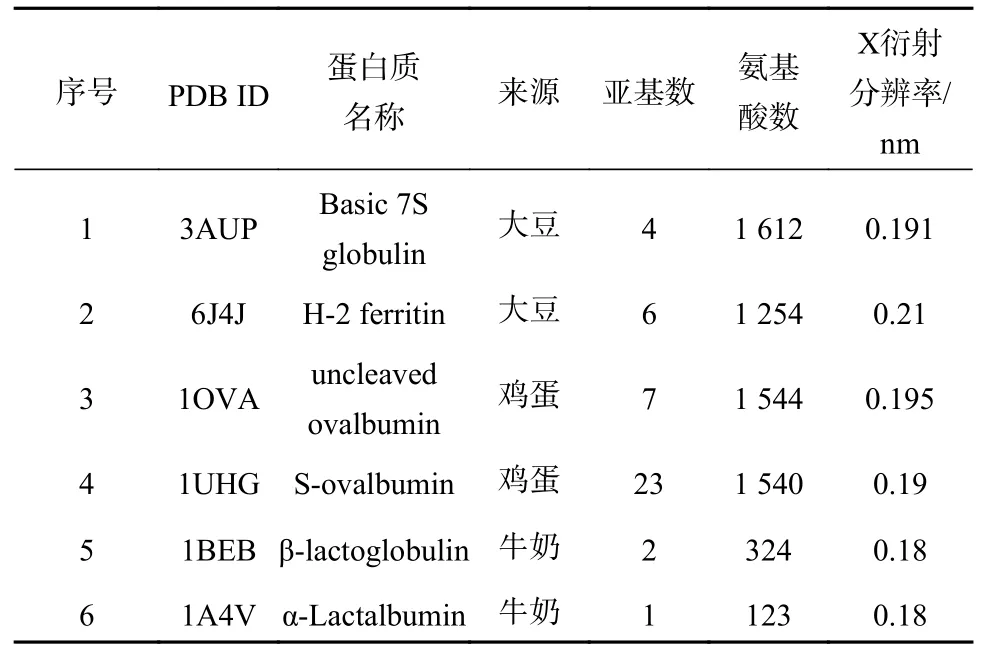
表1 目标蛋白质
各个蛋白质分子经分配键序、电荷优化、加氢等处理后备用。
1.2.1.2 桑椹花色苷分子的准备
以桑椹花色苷的主要成分矢车菊素3-O-(6″-O-α-鼠李糖基-β-半乳糖苷)为代表进行考察,分子平面结构用ChemSketch软件绘制,三维结构由在线程序CORINA(https://www.mn-am.com/)转换产生并进行构象优化。
1.2.1.3 对接参数
通过建立能量网格进行对接,网格分辨率为0.03 nm;结合位置根据探测所得活性口袋进行选择;搜索算法采用MolDock SE,运行次数为100次,最大迭代次数为1 500次;结合构象的能量门槛设为100 kcal/mol;单纯形进化算法最大步骤设为300,邻近距离因子设为1.00。
1.2.1.4 对接评分
评分函数选用MolDock Score,用Escore表示,Escore=ET+Eint,式中,ET为结合构象与靶分子之间的总相互作用能,Eint为结合构象的内能。ET=Epro+EW,其中Epro为结合构象与蛋白质(包括氨基酸残基和辅因子等)之间的相互作用能,EW为结合构象与水分子之间的相互作用能。
1.2.2 桑椹红色素的制备
参考文献[15-17]的方法并结合前期经验,按以下方法制备:桑椹经破碎、充分研磨后,以60%乙醇(盐酸调pH值 为1~2)为提取溶剂,按照料液比1:15,室温下超声波辅助提取2次,每次30 min。提取液加水稀释至花色素质量浓度约0.1 mg/mL(以矢车菊素3-O-葡萄糖苷计),上D101大孔树脂柱进行纯化,上样体积为3倍柱体积,流速为6 BV/h,用水洗去糖类等杂质后,以80%乙醇(盐酸调pH值到 1)解吸,洗脱液经50 ℃以下减压浓缩,得到桑椹红色素浸膏,经冷冻干燥后备用。
1.2.3 桑椹红色素的测定方法
桑椹红色素是由多种花色素类成分组成的混合物,因此采用色价[18-19]来表示其含量。取桑椹红色素样品,以80%乙醇(盐酸调pH为 1)溶解并稀释至合适浓度,先进行光谱扫描确定最大吸收波长,然后以溶剂为参比,测定该波长下的吸光度值(控制吸光度为0.3~0.7),根据朗伯比尔定律计算色价=(A×DF)/m,式中A为所测吸光度值,DF为稀释倍数,m为样品质量。
1.2.4 微胶囊的制备
1.2.4.1 制备步骤
借鉴文献[20-21]的溶剂挥发法制备微胶囊的原理,并参考其中的部分步骤,在此基础上,基于非热处理的思路,以研磨法为主制备桑椹红色素微胶囊。取一定量的壁材物料,加适量水或含水乙醇溶液,使之分散并具有一定的流动性,然后加入一定比例的桑椹红色素提取物作为芯材,经充分研磨后,冷冻干燥,得到的紫红色块状产物,研细过筛,即制得桑椹红色素微胶囊。
1.2.4.2 复合壁材比例的考察
根据分子对接结果选用相应蛋白质,与β-环糊精[22]组成复合壁材,用作桑椹红色素微胶囊的载体。取β-环糊精,与蛋白质按质量比2:8、4:6、5:5、6:4和8:2分别混合,作为壁材。固定芯壁比为1:10,按上述制备步骤分别制成桑椹红色素微胶囊。以包埋率为指标评价β-环糊精与蛋白质的不同比例对包埋效果的影响。包埋率的测定:取微胶囊干燥样品2 g,称定,加95%乙醇20 mL,拌1 min,静置10 min,过滤后测定滤液的吸光值,根据朗伯比尔定律计算滤液中花色素的量Yi(以矢车菊素-3-O-葡萄糖苷计,摩尔吸收系数ε=26 900),由此求得包埋率R,R/%=(1-Yi/Y)×100,式中Yi代表微胶囊产品表面未被包埋的花色素的量;Y为微胶囊供试品中桑椹红色素的总量。
1.2.4.3 芯壁比例的考察
根据复合壁材比例考察结果确定微胶囊壁材,考察不同芯壁比1:6、1:8、1:10、1:12和1:14对包埋效果的影响,包埋率的测定方法同1.2.4.1。
1.2.4.4 微胶囊微观形态的分析
按照优化的复合壁材比例和芯材比例制备桑椹红色素微胶囊,取少量微胶囊粉末置于载玻片上,使其保持均匀(必要时加1滴柏油以便于粉末聚集),盖上盖玻片,置DMi8 A光学显微镜下,在500、250 nm分辨率下观察微胶囊的表面形态,通过联机软件得到显微图像。
1.2.4.5 微胶囊稳定性的考察
对热稳定性进行考察:取未微囊化的桑椹红色素、桑椹红色素微胶囊适量,分别加20.0 mL水,置70 ℃水浴中,避光加热150 min,每隔30 min取出1.0 mL,适当稀释后测定吸光度,计算各时间点样品中的花色素含量(以矢车菊素3-O-葡萄糖苷计),以此求保存率P,P/%=(Mt/M0)×100,式中:Mt为取样时样品中花色素含量;M0为样品中花色素的初始含量。经热处理后的桑椹红色素微胶囊样品,冷冻干燥,再次进行显微镜观察。
对光稳定性考察:取未微囊化的桑椹红色素、桑椹红色素微胶囊适量,于夏天自然光下分别曝光5 d,每天取样溶解后测定吸光度,按热稳定性考察方法计算保存率。
2 结果与分析
2.1 矢车菊素3-O-(6″-O-α-鼠李糖基-β-半乳糖苷)与不同蛋白质的结合能力分析
矢车菊素3-O-(6″-O-α-鼠李糖基-β-半乳糖苷)与6种蛋白质的对接评分结果见表2。配体与蛋白质对接时产生结合构象(pose),其与蛋白质之间的结合自由能,即为Escore值。通常,配体-蛋白质间的结合自由能越低(负值,其绝对值越大),则配体与该蛋白质的结合能力越强[23]。根据对接前的设置,矢车菊素3-O-(6″-O-α-鼠李糖基-β-半乳糖苷)与各个蛋白质对接完成后,MVD软件为每个蛋白质返回5个pose,代表配体与蛋白质相互作用的5种可能状态。利用MVD软件内置的人工神经网络算法对这5个pose的数据进行建模,并根据模型重新预测,可得到较为合理的对接评分。表2的Escore值即为人工神经网络建模后预测值。
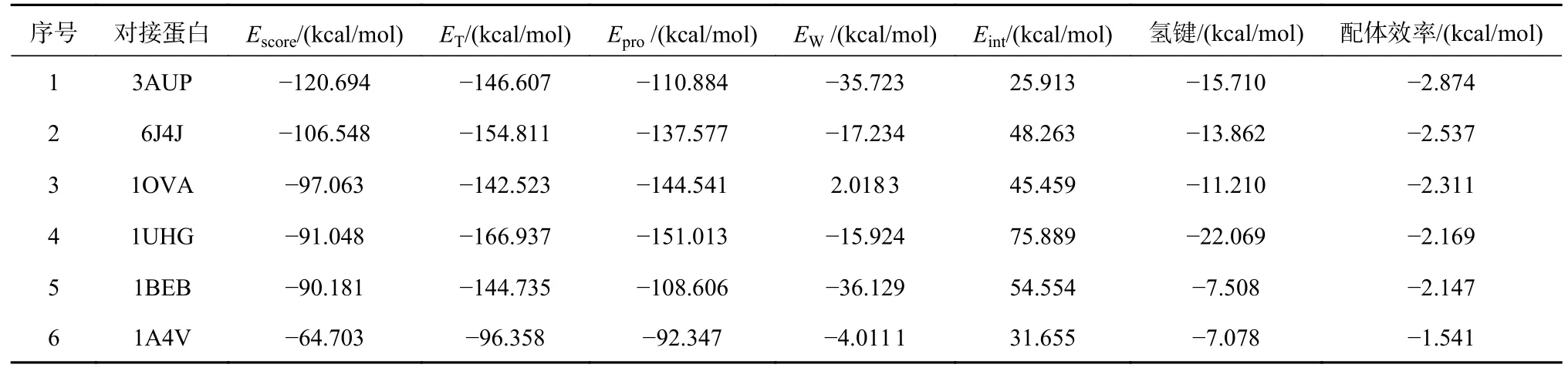
表2 对接参数评分表
对比6个蛋白质的Escore值可知,大豆蛋白3AUP、6J4J较卵清蛋白和牛乳蛋白与矢车菊素3-O-(6″-O-α-鼠李糖基-β-半乳糖苷)的结合能力更强。而且,它们的配体效率也优于其余4种蛋白质。虽然配体效率通常用于表示分子量与活性的关系,但此处也说明大豆蛋白的结构更适宜其配体。另外,花色苷分子中含有较多的氢键供体和受体,能与蛋白质的多种氨基酸残基和结合水形成氢键;因此,氢键是影响其与蛋白质相互作用的主要因素之一。表2中,虽然1UHG所形成的氢键最强(-22.069 kcal/mol)、1BEB中结合水的作用最强(-36.129 kcal/mol),但由于其配体pose具有较高的内能(75.889 kcal/mol、54.554 kcal/mol),故它们的Escore值较低。而3AUP、6J4J的氢键评分和EW评分均较高,且都具有相对较低的内能,表明配体pose处于较为理想的低能构象状态,能够形成较为稳定的配体-蛋白质复合物。
矢车菊素3-O-(6″-O-α-鼠李糖基-β-半乳糖苷)与3AUP的结合位置见图1,结合口袋位于A~D亚基之间,由氢键支撑在体积为3.895 3 nm3的活性口袋的正中间;氢键分布见图2,氢键数据见表3。
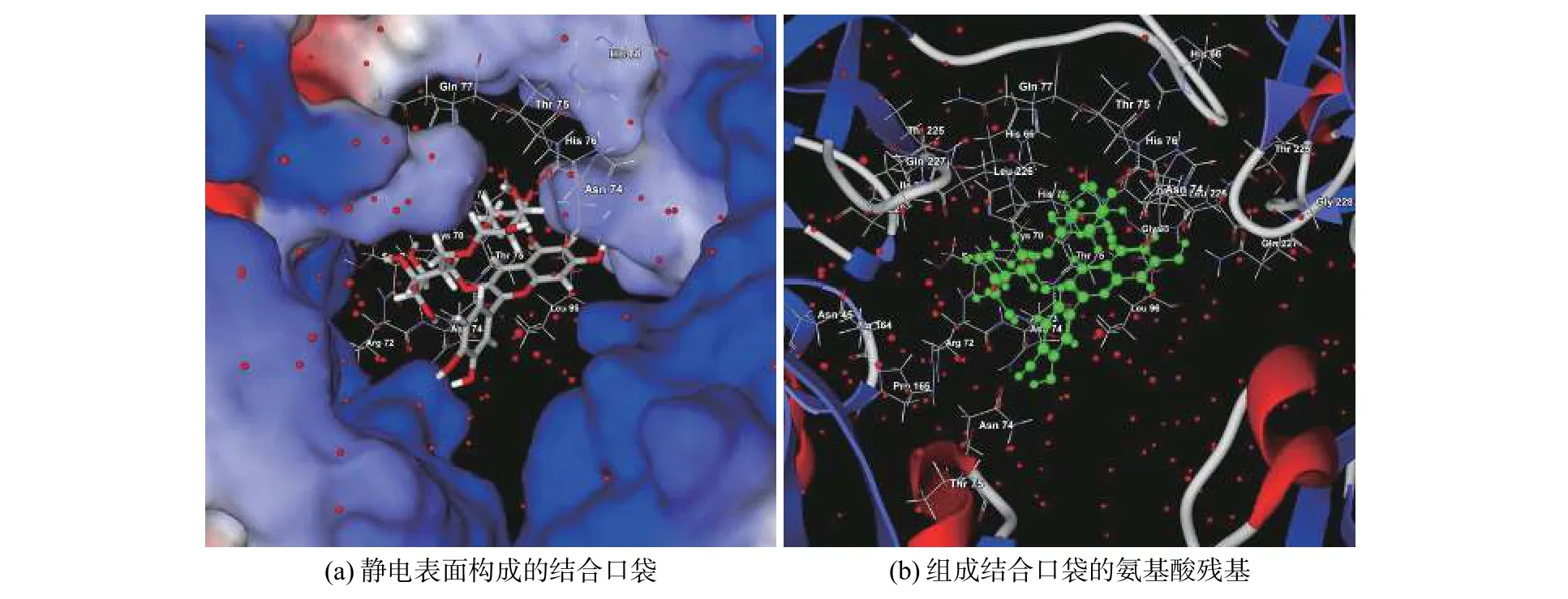
图1 3AUP中矢车菊素3-O-(6″-O-α-鼠李糖基-β-半乳糖苷)的结合位置和构象
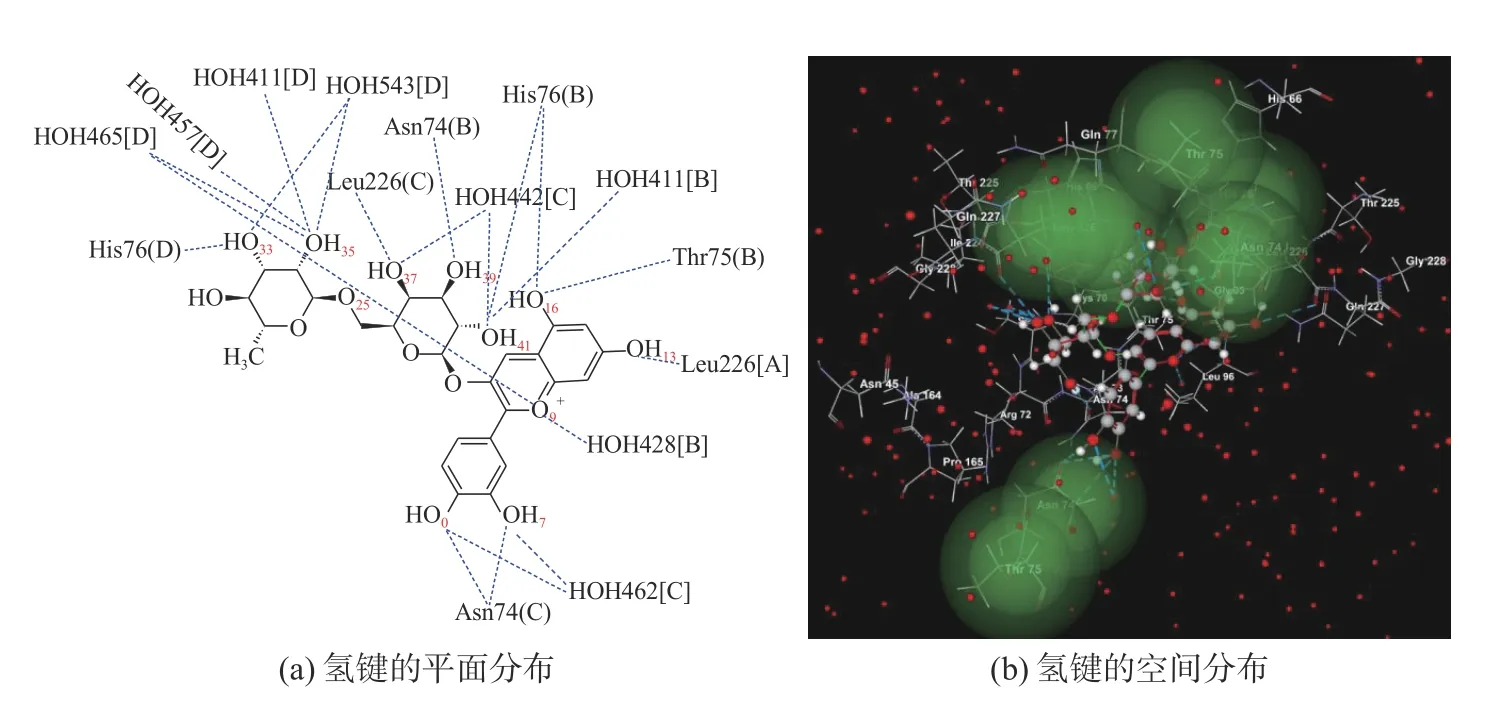
图2 矢车菊素3-O-(6″-O-α-鼠李糖基-β-半乳糖苷)与3AUP形成的氢键
矢车菊素3-O-(6″-O-α-鼠李糖基-β-半 乳 糖苷)与6J4J的结合位置见图3,结合口袋位于A、B亚基之间,体积为0.051 7 nm3;氢键分布见图4,氢键数据见表4。
综合以上分析可知,桑椹红色素的主要成分矢车菊素3-O-(6″-O-α-鼠李糖基-β-半乳糖苷)与大豆蛋白的结合能力强于卵清蛋白和牛乳蛋白,大豆蛋白更适宜用作桑椹红色素微胶囊的壁材成分。
2.2 桑椹红色素提取纯化的结果
原料样品中桑椹红色素的提取率为6.88 mg/g。大孔树脂纯化前,粗提物的色价为=42.3;纯化后提取物的色价为=86.2。
2.3 大豆蛋白用于桑椹红色素微胶囊制备的结果分析
2.3.1 壁材组成对微胶囊包埋率的影响
从由图5(a)可知:大豆分离蛋白与β-环糊精的质量比例的改变对桑椹红色素的包埋效果有着明显的影响;包埋率随着壁材中大豆分离蛋白比例的增加而增加;壁材中大豆分离蛋白的比例从20%增加到80%时,桑椹红色素包埋率的增幅达10%以上。这表明桑椹红色素中的花色苷分子与大豆分离蛋白分子之间的确存在着较强的相互作用。因此,上述分子对接研究的预测结果是准确的。同时,有关以大豆分离蛋白和麦芽糊精为壁材能很好地包埋花色素类成分的报道[24-26]也能与上述结果相互印证。
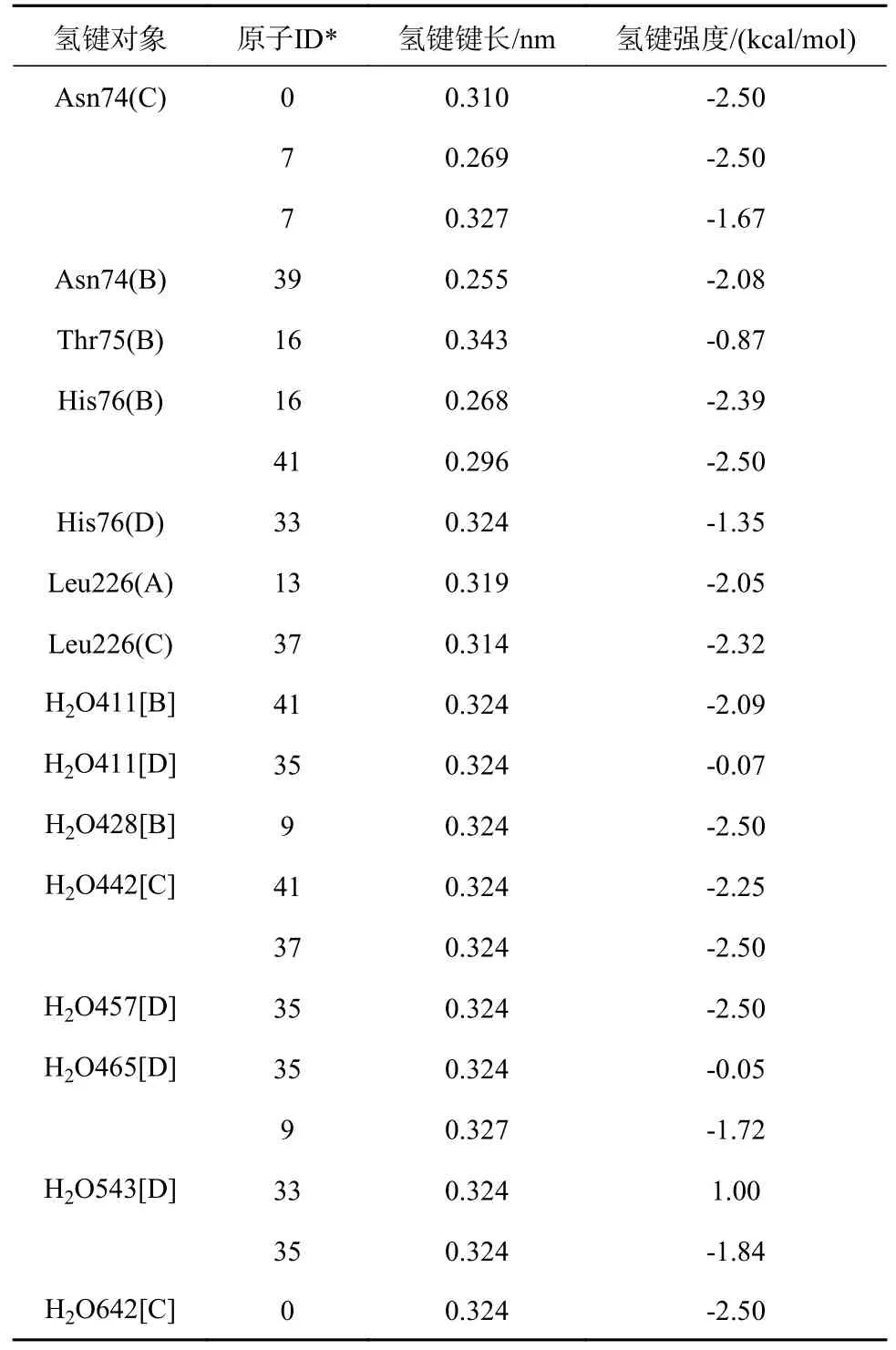
表3 矢车菊素3-O-(6″-O-α-鼠李糖基-β-半乳糖苷)与3AUP间的氢键
2.3.2 芯壁比对微胶囊包埋率的影响
芯壁比的考察所采用的壁材为质量比1∶1的大豆分离蛋白和β-环糊精的混合物。由图5(b)可知,壁材用量为芯材用量的10倍时,与用量为6倍、8倍相比,包埋率有明显的增加,增幅达10%以上。按理,若进一步增加壁材用量,包埋率可进一步增大,但壁材用量增到12、14倍时包埋率略有下降。不过,下降幅度在3%以内。结合实验操作过程分析,这应当是由于壁材比例偏高、研磨不均匀所致。若从分组的角度看,1:6、1:8可归为一组,1:10~1:14可归为另一组。这两组实际上代表了包埋率的两个梯度,而梯度间的转折比例在1:8和1:10之间。因此,为了得到较好的包埋率,1:10是较适宜的选择。
2.3.3 微胶囊的微观表面性状
以质量比为8:2的大豆分离蛋白和β-环糊精混合物为壁材,按照芯材比1:10制备桑椹红色素微胶囊,用于显微分析和稳定性考察。
由图6(a)、图6(b)的显微图像可知:在500、250 nm分辨率下均观察到桑椹花色素微胶囊具有完整的包合结构,微胶囊呈类圆形;其中的镶嵌物清晰可见,表明大豆分离蛋白和β-环糊精对桑椹红色素成分具有很好的包埋效果。
2.3.4 微胶囊稳定性考察结果的分析
由图7(a)可知,随着加热时间的增加,桑椹花色素及其微胶囊产品的保存率都有一定程度的下降,但微胶囊的下降幅度较小,表明由大豆分离蛋白和β-环糊精为壁材制备的微胶囊,能明显提高桑椹红色素的稳定性。另外,从图6(c)、图6(d)的显微图像可知,考察热稳定性后的桑椹微胶囊,经重新冻干,在500、250 nm分辨率下仍然可以观察到微胶囊的完整形态,因此,由大豆分离蛋白和β-环糊精为壁材制备的微胶囊具有比较稳定的结构。这也在一定程度上表明以上分子对接的预测结果与实际情况较为吻合。
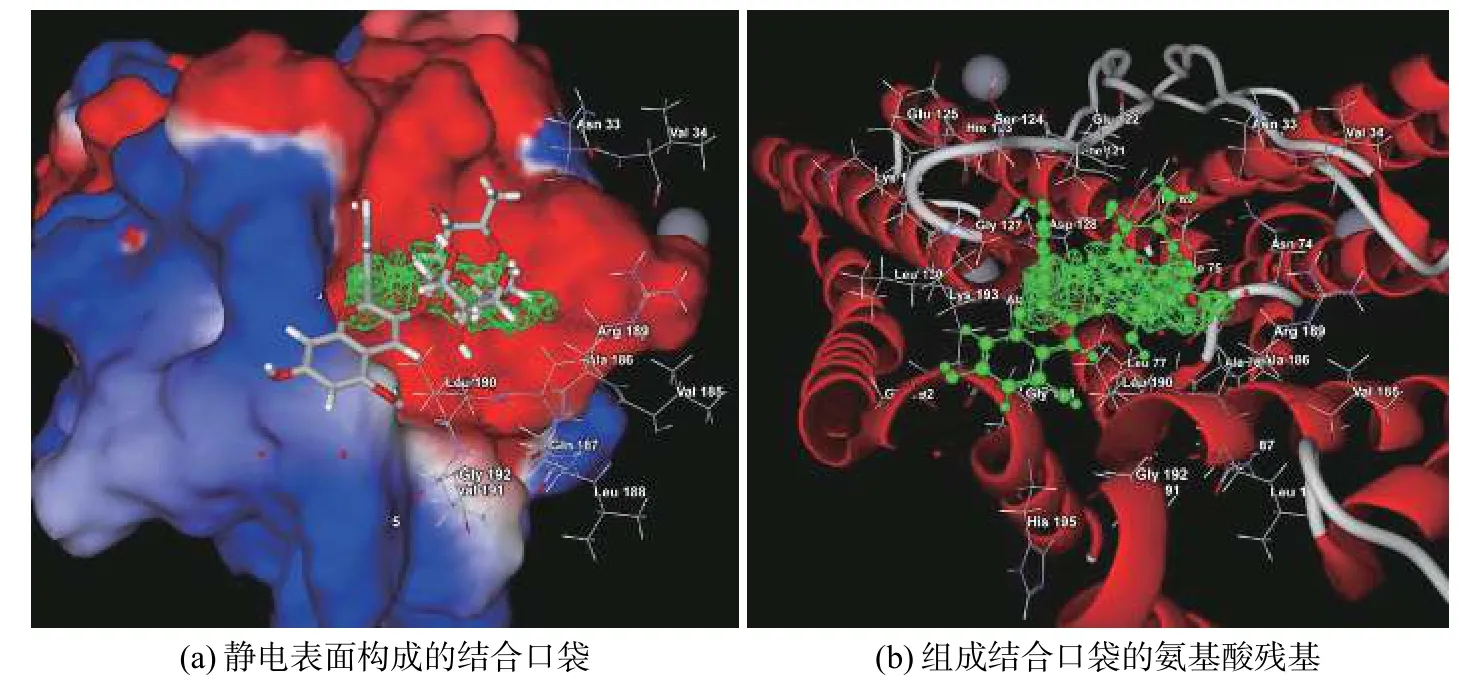
图3 6J4J中矢车菊素3-O-(6″-O-α-鼠李糖基-β-半乳糖苷)的结合位置和构象
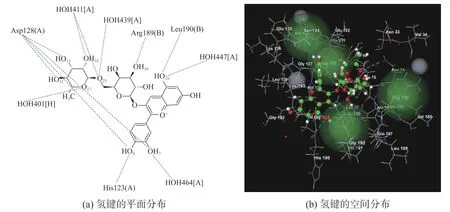
图4 矢车菊素3-O-(6″-O-α-鼠李糖基-β-半乳糖苷)与6J4J形成的氢键
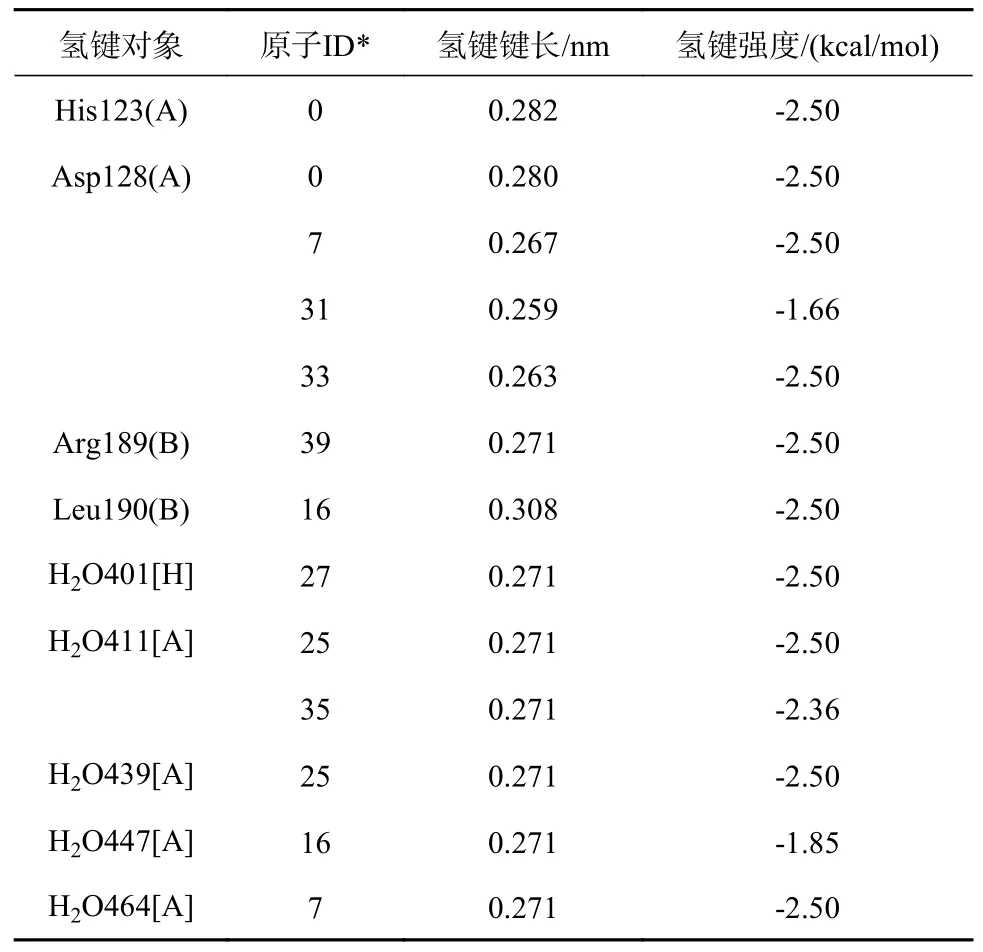
表4 矢车菊素3-O-(6″-O-α-鼠李糖基-β-半乳糖苷)与6J4J间的氢键
由图7(b)可知,随着光照时间的增加,桑椹红色素及微胶囊产品的保存率都有一定程度的下降,但微胶囊的下降幅度较小,表明由大豆分离蛋白和β-环糊精为壁材制备的微胶囊能够提高桑椹红色素的稳定性。
3 结论
经分子对接方法预测,大豆蛋白与桑椹红色素的主要成分矢车菊素3-O-(6″-O-α-鼠李糖基-β-半乳糖苷)的结合能力强于鸡蛋蛋白和牛奶蛋白,这为桑椹红色素微胶囊壁材的选择提供了导向;以大豆分离蛋白和β-环糊精作为微胶囊壁材,桑椹红色素的包埋率随大豆分离蛋白比例增加而增加,验证了分子对接的预测结果;显微分析表明该微胶囊具有稳定的结构;对热、对光稳定性试验表明该微胶囊能提高桑椹红色素的稳定性。因此,基于分子对接结果选择食品、药品原辅料的研究方法具有可行性。
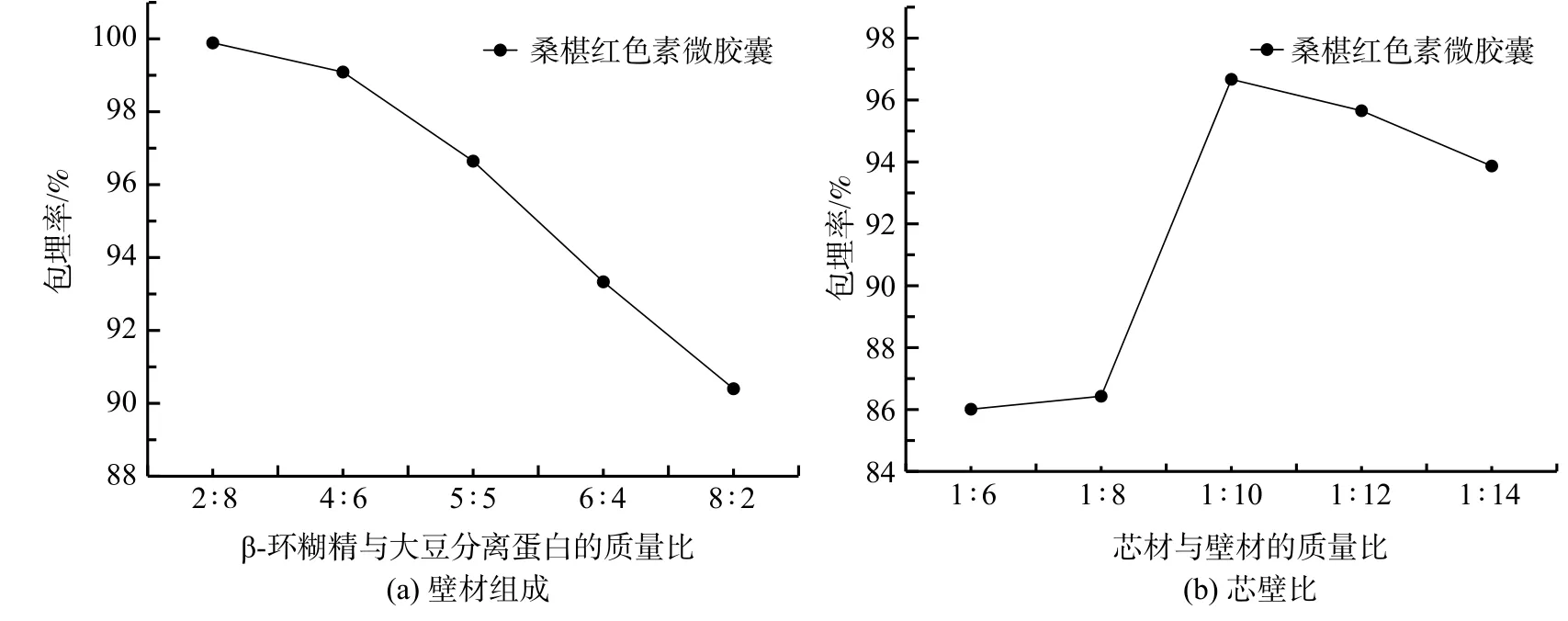
图5 微胶囊不同配方对包埋率的影响
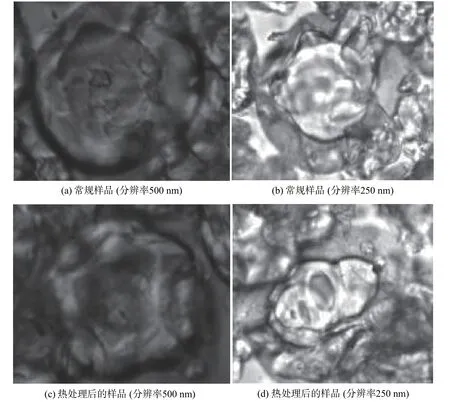
图6 桑椹红色素微胶囊显微图像
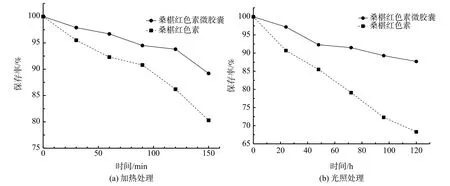
图7 加热和光照对桑椹红色素微胶囊稳定性的影响
致谢:丹麦Molegro ApS公司为本研究提供了Molegro Virtual Docker 软件,在此表示感谢。
