胶质瘤细胞中β-TrCP和Bmi-1之间可能的调节关系
2020-10-14倪卫娟倪殿军李归宿
倪卫娟,王 超,倪殿军,李归宿
(1.深圳市龙华区人民医院 神经内科,广东 深圳 518109;2.杭州市肿瘤医院 肿瘤科,浙江 杭州 310000;3.深圳市龙华区人民医院 神经外科,广东 深圳 518109)
神经胶质瘤是中枢神经系统的侵袭性恶性肿瘤。根据WHO制定的分级系统可将脑胶质瘤分为4级,其中1~2级者代表低级别胶质瘤,表示恶性程度较低、预后效果好;3~4级者代表高级别胶质瘤,表示恶性程度较高、预后效果差[1-2]。神经胶质瘤会影响大脑功能,倘若其生长位置特殊和生长速度较快还可能导致患者生命受到威胁,因此积极、有效治疗尤为重要[3]。目前,关于该病的治疗方法包括手术、放射疗法、化学疗法、靶向疗法和实验性临床试验[4]。然而,由于临床对于胶质瘤的发病机制尚不十分清楚,在外科手术和辅助治疗方面虽然取得了一定的进展,但恶性神经胶质瘤患者的生存时间几乎不会改善[5]。近年来随着分子生物学的发展,探究肿瘤侵袭的分子机制和新的治疗靶标为癌症治疗开辟了新的思路。
β-转导重复相容蛋白(Beta-transducinrepeats-containingproteins,β-TrCP)是F-box蛋白家族的成员,是SCF(Skpl-Cullinl-F-box)型泛素连接酶E3的关键组分。β-TrcpDg能够通过识别并泛素化降解特异性磷酸化底物,如IKB、β-catenin、Emil和Snail等进而对NF-κB信号通路、Wnt信号通路、细胞周期和细胞侵袭转移等进行调控,影响细胞的生长、分化、凋亡以及肿瘤的发生[6-7]。近年来,已鉴定出许多β-TrCP底物,包括Bmi1,β-catenin,Emi1等[8-9]。其中B细胞特异性莫洛尼鼠白血病病毒插入位点1(B-cell-specific Moloney murine leukemia virus insertion site 1,Bmi-1)在多种肿瘤中呈现高表达趋势[10-11]。尽管对β-TrCP的基本生物学和发病机理的理解已有实质性进展,但对β-TrCP在神经胶质瘤中的可能作用和临床意义了解甚少。对此,本研究通过临床组织样品和细胞实验来探索神经胶质瘤中β-TrCP与Bmi-1的上下游表达关系,为β-TrCP在人类神经胶质瘤进展中所产生的作用提供有关的重要数据。
1 材料与方法
1.1 材料
1.1.1 临床样本 收集我院神经外科手术后的脑胶质细胞瘤标本及非肿瘤脑组织标本,共收集临床组织样品78例。其中,WHO1~2级24例(WHO1~2),WHO3~4级38例(WHO3~4),非肿瘤脑组织临床样本16例(NC)。样本均保存于-80℃冰箱。
1.1.2 细胞 人神经胶质瘤细胞系(U87)购于中科院上海细胞库。
1.1.3 试剂 BMI1 Rabbit Polyclonal一抗,β-TrCP Rabbit Polyclonal一抗,β-actin Rabbit Monoclonal antibody一抗和羊抗兔IgG-HPR二抗抗体均购于武汉Proteintech公司;细胞培养基和胎牛血清均购于美国Gibco公司;蛋白定量试剂盒和荧光定量试剂盒购于上海贝博生物公司;腺病毒和转染试剂及siRNA均购于吉马基因公司。
1.2 方法
1.2.1 U87细胞培养 U87细胞用含有10%胎牛血清、青霉素(100 U/mL)和链霉素(100 μg/mL)的培养基在37℃,5%二氧化碳培养箱中培养。
1.2.2 U87细胞转染β-TrCP过表达腺病毒 培养U87细胞于六孔板中,细胞设置为3组,分别为空白对照组(NC,无添加)、阳性对照组(Control,添加无目的基因序列的病毒Vector)、实验组(ad-β-TrCP,添加含有β-TrCP基因的腺病毒)。正式实验之前检测不同浓度病毒转染效率,选取转染率90%左右病毒浓度用于实验。实验组将50 μL病毒原液加入培养液中稀释至1.5 mL,待细胞生长密度约70%分别加入1.5 mL 病毒稀释液于细胞中。在细胞感染后12~48 h之间更换培养基,摇匀。待细胞密度90%左右收取细胞样品于-80℃保存。
1.2.3 siRNA转染β-TrCP沉默 培养U87细胞于六孔板中,细胞设置为3组,分别为空白对照组(NC,只添加转染试剂)、阳性对照组(Control,添加转染试剂和无目的基因序列的siRNA)、实验组(si-β-TrCP,添加添加转染试剂和含有β-TrCP基因的siRNA)。正式实验之前,检测不同浓度siRNA的沉默效率,选取沉默效率70%左右siRNA浓度(100 nM)进行实验。实验组将siRNA加入培养液中稀释至1.5 mL,待细胞生长密度约70%分别加入细胞中。在细胞转染后12~48 h更换培养基,摇匀。待细胞密度90%左右收取细胞样品于-80℃保存。
1.2.4 实时荧光定量PCR检测组织标本β-TrCP及Bmi-1基因表达 利用TRizol法提取组织样品总RNA,反转录得到cDNA。设计合适的引物(序列见表1),按照荧光定量PCR试剂盒完成扩增反应,即95℃ 5min,95℃ 10 s和95℃ 45 s循环40次,结果以2-ΔΔCt计算相对表达量。

表1 实时荧光定量PCR引物序列
1.2.5 蛋白免疫印迹检测细胞样品β-TrCP及Bmi-1蛋白表达 向收集到的细胞样品中加入100 μL含有1%蛋白酶磷酸抑制剂的蛋白裂解液,裂解离心后取上清蛋白。使用BCA Protein Quantification Kit试剂盒测定蛋白浓度。使用SDS-PAGE电泳法分离蛋白,转膜后进行封闭,将一抗按要求稀释至最佳孵育浓度,4℃摇床一抗(BMI1一抗1∶2 000,β-TrCP一抗1∶2 000,β-actin一抗1∶5 000 )孵育过夜。第二天孵育二抗(羊抗兔IgG-HPR二抗1∶5 000)后进行ECL显色,Image lab进行扫描成像并处理图像和半定量分析。
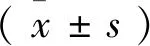
2 结果
2.1 临床样本中β-TrCP和Bmi-1的基因表达 如图1所示,与非肿瘤组织比较,不同级别胶质瘤组织样本中β-TrCP基因的表达水平均显著低于非肿瘤组织(P<0.01),Bmi-1基因的表达水平则显著高于非肿瘤组织(P<0.01)。其中,WHO3~4级胶质瘤的β-TrCP表达水平显著低于WHO1~2级别胶质瘤(P<0.05),但WHO3~4级胶质瘤的Bmi-1基因表达水平显著高于WHO1~2级别胶质瘤(P<0.05)。
A:实时荧光定量检测胶质瘤组织和非肿瘤组织中β-TrCP基因表达统计图,β-actin为内参;B:实时荧光定量检测胶质瘤组织和非肿瘤组织中Bmi-1基因表达统计图,β-actin为内参;采用t-test检验统计学差异,与NC组相比,*:P<0.05,**:P<0.01,***:P<0.001具有显著差异性。图1 β-TrCP和Bmi-1基因在胶质瘤组织和非肿瘤组织中的表达
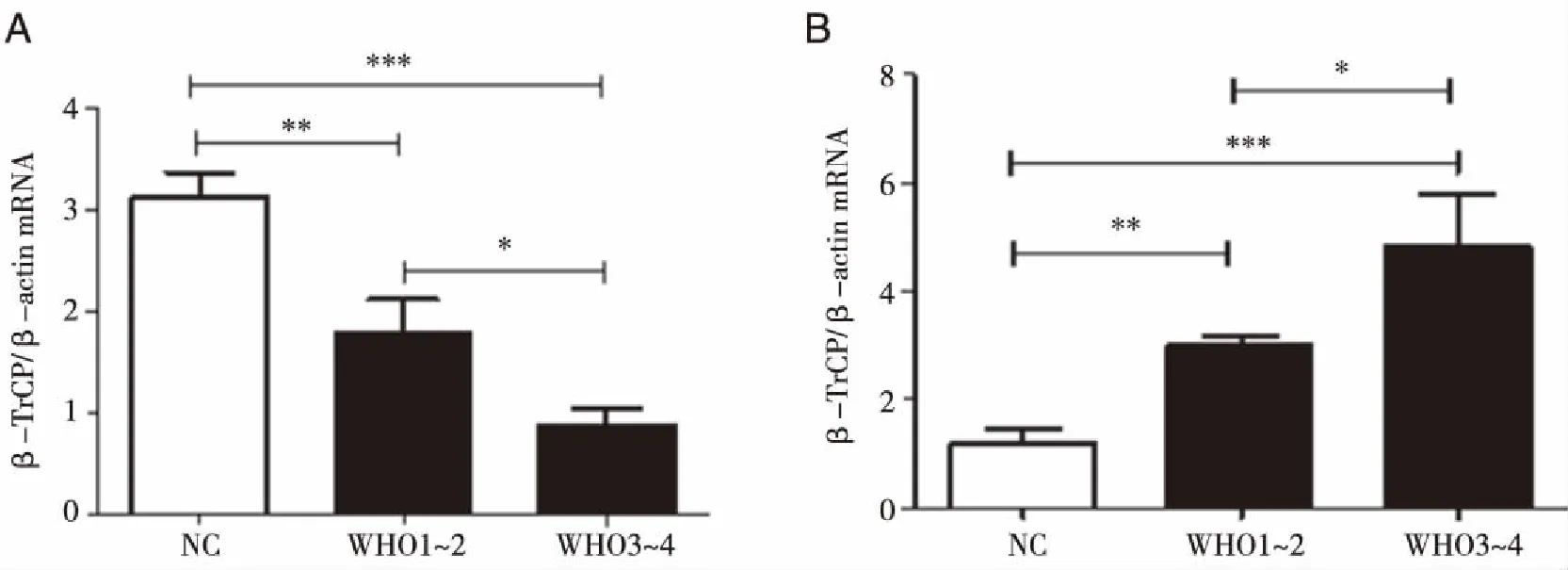
2.2 U87细胞中β-TrCP过表达后Bmi-1的蛋白表达 利用在U87细胞中感染腺病毒的方法使β-TrCP在细胞中高表达,实验结果如图2,感染带有目的基因片段的腺病毒后,U87细胞中β-TrCP蛋白表达显著增加,而Bmi-1蛋白的表达被抑制,呈现出低表达水平(P<0.001)。
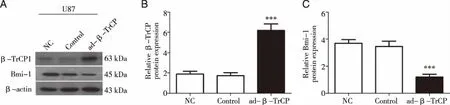
2.3 U87细胞中β-TrCP沉默后Bmi-1的蛋白表达 实验结果如图3,β-TrCP基因沉默表达后,U87细胞中β-TrCP蛋白表达被显著抑制,而Bmi-1蛋白的表达显著增加(P<0.01)。
A:蛋白免疫印迹检测β-TrCP和Bmi-1蛋白表达电泳图,β-actin为内参;B:3组细胞β-TrCP表达相对定量统计图;C:3组细胞Bmi-1表达相对定量统计图;采用t-test检验统计学差异,与NC组相比,***:P<0.001具有显著差异性。图2 在U87细胞中过表达β-TrCP后检测β-TrCP和Bmi-1的蛋白表达
A:蛋白免疫印迹检测β-TrCP和Bmi-1蛋白表达电泳图,β-actin为内参;B:3组细胞中β-TrCP表达相对定量统计图;C:3组细胞中Bmi-1表达相对定量统计图;采用t-test检验统计学差异,与NC组相比,**:P<0.01,***:P<0.001具有显著差异性。图3 在U87细胞中沉默β-TrCP后检测β-TrCP和Bmi-1的蛋白表达
3 讨论
神经胶质瘤是一种发生在大脑和脊髓中的肿瘤,其始于周围神经细胞及帮助其发挥功能的胶状支持细胞,如神经胶质细胞。像大多数原发性脑肿瘤一样,胶质瘤的确切原因尚不清楚,但其发病率居神经系统肿瘤首位,根据WHO分型共分为4级。其中,1级和2级胶质瘤细胞生长较缓慢,又称作低级别胶质瘤,而生长较为快速的3级和4级则被定义为高级别胶质瘤。近年来,随着靶向治疗的发展,探究疾病的发生机制并寻找治疗的基因靶点对神经胶质瘤的临床诊疗至关重要。
哺乳动物会表达两个β-TrCP旁系同源物,分别为β-TrCP1和β-TrCP2。两者具有相似的氨基酸序列和功能。有研究表明,β-TrCP可以在人骨肉瘤细胞系U2OS中泛素化降解Bmi-1蛋白从而达到治疗的目的[12]。结合文献,我们推测在胶质瘤中β-TrCP可能也存在着可以下调Bmi-1的机制功能。在我们的研究中,与非肿瘤组织相比,胶质瘤组织中β-TrCP1呈现低水平表达,但Bmi-1基因表达水平显著较高;且与低级别胶质瘤(WHO1~2)相比,高级别胶质瘤(WHO3~4)的β-TrCP1基因表达显著降低。可以推测,β-TrCP1和Bmi-1在肿瘤组织中具有特征性表达。此外,在U87细胞中沉默β-TrCP1表达足以引起Bmi-1蛋白积聚,但过表达β-TrCP1则显著抑制Bmi-1蛋白表达,这说明β-TrCP1和Bmi-1具有显著相关性。大量文献表明,β-TrCP1和β-TrCP2均具有一个保守的功能模块F-box域,该模块将底物桥接至功能性E3泛素SCF复合体,而β-TrCP1促进降解的能力在很大程度上取决于其与底物的磷酸化依赖性结合[13]。本文的研究数据也表明Bmi-1的基因表达在某种程度上受到β-TrCP1的调控。
随着研究的深入,多种β-TrCP 底物陆续被发现,其中Emi1主要通过对细胞周期和细胞周期相关的蛋白因子的调节来实现β-TrCP的调控。在多种肿瘤细胞中,Bmi-1呈现高表达水平并通过参与肿瘤细胞周期调节肿瘤发生[14]。有研究发现,在某些人大肠肿瘤中,β-catenin的积累与高水平的β-TrCP1伴随。此外,β-TrCP的积累还会增加NF-κB的反式激活,这暗示由Wnt的持续激活或β-连环蛋白或APC中的致癌突变引起的β-连环蛋白的稳定可能有助于肿瘤细胞依赖NF-κB的存活[15]。在前列腺癌中,β-TrCP的过度表达即能够提高HIF-1的转录活性,降低β-TrCP的表达成为抗肿瘤治疗的新途径[16]。另有报道发现,β-TrCP可通过促进泛素蛋白水解作用,抑制血管生成以及甲状腺癌细胞迁移或减弱癌细胞增殖侵袭能力[17]。然而,由于内源性β-TrCPs呈低水平表达,其功能很容易被显性负性构建体或抑制性底物抑制[18]。
在本研究中,我们发现上调β-TrCP1蛋白表达水平,会导致Bmi-1蛋白表达下调,提示Bmi-1蛋白表达下调可能是由β-TrCP1介导的翻译后修饰反应所引起。随后进一步研究β-TrCP1与Bmi-1表达存在的相关性。实验表明,在siRNA敲低β-TrCP1表达后,Bmi-1表达显著提高;而在β-TrCP1过表达后,Bmi-1表达显著降低。结合以往研究[19]分析可知,β-TrCP1与Bmi-1表达具有上下游的调节关系。
综上,本次研究结果显示β-TrCP和Bmi-1的表达与胶质瘤具有密切关系。Bmi-1作为β-TrCP的底物,与β-TrCP之间具有相互调节关系,即β-TrCP的高表达会抑制Bmi-1的表达,而β-TrCP的低表达会解除对Bmi-1的抑制作用。这种相互关系对研究胶质瘤的病理特征及疾病靶标具有参考作用。
