儿童粪便中四环素耐药菌分离鉴定及四环素耐药基因分析
2020-10-14徐先林孙泽敏欧刚卫
徐先林,文 雯,孙泽敏,欧刚卫
(遵义医科大学 生物化学与分子生物学教研室,贵州 遵义 563099)
抗生素的滥用或习惯性使用[1-2]导致耐药菌大量出现和各类抗生素耐药基因(Antibiotic resistance genes,ARGs)在不同生态系统中转移和传播[3]。人类肠道中多种微生物共存,细菌通过水平基因转移等[4]方式交换基因片段。已发现人类肠道微生物包含超过6 000种ARGs[5],ARGs在肠道菌群间广泛转移可能破坏肠道菌群稳态,对人体健康造成威胁。
虽然临床已经多年很少使用四环素(Tetracycline, TC)类抗生素治疗或预防感染性疾病[6],但TC仍被大量用于防治多种动物疾病以及家禽和家畜饲养中[7],未被充分利用或代谢的TC被大量排泄到环境中[8]。我国不同地区和许多国家的污水和地表水等环境中均检测到高浓度的TC残留[9-10],残留的TC对生态系统中细菌产生选择压力,并通过移动基因元件(Mobile genetic elements,MGEs)[11-12]在细菌间转移。肠道微生物群长期暴露于亚剂量TC中,有利于潜在耐药菌生长[13]。
肠道菌群具有高度抗生素耐药性[14],目前对无抗生素使用史肠道耐药菌及相应ARGs特征的认识仍不清楚。本研究从儿童粪便中筛选TC耐药菌并评估细菌携带TC耐药基因情况,了解肠道内可培养TC耐药菌分布并分析耐药基因与耐药相关性,探讨儿童肠道菌群携带TC耐药基因的特点与规律。
1 材料与方法
1.1 材料
1.1.1 粪便标本采集 本研究招募了遵义市儿童4例(见表1),均无TC使用史,征得监护人同意后采集新鲜粪便样本置于无菌EP管中,样品编号为Z-1、Z-2、Z-3、Z-4,低温条件运至实验室,保存于-80℃,并尽快进行后续实验。

表1 受试者的基本情况
1.1.2 主要药物与试剂 四环素药敏片(杭州微生物试剂有限公司);四环素盐酸盐(50 mg/mL)(上海生工);营养琼脂培养基、麦康凯培养基、脑心浸液培养基、布氏琼脂(青岛海博生物);MH培养基(索莱宝生物);DNA分子量标准(碧云天生物);PCR Master Mix(2×)(Fermentas公司);GoldView核酸染料(碧云天生物);引物(上海生工);其它试剂为国产分析纯。
1.2 方法
1.2.1 TC耐药菌株分离与保存 将粪便样本分区划线接种于TC选择性培养基中进行耐药菌株的筛选与分离,TC筛选浓度(150 μg/mL)参考文献[15]。为了尽可能筛选出更多细菌,采用多种培养基分别在有氧和厌氧条件下培养粪便样本。有氧条件:蘸取少许样本用分区划线法接种于新配制的营养琼脂、脑心浸液、麦康凯、血平板等培养基中,置于37℃培养箱中培养24 h;随机挑取平板上菌落外观形态不同(大小、形态、颜色、边缘情况、表面光泽、质地和透明度等)的菌落数个,分区划线接种于新的平板上,37℃培养24 h;重复纯化2~3次,直至平板上形成外观形态单一的菌落。厌氧条件:挑取少许样本分区划线接种于新配制的脑心浸液和血平板中,迅速放入3.5 L厌氧罐,并立即放入厌氧产气袋(3.5 L,日本三菱),封闭厌氧罐,置于37℃培养箱中培养72 h,同时以接种破伤风杆菌(本校微免实验室提供)的平板作为厌氧条件验证;随机挑选平板上形态不同的菌落数个,置于厌氧条件下37℃培养48~72 h;重复纯化2~3次直至厌氧纯化平板上形成单一菌落。保存所有菌株,非厌氧菌置于含20%甘油的液体培养基中保存于-80℃;厌氧菌采用半固体穿刺保存。
1.2.2 革兰氏染色 采用革兰氏染色对细菌进行初步分类鉴定,确定革兰氏染色情况。革兰氏染色具体步骤参考文献方法[16],简单描述为如下8步:涂片、晾干、固定、染色、媒染、脱色、复染、镜检。
1.2.3 分子生物学鉴定 采用16S rRNA基因PCR扩增法进行细菌鉴定,扩增通用引物见表2。PCR模板制备:取菌体少许加入100 μL无菌水中,涡旋混匀后置于沸水浴中加热10 min,稍冷后12 000 rpm离心1 min,上清液作为模板直接用于16S rRNA基因PCR扩增。扩增体系(50 μL):上游引物(10 pmol/μL) 1 μL;下游引物(10 pmol/μL)1 μL;PCR Master Mix(2×) 25 μL;模板(空白对照组以蒸馏水代替)5 μL;蒸馏水 18 μL。扩增条件:94℃预变性5 min;94℃变性45 s,56℃退火45 s,72℃延伸90 s,30次循环;72℃延伸10 min;4℃保存。PCR结束后取扩增产物5 μL进行1%琼脂糖凝胶电泳,设定恒压120V,电泳35min;在凝胶成像系统(Bio-RAD公司)下观察结果,将能清晰分辨出目的条带且具有一定亮度的PCR产物送至上海生工武汉测序部进行测序。将测序结果与GenBank中已知菌株的16S rDNA 序列进行同源性对比鉴定细菌。鉴定方法参考文献[17]。

表2 引物序列信息
1.2.4 TC药敏试验 对所有细菌均进行TC药敏试验,非厌氧菌采用K-B纸片琼脂扩散法,厌氧菌则采用琼脂稀释法。K-B纸片琼脂扩散法:取菌落移至3~4 mL无菌生理盐水中,涡旋振荡混匀,用细菌比浊仪(法国梅里埃)调整其比浊度为0.50个麦氏比浊单位;无菌棉拭子蘸取菌液,均匀涂布于MH琼脂平板表面,室温下干燥3~5 min,用无菌镊子取TC药敏纸片(含药量30 μg/片)紧贴于平板表面,药敏纸片距平板内缘>15 mm,纸片之间距离不小于24 mm。将平板翻转后置于37℃培养16~18 h,测量抑菌圈大小。根据CLSI(美国临床与实验室标准化协会)标准(见表3),对各菌做出“敏感”、“中介”、“耐药”的判断。琼脂稀释法:取菌落直接悬浮于布氏肉汤培养基中,涡旋混匀,用细菌比浊仪调节菌液浊度为0.5个麦氏浊度单位。准确量取已经校正比浊度的菌液各2 μL分别滴在在含不同浓度TC(0、2、4、8、16、32、150 μg/mL)的强化布氏琼脂平板上。待平板吸收完菌液后翻转平板,迅速放入厌氧条件,37℃培养42~48 h观察结果,判读最小抑菌浓度(MIC)终点。与无TC(0 μg/mL)的平板对比,细菌生长显著减少的TC浓度即为MIC值,并根据CLSI标准做出敏感(≤4 μg/mL)、中介(8 μg/mL)和耐药(≥16 μg/mL)的判断。

表3 K-B纸片扩散法TC药敏判读标准
1.2.5 TC耐药基因检测 对分离的细菌进行tet(A)、tet(B)、tet(G)、tet(L)、tet(M)、tet(O)、tet(Q)、tet(W) 8种四环素耐药基因PCR扩增,引物由上海生工生物工程有限公司合成,引物基本信息见表2。PCR模板制备方法同1.2.3。扩增体系20 μL:16S rRNA基因上游引物(10 pmol/μL)0.5 μL,16S rRNA基因上游引物(10 pmol/μL)0.5 μL,TC耐药基因上游引物(10 pmol/μL)0.5 μL,TC耐药基因下游引物(10 pmol/μL)0.5 μL,PCR Master Mix(2×)10 μL,模板(空白对照以蒸馏水代替)3 μL,蒸馏水5 μL。扩增程序:94℃预变性5 min;94℃变性45 s,退火温度(见表2)45 s,72℃延伸90 s,30个循环;72℃延伸10 min;4℃保存。电泳检测:取PCR扩增产物5 μL进行1.5%琼脂糖凝胶电泳,调整电压为120 V,电泳40 min后用凝胶成像系统观察结果。

2 结果
2.1 细菌鉴定 通过TC筛选培养基进行粪便培养,挑选出190个菌落进行纯化培养,但在纯化过程中有6株细菌未生长,对余下184株细菌进行革兰氏染色和16S rRNA基因测序鉴定。革兰氏染色结果显示,各细菌涂片清晰、颜色单一、细菌形态一致,无形态多样和染色同时出现紫色和红色及染色不清楚的情况(见图1),表明各菌株已经完全纯化,可以用于后续实验;通用引物扩增的16S rRNA基因大小约为1500 bp,采用双向测序,将测序结果用SeqMan软件去除测序图谱两端峰形较乱的序列,拼接双向测序结果,查找并修正其中拼接错误。采用16S rRNA基因测序鉴定显示共分离出163株非厌氧菌和21株厌氧菌,其中大肠杆菌、肠球菌、双歧杆菌、迟缓埃格特菌、产气柯林斯菌是主要细菌种类。4例粪便样本的细菌分离鉴定结果见表4。
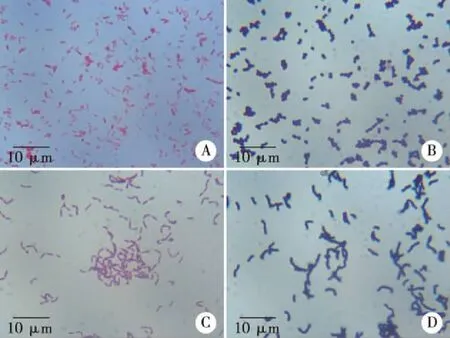
A:大肠杆菌;B:鸟肠球菌;C:青春双歧杆菌;D:产气柯林斯菌。图1 部分菌株革兰氏染色结果(倍数10 ×100)

表4 4例样本中分离鉴定的细菌
2.2 TC药敏试验 所有细菌均进行TC药敏试验,部分TC药敏结果如图2。由药敏试验结果(见表5)可知,184株细菌表型耐药率为93.5%,表型敏感率为6.5%,无中介率。大肠杆菌耐药率为91.8%,肠球菌、双歧杆菌、产气科特斯菌、迟缓埃格特菌耐药率均为100%。9株敏感大肠杆菌均来Z-1样本,另外3株敏感菌来自Z-3和Z-4。全部细菌药敏试验统计结果见表5。
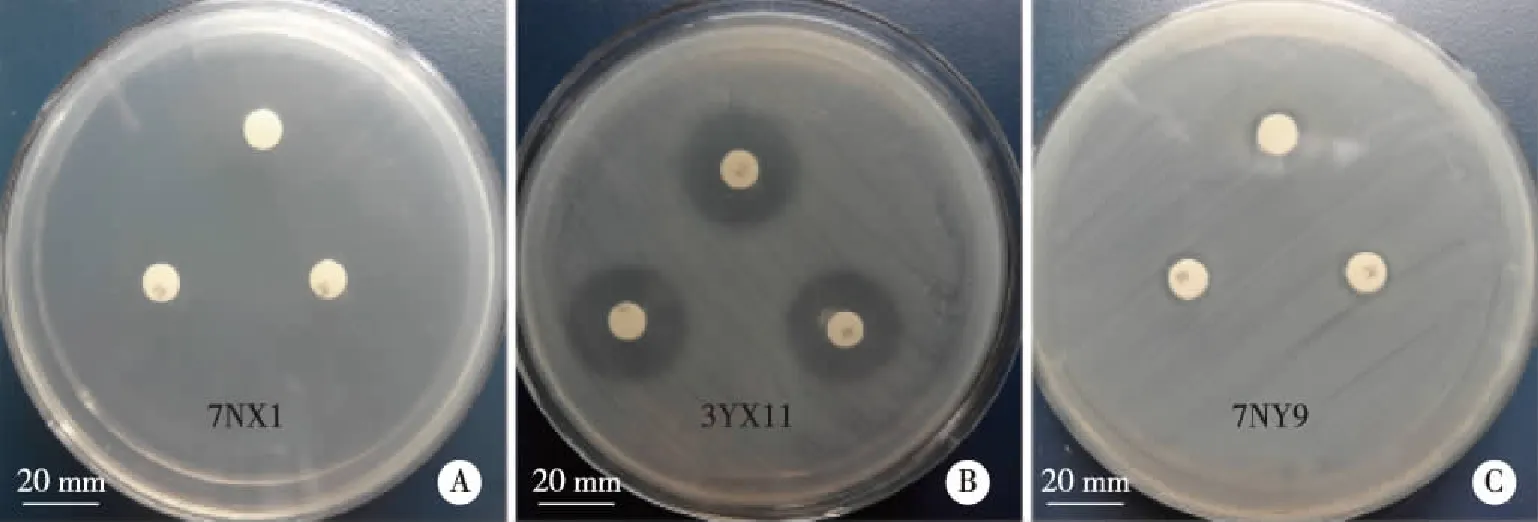
A:屎肠球菌;B:大肠杆菌;C:大肠杆菌。图2 部分细菌K-B纸片扩散法四环素药敏试验结果
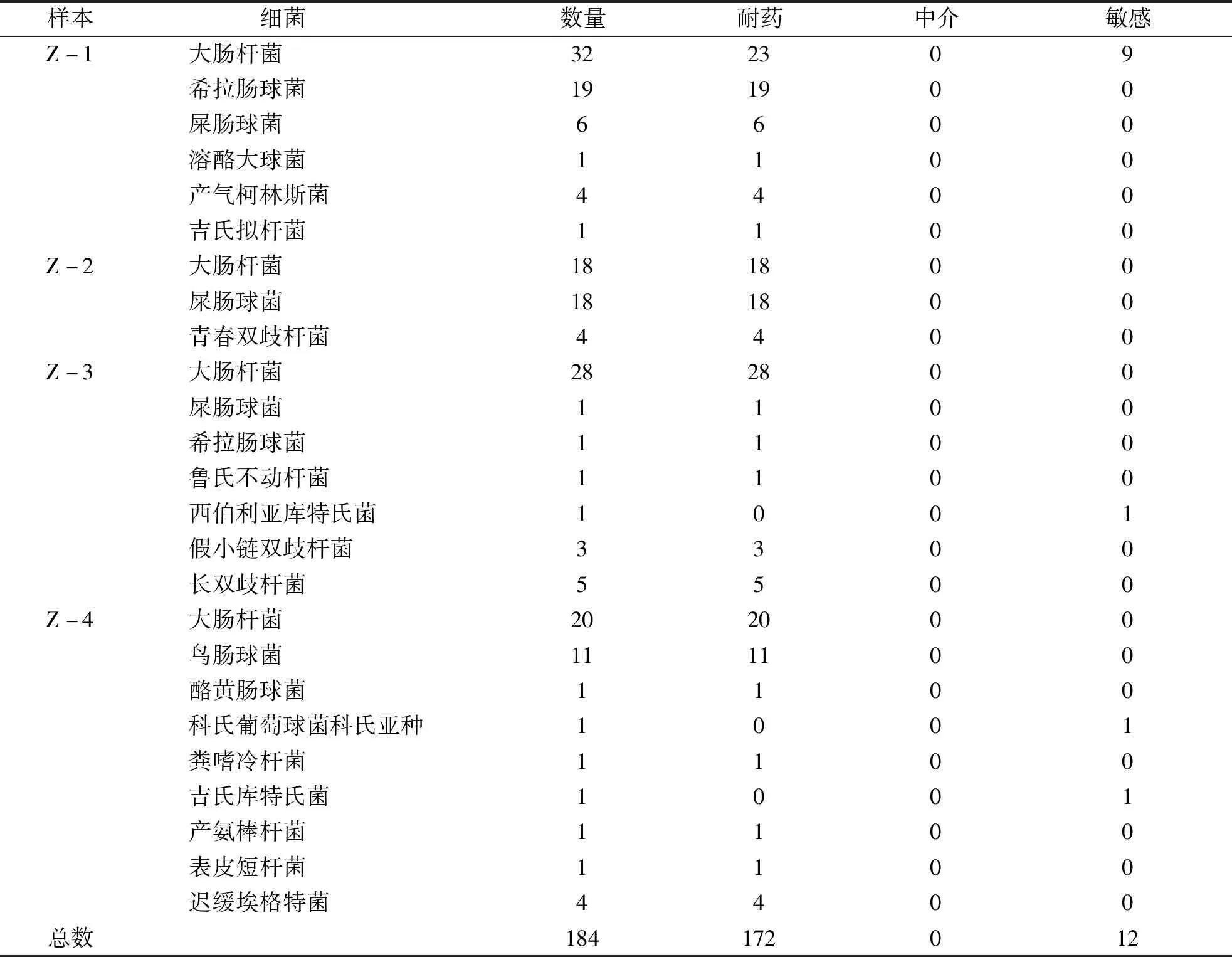
表5 184株细菌四环素药敏试验结果
2.3 TC耐药基因扩增 根据PCR产物琼脂糖凝胶电泳结果判断是否扩增出目标耐药基因,部分菌株耐药基因PCR产物电泳结果见图3。如表6、7所示,184株细菌中耐药基因总检出率为83.2%,12株TC敏感菌未检出任何耐药菌基因;其中tet(B)、tet(M)、tet(Q)、tet(W)、tet(A)检出率分别为18.5%、32.1%、0.5%、8.7%、23.4%,未检出耐药基因比例为16.8%;172株耐药菌中耐药基因检出率为89.0%,其中大肠杆菌主要检测出tet(A)和tet(B),肠球菌全部检测到tet(M),双歧杆菌全部检测到tet(W),产气柯林斯菌全部检出tet(W),19株耐药菌(11.0%)未检测到上述8种基因;所有细菌均未检测到2种以上的耐药基因,无细菌扩增出tet(G)、tet(L)、tet(O)。

A:DNA分子量标准;B:部分菌株tet(W)基因PCR扩增产物电泳图,可见目的条带(168 bp)和16S rRNA条带(1500 bp);C:部分菌株tet(G)基因PCR扩增产物电泳图,可见16S rRNA条带(1500 bp),未见目的条带(662 bp)。图3 部分耐药基因PCR产物电泳图
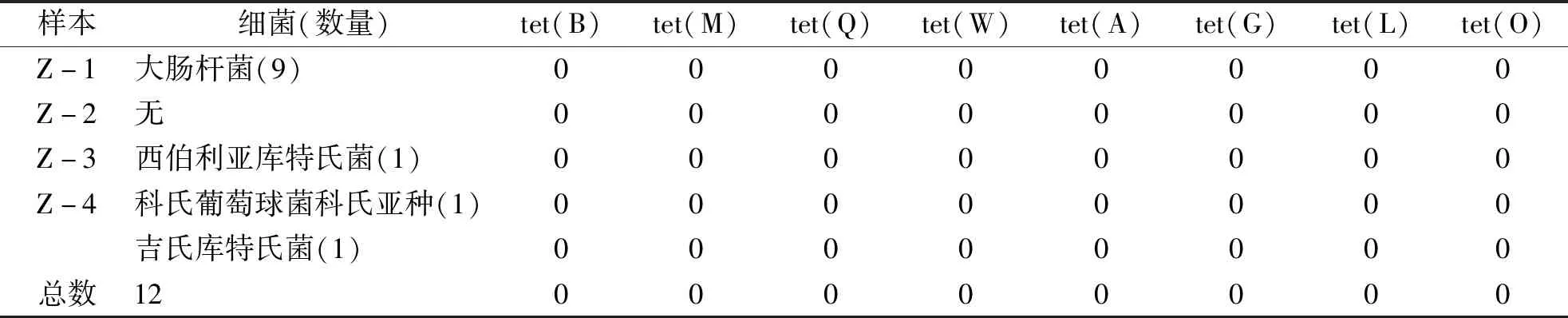
表6 四环素敏感菌耐药基因PCR扩增结果
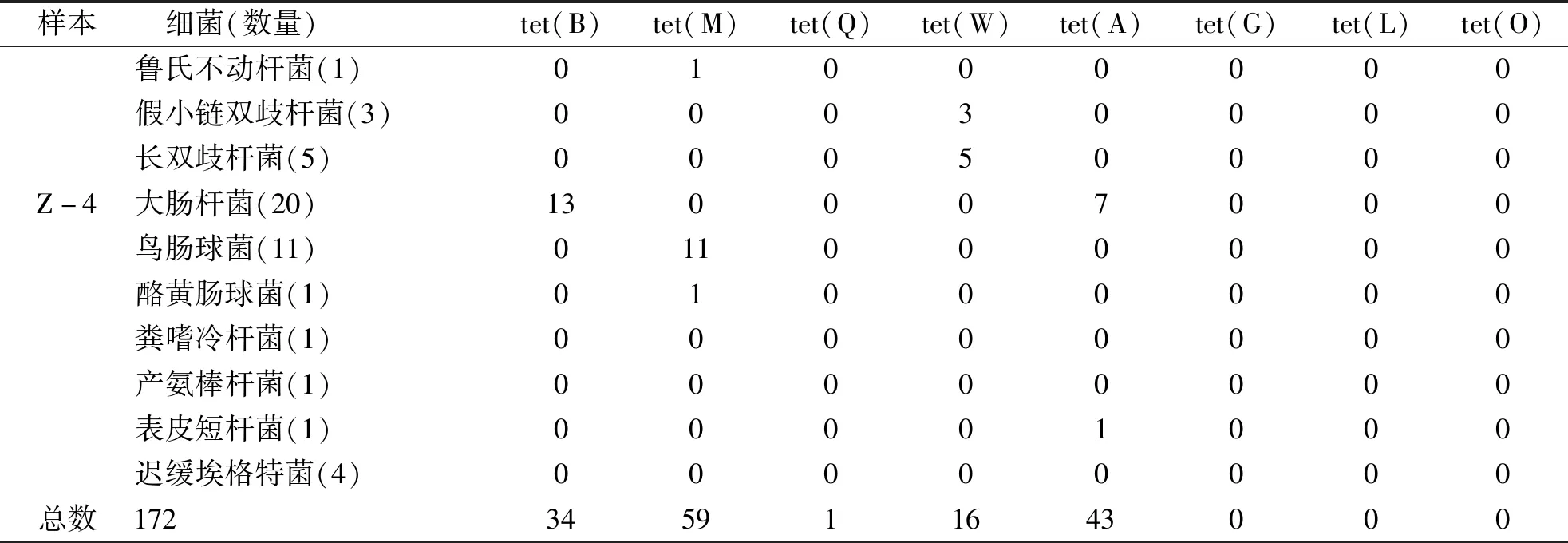
(续表7)
2.4 携带tet(A)与tet(B)的大肠杆菌抑菌圈大小比较 4个样本耐药基因检出率分别为92.6%、95.0%、82.1%、84.6%,耐药基因检出率较高;各样本中大肠杆菌携带tet(A)与tet(B)比例差异较大,Z-1中tet(B)检出率为30.9%,tet(A)检出率为17.4%;Z-2中无细菌检测出tet(B)基因,tet(A)检出率为88.9%;Z-3中tet(B)为检出率21.4%,tet(A)为检出率53.6%;Z-4中tet(B)检出率为65.0%,tet(A)检出率为35.0%。统计4个样本中所有耐药大肠杆菌药敏及耐药基因检测情况发现,tet(B)阳性大肠杆菌药敏抑菌圈明显小于tet(A)阳性大肠杆菌(见表8,图4),差异具有统计学意义(P<0.05),抑菌圈越小表明敏感性低、耐药性更强。

表8 K-B纸片扩散法四环素药敏试验抑菌圈大小
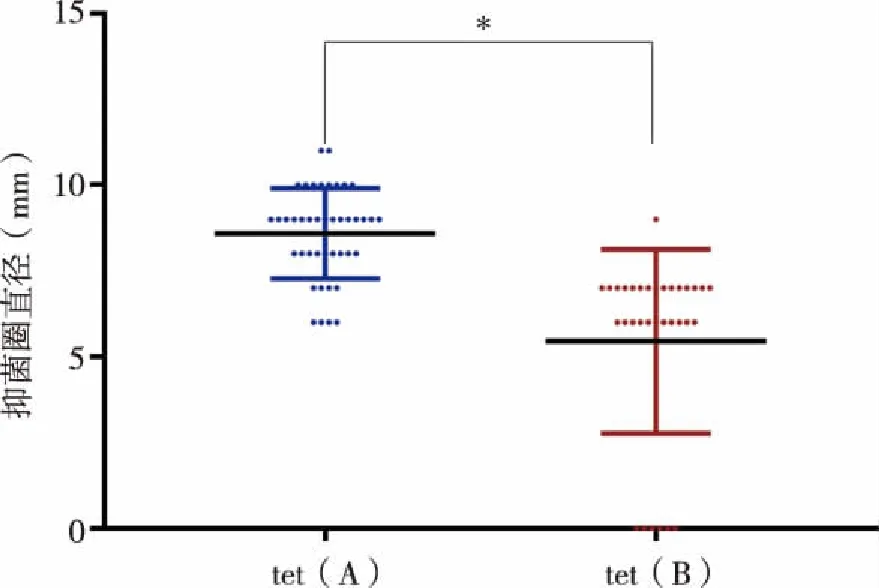
图4 tet(A)阳性大肠杆菌与tet(B)阳性大肠杆菌抑菌圈直径比较
3 讨论
由于肠道菌群的复杂性及细菌培养技术的限制,分离的细菌种类和数量有限,不能全面分离肠道菌群中TC耐药菌。但在现有技术条件下,通过细菌培养和PCR扩增等技术,分析肠道菌群TC耐药情况、分析肠道细菌耐药基因携带特点,对于初步了解儿童肠道菌群中可培养TC耐药菌及TC耐药基因携带情况,有助于深入了解耐药基因在儿童肠道菌群中的分布状态、存在方式和对儿童肠道菌群组成及远期健康的影响。本研究从4例儿童粪便中分离、鉴定出184株细菌(见表4),细菌种类在样本间有较大差异,除了受可培养方法的缺陷及筛选细菌数量较少有关外,还因肠道微生物群在生命早期随肠道发育而形成,易受多种因素影响[23],如肠道类型、出生胎龄、分娩类型、母乳喂养方法、断奶期、生活方式、饮食习惯等。
虽然预先通过多种高浓度TC选择性培养基筛选耐药菌,然而TC药敏试验结果显示:184株细菌中172株细菌为TC耐药,另外12株表现出对TC敏感。当通过高浓度的TC(150 μg/mL)筛选时,耐药菌株能够存活,其中有一些短暂性耐药菌株,去除筛选压力之后倾向于丢失存在于染色体外的耐药基因[2]恢复其敏感状态。在后续纯化过程中去除TC的选择性压力后,携带耐药基因对宿主将是不利因素,细菌会有丢失抗性基因的趋势,尤其是位于质粒中的耐药基因,可能重新建立其最初的敏感状态,因此药敏试验中有少数细菌为敏感菌。结果中敏感细菌不携带任何耐药基因,耐药细菌耐药基因检出率高达89.0%,表明细菌耐药是由于耐药基因的表达。肠道是转运ARGs的良好生态系统,肠道微生物群构成了一个巨大的ARGs储蓄库。研究者通过成对比较建模方法从人类肠道菌群中鉴定出超过6 000种抗生素耐药基因[5],表明肠道环境中抗生素耐药基因的巨大多样性。课题组前期研究结果也已经表明无TC直接使用史儿童粪便中存在着tet(B)、tet(Q)、tet(M)等多种TC耐药基因(结果未展示),但并不清楚耐药细菌携带何种耐药基因。本研究通过分离TC耐药菌探讨多种TC耐药基因携带情况。tet(A)、tet(B)、tet(G)、tet(L)、tet(M)、tet(O)、tet(Q)、tet(W)是常见的TC耐药基因,tet(A)、tet(B)、tet(G)、tet(L)编码外排泵蛋白,tet(M)、tet(O)、tet(Q)、tet(W) 编码核糖体保护蛋白[24]。本实验通过PCR扩增上述8中耐药基因,结果显示不同耐药基因检出率各不相同(见表7),而且样本间各耐药基因检出率差异较明显。大肠杆菌、肠球菌、双歧杆菌及产期柯林斯菌是分离的主要细菌种类,属于肠道共生菌。肠道共生菌是天生抗生素耐药菌[14],大肠杆菌主要检测到tet(A)、tet(B),肠球菌全部携带tet(M),双歧杆菌和产气柯林斯菌全部检测到tet(W),表明特定种属细菌可能携带不同优势耐药基因[24],且不能在物种间转移[5,25]。虽然现已知肠道耐药基因种类庞大,但不同耐药基因检出率可能和细菌种类密切相关,表明细菌多样性影响耐药基因的检出率。抗生素在环境中高度残留[9]及TC耐药基因在环境中呈多样性[26],健康人群通过环境暴露和饮食摄取,肠道微生物群长期暴露于亚治疗剂量TC中,但结果中耐药菌均检测出单一耐药基因并无两种及以上耐药基因检测情况,表明肠道细菌无TC直接筛选压力,细菌耐药强度比预期要低。由于细菌耐药基因的表达是耗能的,携带耐药基因并表达对细菌是不利因素[27],细菌倾向携带更少的耐药基因。
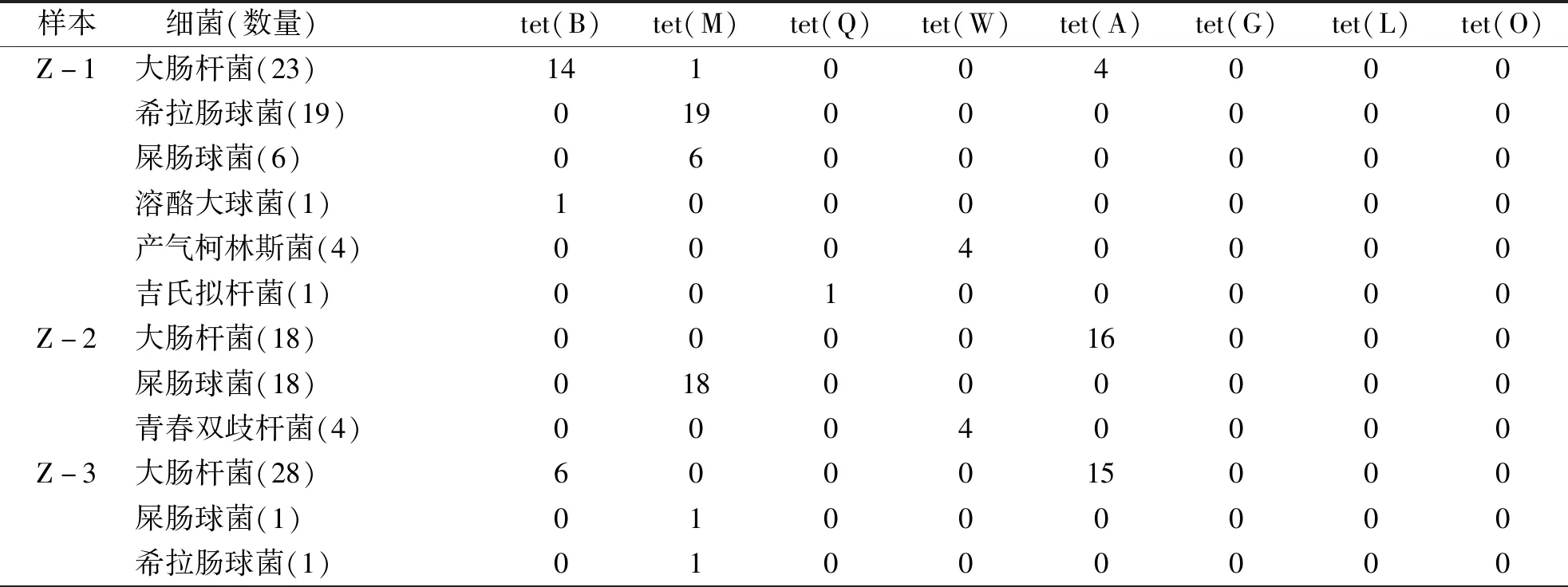
表7 四环素耐药菌耐药基因PCR扩增结果
tet(A)、tet(B)均编码外排泵蛋白,结果显示tet(B)阳性大肠杆菌药敏实验中抑菌圈直径明显小于tet(A)阳性菌株(P<0.05),与Karami研究[28]结果相似,表明携带tet(B)基因的菌株耐药强度可能大于tet(A)基因携带者。4份粪便样本tet(B)和tet(A)阳性大肠杆菌比例差异较大(见表7),表明个体差异可能导致细菌携带不同耐药基因呈现不同耐药强度,由于代谢状态会影响细菌对抗生素的耐药性[29],推测这种差异可能和代谢差异有关。
因此,耐药除了与耐药基因表达耐药蛋白有关外,还可能与细菌自身代谢状态有关。结果中11.0%的耐药菌未检测到任何耐药基因,可能携带着其它未检测的耐药菌基因,更可能是它们属于表现耐药,即为持留菌[30],并不携带任何耐药基因,其耐药机制可能涉及细胞代谢状态改变。细菌对亚治疗水平的TC暴露反应具有种特异性、浓度依赖性,因特定细菌比例不同导致肠道细菌代谢状态不同[31],细菌代谢状态影响细菌对抗生素的耐药性,细菌代谢生理的变化影响细菌对抗生素的敏感性而促进耐药与持留产生,调节细菌代谢能够恢复抗生素敏感性[32]。既然细菌代谢与耐药有关,那细菌代谢是否又会影响耐药基因种属特异性?肠道菌群庞大,抗生素与细菌之间的相互作用及其对宿主的影响非常复杂,细菌代谢如何影响抗生素耐药值得进一步研究。
人体即使无直接TC使用史,其肠道菌群仍受到环境或食物来源的多种抗生素的影响,不同耐药菌携带着种属特异性耐药基因;不同个体间的大肠杆菌可能携带不同优势耐药基因而表现出不同的耐药强度。由于样本间细菌耐药率和耐药菌显现出差异性,那么这些差异是否和肠道菌群代谢密切相关?TC对肠道菌群代谢的影响及菌群整体代谢状态如何影响细菌耐药性仍有待探讨。
