恶性实体肿瘤患者外周血T细胞中PD-1、LAG-3、TIM-3的表达情况
2020-10-13陈继中朱亦林韩兴华潘跃银
袁 园,陈继中,朱亦林,张 盛,韩兴华,潘跃银
免疫治疗是肿瘤治疗学中继手术、化疗、放疗之后另一个重要的发展突破口。第一代免疫检查点细胞毒性T淋巴细胞相关分子4(cytotoxic T lymphocyte-associated molecule-4,CTLA-4)、程序性细胞死亡受体-1(programmed cell death receptor-1,PD-1)、程序性细胞死亡配体-1(programmed cell death ligand-1,PD-L1)的抑制剂已经成为部分晚期肿瘤的治疗策略,然而这些药物仅在少数患者(20%左右)中有效[1],这可能与肿瘤细胞利用了其他抑制性通路来逃逸免疫攻击有关。除CTLA-4和PD-1/PD-L1之外,新兴免疫检查点分子如淋巴细胞活化基因3(lymphocyte activation gene-3,LAG-3)、T细胞免疫球蛋白黏蛋白3(T cell immunoglobulin and mucin domain-3,TIM-3)、具有Ig和ITIM结构域的T细胞免疫受体(T cell immunoreceptor with Ig and ITIM domains,TIGIT)等不断涌现[2]。该研究对恶性实体肿瘤患者外周血淋巴细胞亚群及CD4+T细胞、CD8+T细胞上免疫检查点PD-1、LAG-3、TIM-3的表达水平进行探究,以期为恶性肿瘤患者的多靶点联合免疫治疗提供理论依据。
1 材料与方法
1.1 病例资料选取2019年1~12月在铜陵市人民医院住院治疗的恶性实体肿瘤患者30例,其中男16例,女14例,年龄范围47~93岁,中位年龄67(58,74)岁。入组标准:所有患者均经组织病理学确认为恶性实体肿瘤,排除血液系统肿瘤,患者无自身免疫性疾病,近期未进行放疗或化疗,近期无严重病毒、细菌等病原体感染。另选取15例该院体检中心的健康体检者做为健康对照组,其中男8例,女7例,年龄范围43~82岁,中位年龄66(56,78)岁,年龄、性别等一般资料与患者组差异无统计学意义(P>0.05)。
1.2 样本来源肿瘤患者和健康体检者按照常规诊疗需要,于清晨空腹状态用EDTA-K2真空采血管采集静脉血2~3 ml。待常规检测完成后,利用剩余血样标本进行本研究的检测。不再单独采集患者和健康对照者血标本。
1.3 主要仪器和试剂
1.3.1主要仪器 DxFLEX流式细胞仪(贝克曼库尔特生物科技有限公司);TL80-2型医用离心机(江苏天力医疗器械有限公司);QL-901 Vortex涡旋振荡器(海门市其林贝尔仪器制造有限公司);微量移液器(德国Eppendorf公司);IKA移液器(艾卡广州仪器设备有限公司);BCD-165F冰箱(广东海信科龙电器股份有限公司);CytExpert流式分析软件(贝克曼库尔特生物科技有限公司)。
1.3.2试剂耗材 Mouse Anti-Human CD3 APC-CyTM7 SK7、CD4 APC-R700 RPA-T4、CD8 RPA-T8 BB515、CD56 APC B159、CD279(PD-1) PE-Cy7 EH12.1、CD223(LAG-3) PE-CF594 T47-530、CD366(TIM-3) PE 7D3均购自美国BD Biosciences公司;CD19 Monoclonal Antibody(SJ25C1)PerCP-eFluor 710、Flow Cytometry Staining Buffer均购自美国赛默飞世尔公司;荧光单克隆抗体试剂盒、血细胞分析用溶血剂均购自北京同生时代生物技术公司;Coulter Clenz Cleaning Agent购自贝克曼库尔特(苏州)公司;EDTA-K2真空采血管、流式细胞术专用试管均购自浙江拱东医疗器械有限公司。
1.4 实验方法运用流式细胞术(flow cytometry,FCM)进行检测:① 配制1×血细胞分析用溶血剂工作液:将试剂盒内10×血细胞分析用溶血剂浓缩液取出,按照当天的样本数量计算(1 ml/管)用量。使用去离子水将浓缩液按照1 ∶10稀释成1×血细胞分析用溶血剂工作液,平衡至室温。② 在流式细胞术专用试管底部加入抗人CD3(5 μl)、CD4(5 μl)、CD8(5 μl)、CD19(5 μl)、CD56(20 μl)、PD-1(5 μl)、LAG-3(5 μl)和TIM-3(5 μl)荧光标记的单克隆抗体,对照管中加入等量阴性对照抗体。③ 充分颠倒混匀EDTA-K2抗凝的全血。为了保证吸样准确,使用反向移液技术吸取100 μl抗凝全血,轻轻加入试管底部,注意避免血液碰触到试管上壁。④ 使用涡旋震荡器,轻轻涡旋混匀已加入荧光抗体的样本,20~25 ℃下避光孵育20 min。⑤ 向荧光抗体样本管中加入1×血细胞分析用溶血剂工作液1 ml,使用涡旋震荡器轻柔涡旋混匀,室温避光孵育15 min。⑥ 使用移液器向荧光抗体样本管中加入细胞染色缓冲液1 ml洗涤,使用离心机1 500 r/min离心5 min。⑦ 手持流式管,倾倒上清液,然后果断回正,切勿二次倾倒导致细胞丢失。此时流式管底部应剩余约200 μl液体,涡旋振荡器涡旋混匀。⑧ 重复步骤⑥、⑦。⑨ 向流式样本管加入500 μl细胞染色缓冲液,涡旋振荡器重悬,上流式细胞仪检测。淋巴门内至少收集10 000个细胞,保存数据。使用CytExpert流式分析软件设门分析样本中CD3-、CD3+T、CD4+T、CD8+T、CD4/CD8、B细胞、NK细胞以及CD4+T细胞、CD8+T细胞上的免疫检查点分子PD-1、LAG-3、TIM-3的表达情况。
2 结果
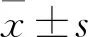
2.1 肿瘤组和对照组外周血CD3-、CD3+T细胞的表达比例恶性肿瘤患者外周血CD3-细胞比例(59.55%±21.09%),与健康对照组(53.07%±10.43%)相比有所升高,但差异无统计学意义(t=-1.378,P>0.05);恶性肿瘤患者外周血CD3+T细胞比例(40.09%±21.18%),与健康对照组(46.78%±10.39%)比较有所降低,但差异无统计学意义(t=1.422,P>0.05);代表性流式图见图1。
2.2 肿瘤组和对照组外周血CD4+T、CD8+T细胞的表达比例及CD4/CD8比值恶性肿瘤患者外周血CD4+T、CD8+T细胞比例(57.64%±15.52%)、(34.03%±14.27%),与健康对照组(54.69%±11.33%)、(31.13%±9.97%)比例接近,差异均无统计学意义(t=-0.654、-0.704,P>0.05);恶性肿瘤患者外周血CD4/CD8比值1.94(0.96,2.68),与健康对照组比值1.85(1.30,2.67)相比变化不大,差异无统计学意义(Z=-0.120,P>0.05);流式代表图及统计见图2。
2.3 肿瘤组和对照组外周血B细胞、NK细胞的表达比例恶性肿瘤患者外周血B细胞比例5.90%(3.09%,10.69%),与健康对照组7.63%(6.67%,10.85%)相比有所降低,但差异无统计学意义(Z=-1.156,P>0.05);恶性肿瘤患者外周血NK细胞比例8.61%(5.58%,16.15%),与健康对照组21.96%(12.84%,36.47%)相比降低,差异有统计学意义(Z=-3.539,P<0.001);流式代表图及统计见图3。
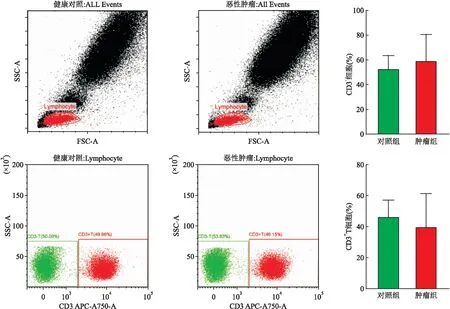
图1 肿瘤组和对照组外周血CD3-、CD3+T细胞的表达情况

图2 肿瘤组和对照组外周血CD4+、CD8+T细胞的表达和CD4/CD8比值情况

图3 肿瘤组和对照组外周血B细胞、NK细胞的表达情况
2.4 肿瘤组和对照组外周血CD4+T细胞免疫检查点PD-1、LAG-3、TIM-3的表达情况恶性肿瘤患者外周血PD-1+CD4+T细胞比例8.96%(6.06%,15.34%),与健康对照组7.34%(3.94%,8.94%)相比增高,差异有统计学意义(Z=-2.119,P<0.05);恶性肿瘤患者外周血LAG-3+CD4+T细胞比例15.92%(12.61%,18.64%),与健康对照组9.11%(7.93%,10.46%)相比增高,差异有统计学意义(Z=-4.021,P<0.001);恶性肿瘤患者外周血TIM-3+CD4+T细胞比例14.18%(11.01%,19.50%),与健康对照组7.64%(6.51%,10.55%)相比增高,差异有统计学意义(Z=-4.466,P<0.001);代表性流式图见图4。
2.5 肿瘤组和对照组外周血CD8+T细胞免疫检查点PD-1、LAG-3、TIM-3的表达情况恶性肿瘤患者外周血PD-1+CD8+T细胞比例10.07%(8.49%,12.88%),与健康对照组6.71%(5.10%,9.31%)相比增高,差异有统计学意义(Z=-3.070,P<0.01);恶性肿瘤患者外周血LAG-3+CD8+T细胞比例17.64%(14.27%,20.74%),与健康对照组4.09%(2.52%,12.41%)相比增高,差异有统计学意义(Z=-3.852,P<0.001);恶性肿瘤患者外周血TIM-3+CD8+T细胞比例18.66%(9.09%,23.59%),与健康对照组6.60%(5.01%,12.87%)相比增高,差异有统计学意义(Z=-2.576,P<0.01);流式代表图及统计见图5。
2.6 肿瘤组和对照组外周血双阳耗竭CD4+T、双阳耗竭CD8+T细胞的表达情况双阳耗竭CD4+T、双阳耗竭CD8+T细胞,即PD-1、LAG-3、TIM-3中两个分子阳性的CD4+T和CD8+T细胞,它们往往代表着T细胞功能高度抑制,进一步失去活性。恶性肿瘤患者外周血PD-1+LAG-3+CD4+T细胞比例3.03%(1.02%,6.79%),与健康对照组2.10%(1.52%,2.67%)相比增高,差异有统计学意义(t=2.898,P<0.01);恶性肿瘤患者外周血PD-1+TIM-3+CD4+T细胞比例2.12%(1.24%,5.58%),与健康对照组1.11%(0.73%,1.24%)相比增高,差异有统计学意义(t=4.389,P<0.001);恶性肿瘤患者外周血LAG-3+TIM-3+CD4+T细胞比例2.98%(0.59%,8.19%),与健康对照组1.28%(0.80%,1.54%)相比增高,差异有统计学意义(t=3.207,P<0.01);三种表型的双阳耗竭CD8+T在肿瘤组与健康组中的比例接近,差异均无统计学意义。双阳耗竭CD4+T细胞流式代表图及统计见图6。
2.7 恶性肿瘤患者外周血CD4+T、CD8+T细胞及其免疫检查点分子PD-1、LAG-3、TIM-3的相关性分析恶性肿瘤患者外周血CD4+T细胞与PD-1+CD4+T细胞比例之间采用Pearson相关性分析,其余均采用Spearman相关性分析。肿瘤患者CD4+T细胞比例与PD-1+CD4+T(r=-0.506,P=0.004)、PD-1+LAG-3+CD4+T(r=-0.606,P<0.001)、PD-1+TIM-3+CD4+T(r=-0.516,P=0.004)、LAG-3+TIM-3+CD4+T(r=-0.581,P<0.001)细胞比例之间均呈负相关性,差异均有统计学意义(P<0.01)。CD8+T细胞与各检查点阳性亚群之间均无相关性(P>0.05)。见图7。

图4 肿瘤组和对照组外周血CD4+T细胞免疫检查点PD-1、LAG-3、TIM-3的表达情况
3 讨论
T淋巴细胞以膜标志的不同划分出不同的亚群,CD3分子在抗原识别中起着信号传递的重要作用,一般仅存在于T细胞表面;CD4+T细胞主要通过细胞因子的作用调节T细胞的亚群分化和B细胞的抗体分泌;CD8+T细胞则通过细胞毒性作用,直接杀伤或抑制肿瘤细胞,CD4/CD8比例稳定对机体免疫稳态具有重要意义[3]。本研究中恶性实体瘤患者,与健康对照组相比,外周血中CD3-细胞比例有升高趋势,CD3+T细胞、B细胞比例均呈降低趋势,而CD4+T比例、CD8+T细胞比例及CD4/CD8比值均与健康对照组相接近。由此提示恶性肿瘤患者的T、B淋巴细胞活化可能受到抑制,而免疫功能低下与CD4+T细胞、CD8+T细胞比例的关系不确切,是否与细胞数量和亚群有关尚待进一步研究;NK细胞因其固有表达的受体可无需致敏直接识别并杀伤肿瘤细胞,是非常重要的固有免疫细胞。本研究中肿瘤患者的NK细胞的表达比例降低,这可导致患者的固有免疫系统对肿瘤细胞的杀伤能力降低,造成肿瘤的发生和逃逸[4]。
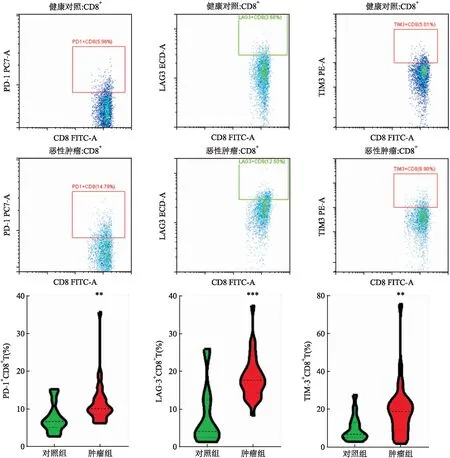
图5 肿瘤组和对照组外周血CD8+T细胞免疫检查点PD-1、LAG-3、TIM-3的表达情况
PD-1是重要的抑制性免疫检查点分子,主要表达于活化的CD4+T细胞、CD8+T细胞、B细胞、自然杀伤细胞、单核巨噬细胞和DC细胞表面,其配体为PD-L1和PD-L2;PD-1与配体结合后通过多种途径抑制T、B、NK细胞活化信号和细胞因子的释放[5]。本研究检测了CD4+T细胞、CD8+T细胞上PD-1分子的表达率,结果显示恶性肿瘤患者与健康对照组比较外周血PD-1+CD4+T、PD-1+CD8+T细胞比例均升高,提示肿瘤患者的T淋巴细胞功能高度抑制,抗肿瘤免疫功能低下。
LAG-3是近年来新发现的一种负性免疫检查点分子,与CD4在分子结构上很相似,配体为MHC-Ⅱ分子,主要表达在活化或耗竭T细胞、NK等细胞上[6];LAG-3主要通过直接抑制T淋巴细胞,促进Treg细胞活化增殖,调节APC细胞的功能等方式来发挥免疫抑制性[7]。本研究发现LAG-3不仅可以在肿瘤患者CD4+T和CD8+T细胞上高表达,提示LAG-3可能参与了抗肿瘤免疫抑制,而且CD8+T细胞上的表达率高于CD4+T细胞。Shapiro et al[8]在慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)患者淋巴结中发现CD8+T和CD4+T均高表达LAG-3,且LAG-3+CD8+T的比例高于LAG-3+CD4+T的比例,本研究结果与之具有一致性。
TIM-3是一种在T淋巴细胞、单核巨噬细胞、Treg细胞、NK细胞及肿瘤细胞中均可表达的负性免疫检查点分子,TIM-3与配体结合可诱导T淋巴细胞功能耗竭,不能活化且不能分泌细胞因子[7]。本研究中肿瘤患者TIM-3在CD4+T细胞、CD8+T细胞中的表达率均高于健康对照组,提示TIM-3可能通过抑制T淋巴细胞亚群导致肿瘤发生发展。

图6 肿瘤组和对照组外周血双阳耗竭CD4+T细胞的表达情况
受肿瘤或慢性感染影响,T淋巴细胞多种免疫检查点高表达,细胞因子产生减少,细胞毒性和增殖能力受损,表观基因组学改变的现象称为T细胞耗竭[9]。本研究进一步研究了恶性肿瘤患者与健康对照组外周血中双阳耗竭T细胞的表达情况,结果显示肿瘤患者的PD-1+LAG-3+CD4+T、PD-1+TIM-3+CD4+T、LAG-3+TIM-3+CD4+T细胞比例均高于对照组,而双阳耗竭CD8+T细胞比例差异不大,提示肿瘤患者CD4+T细胞功能进一步耗竭,免疫活化调节功能较差。动物黑色素瘤研究[10]表明,耗竭的CD4+T细胞可导致肿瘤复发,而逆转耗竭CD4+T细胞的治疗手段对复发性黑色素瘤非常有效。然而CD4+T细胞和CD8+T细胞的耗竭机制与表型不完全一致[11],这可能是本研究中CD8+T细胞与CD4+T细胞未同步呈现双阳耗竭的原因之一,此外也可能与样本量不够大有关。需要引起注意的是,肿瘤患者TIM-3、PD-1、LAG-3等负性分子不仅共表达,同时也呈现出此消彼长的趋势,有研究[12]表明PD-1单抗治疗耐药患者的TIM-3表达上调。了解肿瘤患者耗竭T细胞的分子表型和产生机制,对于更精确的肿瘤免疫治疗策略开发具有重要意义。

图7 肿瘤患者外周血CD4+T细胞与PD-1、LAG-3、TIM-3阳性亚群之间的相关性
本研究对恶性肿瘤组的淋巴细胞亚群及免疫检查点阳性细胞亚群进行了相关性分析,结果显示肿瘤患者CD4+T细胞比例随着PD-1+CD4+T细胞、双阳耗竭CD4+T细胞比例的升高而降低,均呈负相关性。提示肿瘤患者PD-1、LAG-3、TIM-3高表达与CD4+T细胞比例降低相关,这进一步印证了免疫检查点分子对T淋巴细胞活化增殖的负性调控作用[5,7]。
综上,本研究表明恶性实体肿瘤患者外周血部分淋巴细胞比例紊乱。负性免疫检查点分子高表达、共表达,耗竭T细胞比例升高,对细胞免疫进行负性调控。免疫检查点分子的协同作用可能参与了肿瘤的发生发展,动态监测肿瘤患者淋巴细胞亚群及免疫检查点水平,对临床免疫治疗具有重要价值。肿瘤患者免疫检查点抑制剂单药治疗无效的患者,多靶点联合治疗可能会取得更好的效果。
