卡波肉瘤相关疱疹病毒细胞抗原片的制备
2020-10-13董凯旋王林定
文 志,周 畅,华 玮,董凯旋,叶 磊,郑 豪,徐 涵,王林定
卡波肉瘤疱疹病毒(Kaposi′ssarcoma-associated herpesvirus,KSHV)又被称之为人类疱疹病毒8型(human herpervirus 8,HHV-8),是在1994年由Chang et al[1]在卡波肉瘤(Ksposi′ssacoma, KS)组织中发现的,是引起KS的主要病原体[2]。经研究证明KSHV同时还是原发性渗出性淋巴瘤[3](primary effusion lymphoma,PEL)多中心性Castleman病(multicentric Castlemans disease, MCD)的病原体[4],是危害人类健康的一大病原体。KSHV的生命周期包涵两个阶段,潜伏期和裂解期。潜伏期和裂解期的转换是受到基因的严格控制[5]。潜伏期占病毒整个生命周期的绝大多数时间,病毒的基因受到严格调控,只有少数潜伏相关基因在持续表达,所以临床很难对这一时间段病毒的存在做出精确的检出,但在裂解复制阶段,病毒绝大多数基因复制表达,并包装产生新的病毒,感染新的宿主细胞。目前用于检测KSHV的方法主要是酶联免疫吸附试验(ELISA),时间长,耗材大,不能长久保存。但是目前用只有KSHV感染而EB病毒未感染过的PEL细胞系来检测血清样本尚无人报道。这种细胞抗原片的制备能很好地解决上述问题,为KSHV的血清检测提供了一条新的检测方法。
1 材料与方法
1.1 材料
1.1.1细胞系 卡波肉瘤相关疱疹病毒感染细胞系BCBL-1由本实验室保存。
1.1.2主要试剂和材料 12孔免疫荧光原位杂交载玻片;Triton X-100(德国Biofrox公司);DAPI染液、牛血清白蛋白(BSA)(上海碧云天公司);山羊抗人IgG(FITC) (武汉Elabscience公司);免疫荧光显微镜(日本OLYMPUS公司TH4-200);KSHV阴性和阳性标本为本实验室保存。
1.2 方法
1.2.1细胞培养 将BCBL-1细胞复苏后置于含10% FBS的且含有1%双抗的RPMI 1640培养基中,37 ℃、5% CO2培养箱培养。每48 h观察细胞状态并收集细胞离心换一次液。
1.2.2固定和预处理细胞 待细胞长到活力旺盛时期,收集细胞,2 000 r/min离心10 min,PBS洗3遍。洗完后加入200 μl PBS,彻底使细胞悬浮,使细胞单个均匀分布。载玻片每孔加入5 μl的细胞悬液,放置室温,20~30 min,待干透后每孔加入50 μl 4%多聚甲醛固定细胞,10~15 min,PBS洗3遍,每次5 min。固定后每孔加50 μl 3%BSA和0.1% Triton X-100的混合液,封闭细胞,室温放置1~2 h,PBS洗3遍,每次5 min。
1.2.3检测样本 将待测样本用PBS按照1 ∶50稀释,每孔加入50 μl,置于4 ℃,过夜孵育。
1.2.4免疫荧光二抗的孵育 将孵育完检测血清后的抗原片用PBS洗3遍,每次5 min,每孔加入50 μl预先用PBS按照1 ∶100稀释后的荧光二抗,室温避光孵育1~2 h,PBS洗3遍,每次10 min。
1.2.5细胞核染色 每个抗原孔内加入50 μl DAPI染液,室温避光5 min,PBS洗3遍,每次10 min。
2 结果
2.1 显微镜下细胞培养结果BCBL-1细胞为悬浮细胞,生长时间相对较长,需在含有10% FBS和1% 双抗的1640培养基、37 ℃、5% CO2中培养5~7 d,低倍镜下观察细胞生长状态(图1A),待细胞长满整个视野时,此时细胞数量较多,活力旺盛,适合做免疫荧光。
2.2 细胞固定结果待细胞固定在载玻片后肉眼可在载玻片上观察看到一层白色薄膜覆盖在孔底,显微镜下可见点状细胞分布在视野内。见图1B。

图1 BCBL-1细胞培养和12孔免疫荧光原位杂交载玻片
2.3 荧光显微镜观察结果在荧光显微镜下,可以观察到孵育KSHV阳性血清的样本,有异硫氰酸(FITC)激发的绿色荧光。KSHV阴性样本的血清则没有看见异硫氰酸激发的绿色荧光。细胞经过细胞核染色后,发现细胞核激发的蓝色荧光位点与FITC激发的绿色荧光位点相同。见图2、3。
2.4 普通人群血清样本的检测结果收集了合肥市238份普通血清标本,并用此方法检测,结果显示合肥市普通人群感染KSHV的感染率约为7.6%。见表1。
3 讨论
KSHV又称为卡波肉瘤病相关疱疹病毒,是DNA双链病毒,属于γ疱疹病毒的亚科。现已发现的KSHV有4种类型,分别是经典型KS、地域型KS、移植型KS和AIDS相关性KS。KSHV在全世界的分布比较广泛,集中分布在非洲。部分欧美等地和地中海国家是高发区域。随着世界人口的流动,在中国及日韩和东南亚地区也发现了KSHV的活动迹象。我国对KSHV的研究起步相对较晚[6],但是有研究[7]表明我国西北地区KSHV的发病率明显较高,且各族之间差异较为显著。
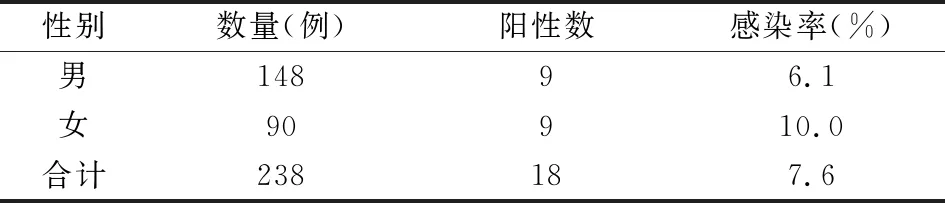
表1 合肥市238例普通人群KSHV的感染情况

图2 荧光显微镜下观察KSHV阳性与阴性样本检测结果 ×100
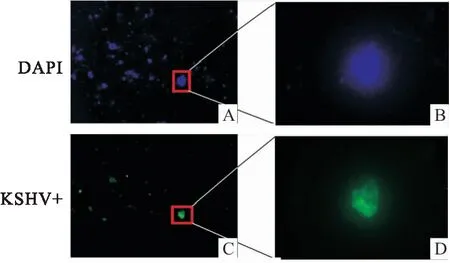
图3 KSHV阳性标本结果局部放大与细胞核染色对比
目前常用于检测KSHV的血清学方法为ELISA间接法,用此方法检测血清有以下几个优点:① 适用于大量样本的检测,一块反应板至少可以检测90余份血清标本,一次检测数块反应板可完成上百个样本的检测;② 成本较低,ELISA中各种试剂、耗材及仪器价格相对较低,储存方便。但是缺点也是十分明显的:① 费时,包被抗原需4 ℃过夜,第2天检测血清样本时,当中各种过程所需的时间至少要6 h;② 检测过程中温度求高,在检测样本时,除洗涤外,所有的过程均需要在37 ℃的环境中进行,尤其是在酶和底物反应时,温度对最终的OD值影响较大;③ 洗涤不完全时,容易造成背景值的偏高,进而造成假阳性。采用细胞抗原片的方法检测血清样本也有优点:① 检测时间短,抗原片还可以储存。制作抗原片只需要1 h,检测样本需要3 h,制作完成的抗原片可置于-80 ℃保存,待有样本检测时可直接取出使用。② 灵敏度较ELISA法高,只有与阳性标本中的抗体结合的荧光二抗能激发目的荧光,目的荧光的强弱只与激发光的强弱相关,不受温度等因素的影响。但是此种方法也存在不足:① 细胞生长缓慢,BCBL-1细胞为悬浮细胞,相对于普通的贴壁细胞生长周期更长。② 要求避光。因为荧光二抗中的荧光物质在白光环境下容易淬灭,所以孵育二抗和在荧光显微镜下观察结果时不可过长时间暴露在白光下,进而造成假阴性。③ 费用相对较高,荧光显微镜的成本及维护和酶标仪表相比较高,不适用于临床检测样本。
KSHV生命周期中包涵两个阶段,即潜伏期及裂解期。当病毒侵入宿主细胞后,经过短暂的急性感染,病毒的自身基因激活,在表达的潜伏核抗原(LANA)的作用下,病毒自身的环状DNA分子直接耦联到宿主细胞核的基因组中,病毒进入到潜伏状态。此时,病毒的大多数基因处于沉默状态,只有少数的潜伏相关基因处于激活状态,如ORF73、ORF72和K13等。但是当宿主受到外界因素的直接或间接作用,处于免疫功能低下时,病毒潜伏状态的一些基因能被重新激活,并进入复制阶段,此时能检测到多种病毒裂解产物,如病毒复制与转录激活因子(RTA),病毒裂解复制立早期蛋白(MTA)等。
潜伏期相关核抗原LANA是一种多功能核蛋白,在病毒的整个生命周期中都持续稳定表达。LANA有220 ku,是由KSHV的ORF73基因编码。当病毒侵入宿主细胞并且处于潜伏状态时,它对病毒染色质的复制,维持正常结构和协助KSHV病毒基因组整合到宿主细胞中,并通过有丝分裂进入子代细胞中,都发挥着非常重要的作用。目前已知KSHV的基因组的末端重复序列(terminal repeats,TRs)包含有一个负责DNA复制起始的顺式作用元件(cis-element)。LANA是一种反式作用蛋白,它的氨基末端和羧基末端共同参与并调节了其与基因组的TRs的特异性结合,最终形成一种DNA蛋白质复合体,这种蛋白质复合体来调节病毒染色质的复制[8]。LANA是定位于细胞核中,能够将病毒的基因组与宿主的基因组相互整合并随着宿主细胞的有丝分裂进入到子代细胞中[9]。目前认为,甲基化的CPG结合蛋白MeCP2和DEK蛋白共同作用于LANA,介导了这种作用[10]。近几年发现在KSHV潜伏感染的JSC细胞株中,LANA蛋白与着丝粒蛋白F(CENP-F)共同在着丝粒区域出现,并且观察到N端与C端能直接与CENP-F结合。除此之外,还发现LANA与另一种着丝粒蛋白Bu1b有关,Bub1与CENP-F共同形成复合体并且与LANA相互作用,免疫荧光原位杂交显示,CENP-F、Bub1、LANA三个蛋白共同介导KSHV基因组附着到宿主细胞的基因组中[11-12],实验通过携带有短发夹结构的RNA(shRNA)的慢病毒载体干扰蛋白Bnb1的表达能显著降低KSHV基因组的拷贝数量,但是蛋白CENT-F的去除并未观察到这一现象[13],提示LANA可能与多种蛋白相互作用,共同促进了病毒潜伏机制的建立。
