UCP-2、ROS对老年2型糖尿病患者血管内皮功能障碍的调控作用及其机制
2020-10-12吕晓静杜丽娜张洁王郡杨爱格张趁儒
吕晓静 杜丽娜 张洁 王郡 杨爱格 张趁儒
(河北医科大学第一医院内分泌科,河北 石家庄 050000)
糖尿病的发病率高〔1〕,其由于胰岛素的缺乏或胰岛素生物作用从而诱发糖代谢混乱,而在糖尿病中,90%的患者为2型糖尿病〔2,3〕,临床表现为餐后高血糖及空腹高血糖〔4〕。在糖尿病后期,血管内皮功能障碍是其主要并发症之一,且多数发生在老年患者之中。血管内皮功能障碍的发生在血管老化中最早,且会加剧患者糖尿病严重程度,目前有研究发现,ROS在血管壁中参与着内皮依赖性功能的调节、内皮细胞、血管平滑肌细胞的增殖和凋亡及血管壁的重构且与胰岛素抵抗(IR)有着密切关系〔5〕,过量的活性氧(ROS)会出现氧化过激反应,造成血管内皮损伤,而高糖的条件下,ROS的水平将被提高〔6〕。主存于线粒体内膜上的解耦联蛋白(UCP)-2,可以影响氧化磷酸化过程〔7〕,使其解耦联调节能量代谢,且在此基础上减少ROS的生成,防止因氧化应激反应造成的血管内皮损伤,改善血管内皮功能障碍〔8〕,从而达到帮助老年2型糖尿病血管内皮功能障碍患者调节身体功能,防止血管内皮功能障碍〔9〕。本研究主要探讨UCP-2及ROS表达对老年2型糖尿病患者血管内皮功能障碍的调控作用。
1 对象及方法
1.1对象及分组 选取2017年6月至2018年6月河北医科大学第一医院收治的老年2型糖尿病患者30例、老年2型糖尿病合并内皮功能障碍患者30例及期间在医院门诊进行体检的健康人群30例,分为糖尿病组、共病组及健康组。纳入标准:年龄60~72岁;对本课题研究知情且同意;共病组:符合2017年版《中国2型糖尿病防治指标》中对糖尿病的诊断且通过血管内超声检测发现已经出现血管内皮功能障碍;糖尿病组:符合2017年版《中国二型糖尿病防治指标》中对糖尿病的诊断。 排除标准:①严重肝肾功能不全者;②具有精神性疾病,无法配合本研究者。
1.2UCP-2、ROS水平检测 UCP-2检测:取血样5 ml,2 h内于3 000 r/min离心10 min,分离血清后,放入冻存管存放,于-80℃冰箱中保存待测。采用UCP-2试剂盒,上海蓝基生物科技有限公司;灵敏度1.0 μg/ml,批间变异系数<10%,批内变异系数<10%,抗体用以抗人UCP-2单克隆抗血清,与其他物种均无交叉反应。ROS检测:ROS试剂盒,购自上海蓝基生物科技有限公司,抗体用以抗人ROS单克隆抗血清,与其他物种均无交叉反应,灵敏度为1.0 ng/ml,批间变异系数<5%,按试剂盒说明进行测定。
1.3临床指标检测 采用免疫比浊法测定糖化血红蛋白(HbA1c),采用葡萄糖氧化酶法测定空腹血糖(FBG),采用酶联免疫吸附试验测定血清空腹胰岛素(FINS),采用全自动分析测定仪(美国贝克曼库尔特公司生产)应用酶定量法检测患者总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C),相关检测试剂盒购自美国贝克曼库尔特公司,操作均严格采用试剂盒说明进行,HOMA-IR采用标准公式计算。
1.4统计学方法 采用SPSS21.0软件行t检验。
2 结 果
2.13组一般资料比较 3组性别、年龄、体重指数(BIM)、HDL-C比较差异无统计学意义(P>0.05);与健康组比较,糖尿病组和共病组 TG、TC、LDL-C 水平明显升高(P<0.05);糖尿病组TG、LDL-C 水平显著高于共病组(P<0.05);糖尿病组和共病组HbA1c、FPG、FINS及胰岛素抵抗指数(HOMA-IR)均显著高于健康组(P<0.05),但共病组上述指标与糖尿病组比较差异无统计学意义(P>0.05)。见表1。
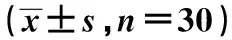
表1 3组临床指标比较
2.23组UCP-2表达比较 与健康组〔(38.25±9.01)ng/L〕比较,糖尿病组〔(14.48±4.78)ng/L〕、共病组〔(7.79±2.12)ng/L〕UCP-2表达明显下降(P<0.05);与糖尿病组比较,共病组UCP-2表达明显下降(P<0.05)。
2.33组ROS表达比较 与健康组〔(533.85±65.48)U/ml〕比较,糖尿病组〔(598.23±52.74)U/ml〕及共病组〔(649.23±79.12)U/ml〕ROS明显升高(P<0.05);与糖尿病组比较,共病组ROS表达明显升高(P<0.05)。
2.43组不同检测时间的肱动脉内径比较 健康组肱动脉内皮依赖性舒张功能、非血管内皮依赖性舒张功能变化率优于糖尿病组,但对比差异无统计学意义(P>0.05);而健康组的肱动脉内皮依赖性舒张功能、非血管内皮依赖性舒张功能变化率明显优于共病组(P<0.05)。见表2。
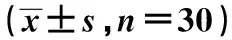
表2 3组不同时间点的肱动脉内径指标对比
2.5各组颈动脉IMT值比较 健康组〔(0.98±0.42)mm〕IMT高于糖尿病组〔(0.92±0.74)mm〕,但差异无统计学意义(P>0.05);而健康组明显高于共病组〔(0.71±0.21)mm,P<0.05〕。
3 讨 论
糖尿病主要特征是长期慢性高血糖,患者会随着病程的加长而导致多种并发症,高血糖环境损害了胰腺对高血糖的反馈抑制,导致血液中胰岛素水平逐渐升高〔10,11〕,在老年糖尿病患者中,血管内皮功能障碍是该年龄阶段出现的主要并发症之一〔12〕。不论是急性与慢性高血糖都会引起不同程度的内皮功能损伤,高血糖会诱导内皮功能障碍的出现,且患者的胰岛素通路损伤及血脂异常也都是导致其内皮功能受损的主要原因。糖尿病患者有着血管紧张、血管通透、凝血功能差等异常,而这些异常在合并到血管内皮功能损伤时,便会出现恶性循环〔13,14〕,所以老年糖尿病患者内皮功能障碍的出现会加剧糖尿病严重程度及增加血糖控制的难度。因此,对此类患者内皮功能的改善也成为治疗糖尿病及预防并发血管内皮功能障碍的关键治疗思路。
ROS为功能性信号因子中的一种,对细胞内的应激敏感性信号通路具有激活作用,而这些可以被其激活的信号通路均与IR有着密切关系〔15〕,氧化应激反应、脂毒性、糖毒性的出现都与ROS的过量有关。国外有研究〔16〕发现,30 mmol/L葡萄糖的浓度下培养肾小球系膜细胞,发现在此条件中线粒体膜电位会出现升高,同时升高的还有细胞内的ROS水平,且UCP-1及锰型超氧化物歧化酶(MnSoD)的超表达又能够对上述现象起抑制作用,这些发现可以说明ROS可以在高糖的环境中产生。ROS导致糖尿病的病理包括晚期蛋白糖基化物途径、氨基己糖途径等,这些途径的激活,还可以对ROS的产生起到促进作用,而随之氧化应激被加剧,以上机制的反复作用会出现恶性循环,疾病的严重程度被不断加深。而ROS的增多,可以直接导致患者出现内皮功能障碍,ROS在血管壁中参与内皮依赖性功能的调节、内皮细胞、血管平滑肌细胞的增殖和凋亡及血管壁的重构。超氧阴离子是血管最为重要的ROS,其会引起一氧化氮(NO)失去活性,进而损坏了血管舒张功能,也就出现了血管内皮功能障碍。所以,在老年糖尿病患者中对ROS表达水平进行干预控制是一种有效的治疗方法及防止其发生血管内皮功能障碍的有效办法。
UCP-2是解耦联蛋白家族中的一员,主要存在于线粒体的内膜上〔17〕,UCP-2可抑制高糖诱导的脐静脉内皮细胞凋亡〔18〕,影响氧化磷酸化过程,使其解耦联调节能量代谢,且在此基础上减少ROS的生成,改善血管内皮功能障碍及动脉重构〔19〕。
综上所述,UCP-2及ROS水平在糖尿病血管内皮功能障碍中具有重要作用,调控UCP-2、ROS可以改善血管内皮功能及对糖尿病起到一定治疗作用。
