建构主义学习理论与化学核心素养培养目标的融合研究
——以“金属的腐蚀与防护”教学设计为例
2020-10-12于文文
于文文
(山东省济南德润高级中学 山东济南 250014)
一、建构主义学习理论与化学学科核心素养关系
1.建构主义学习理论
建构主义学习理论认为,学习不是学习者机械地将外界知识搬到记忆中,而是学习者在已有知识和生活经验基础上,与外界各种因素交互作用,获取和建构自己新的知识体系[1]。因此,教学应以学生为中心,强调对学习环境、学习活动、学习策略等进行分析和构造,激发原有相关经验,激活高水平思维活动,促进新旧知识经验相互作用,让新知识在原有经验基础上生长起来,帮助学生完成意义建构。
2.化学学科核心素养
高中化学学科核心素养包括“宏观辨识与微观探析”、“变化观念与平衡思想”、“证据推理与模型认知”、“科学探究与创新意识”、“科学精神与社会责任”5 个维度[2]。基于化学核心素养培养的教学是指在教学目标确定、教学内容组织、教学过程实施、教学结果改进、教学评价设计等环节均以化学核心素养作为衡量准则。即教学目标源于化学学科核心素养,教学内容基于真实情境,教学过程实施有利于素养内化,关注“教学评”一致性等。
3.二者之间的关系
建构主义学习理论和化学学科核心素养都立足于人的身心和认知发展规律,具有很强的综合性,涵盖了聚焦核心知识、建构思想观念、注重宏微结合、引导实验探究等多方面,二者相辅相成。体现为学生不仅要掌握化学学科5 大模块的理论概念,还要能准确把握各模块之间的内在联系,能够跨模块和综合运用不同模块知识进行分析、归纳、演绎和综合,将零散知识和概念建构成相应的知识体系,并最终内化[3]。
二、设计思想
“金属的电化学腐蚀”在鲁教版教材体系中出现三次,各个板块的教学要求侧重不同[4]。其中,《必修2》要求举例说明金属材料的腐蚀及防护;《化学反应原理》要求能解释金属发生电化学腐蚀的原因,认识金属腐蚀的危害。本教学设计通过实验设计和问题讨论明晰电化学腐蚀原理;通过实验探究初中学习的红磷燃烧实验,从水被倒吸测定体系中压强变化进行联想观察、证据推理与模型认识;让学生学会用化学原理解释某些生活现象。
三、教学目标
证据推理和模型认知—从封闭体系压强变化事实中提取证据,理解金属腐蚀原理,提高学生模型认知的核心素养。
科学探究和创新意识—设计和实施金属腐蚀原理实验,结合问题驱动、情境分析和小组交流得出结论。
科学态度与社会责任—运用金属腐蚀原理探讨金属防护方法,倡导节约资源和社会可持续发展。
四、教学过程
(一)创设情境导入新课
[媒体展示]金属腐蚀的资料图片。
[教师活动]面对这样惊人的数字,大家是否想过:如何预防或者减慢金属的腐蚀?
[设计意图]新课导入设计过程中适时使用情境教学,激发学生“科学精神和社会责任”,为后续任务完成打下基础。
[媒体展示]在九年级化学下册第九单元第三节曾学习过钢铁的腐蚀与防护,并做过这样一组实验,请大家回忆并思考钢铁生锈的条件有哪些?
[学生活动]答案是钢铁生锈的条件:钢铁、空气、水。小组讨论:为什么海边的铁制品比陆地上的铁制品较容易生锈?答案是钢铁(主要成分铁、碳),潮湿的空气即水膜(电解质溶液)形成了原电池。
[设计意图]运用已有知识解决问题,在原有知识点基础上生长出新知识。
[教师活动]将不纯的金属或合金与电解质溶液接触会发生原电池反应,比较活泼的金属失电子被氧化的腐蚀,称为电化学腐蚀。那么钢铁电化学腐蚀的原理是怎样的呢?
(二)小组合作揭示本质—探究钢铁电化学腐蚀的原理
[教师活动]如果水膜呈酸性,写出电极反应式及电池反应方程式。
[学生活动]负极:Fe-2e-=Fe2+正极:2H++2e-=H2↑总:Fe+2H+=Fe2++H2↑
分析:当钢铁处于酸性气氛中时,易发生析氢腐蚀。
[教师活动]如果水膜呈中性或碱性呢?铁被氧化,氧化剂是什么物质呢?O2还是H2O?
[学生活动]小组交流讨论是因为O2。根据以往经验,在水溶液中H+比较容易氧化Fe。中性或碱性电解质溶液,这时c(H+)小于等于10-7mol/L,浓度太小,因此氧化剂是O2。
[教师活动]设计一个封闭体系测定体系压强的变化,证明O2 是否参加反应。联想初中学习的红磷燃烧的实验装置,从水被倒吸的情况测定体系中压强的变化。
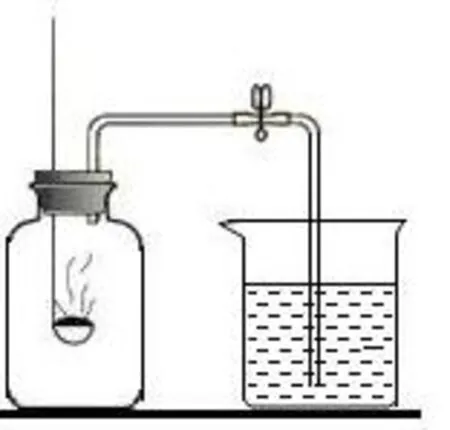
图1

图2
[学生活动]回忆初中阶段学习过的红磷燃烧的实验装置图(图1),小组讨论并展示设计钢铁腐蚀消耗氧气的实验装置图(图2)。
[设计意图]通过情境支架、问题支架为学生提供证据推理与模型认识,培养学生实验探究能力与创新意识和分析问题、解决问题的能力。
[教师活动]铁被腐蚀为Fe2+还是Fe3+?如何检验?
[学生活动]小组交流讨论,小组代表总结回答。取样后先加入KSCN 溶液,若无明显现象,再加入过氧化氢溶液,若出现血红色,可以证明氧化产物为Fe2+。
[设计意图]因为学生有原电池理论、红磷燃烧实验和Fe2+与Fe3+离子检验基础,所以这部分采用实验引入、学生讨论和教师点拨相结合的教学方法,形成完整知识体系,完成意义建构。
[教师活动]总结实验步骤。
[学生活动]实验操作。实验1:将适量铁粉、炭粉混合均匀后加入到试管中向试管中;加入3 滴管氯化钠溶液,按上图装置好仪器;2 分钟后打开止水夹,观察导管中水柱的变化。实验2:取实验1 中少量滤液,滴加KSCN 溶液无变化,再滴加H2O2溶液,溶液显红色。
实验现象及结论:①导管口有一段水柱上升,说明试管内气压减小,氧气消耗,发生了吸氧腐蚀;②滴加KSCN 溶液无变化,再滴加H2O2溶液,溶液显红色,说明Fe 被氧化为Fe2+。
[设计意图]培养学生化学核心素养中的“科学探究与创新意识”,让学生在实验中学习归纳总结,逐步揭示钢铁的吸氧腐蚀原理。
[教师活动]尝试写出如果水膜呈中性或弱酸性,此时吸氧腐蚀的电极反应式。
[学生活动]负极:Fe-2e-=Fe2+正极:O2+H2O+4e-=4OH-
继而发生的反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3
[小结]钢铁的析氢腐蚀、吸氧腐蚀的条件,电极反应以及联系。
[设计意图]帮助学生形成和构建完整知识网络。
(三)迁移应用—金属的防护
[教师活动]镀层破坏后,为什么马口铁(镀锡的铁)比白口铁(镀锌的铁)更易腐蚀?
[学生活动]交流讨论,锌比铁活泼,构成原电池时锌做负极,铁做正极,对铁起了保护作用。
[教师活动]如何对金属的腐蚀进行防护呢?请以钢闸门的防腐为例,应用电化学原理设计防腐蚀装置,并绘制草图。
[学生活动]设计绘制草图并交流分享。
[设计意图]该探究是在探究钢铁腐蚀原理的基础上的应用探究。由学生根据电化学原理设计防腐蚀装置,培养学生进行系统设计和模型建构的高级思维能力,实现认知发展的“平衡化”,培养学生“科学精神与社会责任”这一核心素养。
五、结束语
紧紧围绕“培养学生化学核心素养”的核心目标,然后以建构主义学习理论指导各个教学环节设计,将不再局限于学科知识的传授,而是在复习已有知识的基础上,通过让学生交流讨论、发现问题、进行假设、实验探究得出结论,再通过归纳、总结、迁移帮助学生将知识纳入到自己的认知结构中,实现知识建构。整个教学过程实现了建构主义学习理论和化学核心素养培养的有机结合。
