抑制miR-134表达对幼鼠颞叶癫痫海马神经元的保护作用及其机制
2020-10-12王娟费世早张玥王晨陈传国彭小壮陈龙王磊
王娟 费世早 张玥 王晨 陈传国 彭小壮 陈龙 王磊
癫痫是一种常见于儿童的神经系统疾病,经抗癫痫药物治疗后仍有20%~30%的患者发展为难治性癫痫,其中以颞叶癫痫(temporal lobe epilepsy,TLE)最为多见,成为临床治疗的难点[1]。TLE如未得到有效控制而反复发作可导致患者海马神经元严重损伤及海马硬化[2]。目前抗癫痫药物主要以抑制神经元兴奋性为主,但对TLE的疗效欠佳。近年研究发现[3],微小核糖核酸在癫痫发生、发展过程中发挥重要作用,其中微小核糖核酸-134(miR-134)具有调控神经元微观组织结构的生物学功能,对局部神经回路的兴奋性产生影响[4]。抑制miR-134表达可能发挥直接保护神经系统的作用[5]。研究结果显示,神经细胞的存活主要依赖胞内磷脂酰肌醇-3-激酶(phosphatidy linositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB;亦称为Akt)信号通路的激活,故PI3K/Akt通路在TLE海马神经元的存活中发挥重要作用[6]。本研究通过构建幼鼠TLE动物模型探讨抑制miR-134表达对TLE海马神经元保护作用,以及可能的作用机制。
1 材料和方法
1.1 动物选取出生21 d的SD大鼠幼鼠40只,体质量平均为(50.5±4.6)g,雌雄各半,购自皖南医学院动物实验中心,由专人在清洁级动物房内饲养。根据数字表法将幼鼠随机分为正常对照组、TLE模型组、miR-134抑制组、PI3K/Akt信号通路抑制剂组(以下简称“LY294002组”),每组各10只,雌雄各半。本实验操作符合动物实验伦理规范要求。
1.2 主要试剂和仪器miR-134抑制剂购自上海吉玛制药有限公司,PI3K/Akt信号通路抑制剂(LY294002)购自美国Sigma公司,miR-134引物由北京赛百盛基因技术有限公司合成,神经元抗核抗体(Neu-N)及p-Akt、p70s6k、GSK-3β、Caspase-3羊抗鼠单克隆抗体购自北京中山生物技术有限公司,免疫组织化学、实时定量聚合酶链反应(RT-PCR)及蛋白质免疫印迹法(Western blot,WB)配套试剂盒均购自中国碧云天生物技术有限公司,电泳检测仪及转移槽购自北京菁美瑞科技有限公司,凝胶图像成像分析系统购自上海嘉鹏科技有限公司。
1.3 方法
1.3.1TLE造模:根据Levsque等[7]方法采用腹腔注射海人酸(kainic acid,KA)法构建TLE动物模型,KA注射剂量为按体重12 mg/kg。根据Racine[8]相关标准对造模进行分级:Ⅰ~Ⅱ级:轻型发作;Ⅲ级:中型发作;Ⅳ~Ⅴ级:重型发作。将Ⅳ级及以上癫痫发作定义为TLE造模成功,持续观察2 h后按体重350 mg/kg给予水合氯醛腹腔注射终止癫痫发作。正常对照组幼鼠不做特殊处理。miR-134抑制组幼鼠于造模前30 min,给予侧脑室注射miR-134抑制剂。简要步骤为:按体重350 mg/kg水合氯醛腹腔注射麻醉幼鼠,将头固定在立体定位仪上,于幼鼠前囟后1 mm,旁开1.5 mm处钻透颅骨组织,将微量注射器沿钻孔垂直进入硬膜下4.0 mm部位处,缓慢注射5 μL miR-134抑制剂(20 ng/μL)至海马CA1、CA3区,最后以生物胶封口处理并缝合皮肤组织。LY294002组幼鼠于模型前30 min给予侧脑室注射5 μL miR-134抑制剂+5 μL LY294002至海马区,浓度均为20 ng/μL。2周后处死幼鼠,取大脑海马组织,制备匀浆液及组织切片。
1.3.2行为学检测:TLE造模成功后采用Morris水迷宫检测各组幼鼠行为学改变。(1)逃避潜伏期:反映幼鼠学习记忆能力,记录从入水至爬上水下平台的时间,每天检测1次,连续5 d,取均值;(2)跨越次数:反映幼鼠空间记忆能力,记录2 min内搜寻并穿越平台区域的次数。
1.3.3miR-134表达水平:采用RT-PCR检测幼鼠海马组织miR-134表达水平。提取幼鼠海马组织总RNA,采用逆转录方法合成cDNA,以U6为实验内参,miR-134引物序列设计为:5′-GCGTACCAGAGGGAAAAAA-3′,5′-TGGGCCACCTAGTCACCAA-3′。实验步骤按试剂盒说明书操作,采用2-△△CT法计算miR-134表达水平。
1.3.4海马病理学检测:采用HE染色海马CA1、CA3区组织,置光学显微镜下进行摄片,观察海马病理学变化。
1.3.5Neu-N阳性细胞数检测:采用免疫组织化学检测各组幼鼠海马CA1、CA3区组织Neu-N阳性细胞数。组织切片经常规方法脱蜡至水,采用5%(质量浓度)BSA溶液室温封闭处理5 min,添加一抗(Neu-N浓度为1∶100)室温孵育过夜并以PBS溶液洗涤3次,添加二抗于37℃温度下孵育30 min,再次以PBS溶液洗涤3次,二氨基联苯胺溶液显色,常规固定,光学显微镜下摄片。观察幼鼠海马CA1和CA3区组织Neu-N阳性细胞数(呈棕黄色染色),随机选择每只幼鼠6张切片计数阳性细胞,取均值。
1.3.6PI3K/Akt信号通路相关蛋白检测:采用Western blot法法进行检测。常规方法提取脑组织蛋白质,BCA法进行蛋白定量,上样量50 μg,聚丙烯酰胺凝胶电泳(SDS-PAGE),电转移至PVDF膜,5%(质量浓度)脱脂牛奶室温封闭2 h,根据PVDF膜面积加入一抗,除β-actin抗体浓度为1∶5000外,余浓度均为1∶500,4℃温度条件下孵育过夜,PBS溶液清洗3~4次后,加入辣根过氧化酶-IgG(1∶2000)室温孵育2 h,ECL显色,在荧光凝胶成像系统中显像,摄片,保存记录。采用凝胶图像处理系统分析p-Akt、p70s6k、GSK-3β、Caspase-3信号通路蛋白的相对表达量。
1.4 统计学处理采用SPSS 20.0进行统计学分析,对数据进行正态性和方差齐性检验,符合正态分布的计量资料以均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用LSD法。以P<0.05为差异有统计学意义。
2 结果
2.1 各组行为学检测结果TLE模型组及LY294002组各死亡2只,miR-134抑制组死亡1只,正常对照组无死亡。与正常对照组比较,另3组逃避潜伏期均延长,跨越次数减少(均P<0.05),miR-134抑制组幼鼠逃避潜伏期较TLE模型组和LY294002组缩短,跨越次数增加(均P<0.05),而TLE模型组和LY294002组间逃避潜伏期、跨越次数比较无统计学差异(P>0.05)。结果见表1。
2.2 各组海马miR-134表达与正常对照组比较,另3组海马组织miR-134表达水平均升高(均P<0.05),且miR-134抑制组、LY294002组海马miR-134表达低于TLE模型组(均P<0.05),而miR-134抑制组和LY294002组间比较无统计学差异(P<0.05)。具体结果见表1。
2.3 各组海马组织病理学检测正常对照组海马CA1、CA3区组织结构未见异常;TLE模型组及LY294002组可见海马CA1、CA3区神经元广泛丢失,组织呈疏松水肿表现;miR-134抑制组CA1、CA3区组织结构及海马神经元损伤程度较TLE模型组及LY294002组减轻(图1)。
2.4 各组海马组织Neu-N阳性细胞数比较与正常对照组比较,另3组海马CA1、CA3区Neu-N阳性细胞数均减少(均P<0.05),且miR-134抑制组Neu-N阳性细胞数高于TLE模型组及LY294002组(P<0.05),而TLE模型组及LY294002组Neu-N阳性细胞数比较无统计学差异(P>0.05)。结果见表1、图2。
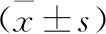
表1 各组SD幼鼠Morris水迷宫以及海马miR-134和Neu-N阳性细胞检测结果

图1 各组SD幼鼠海马CA1区、CA3区病理学检查结果(HE染色,×200)

图2 各组SD幼鼠海马CA1区、CA3区Neu-N阳性细胞表达比较(免疫组化,×100)
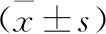
表2 各组SD幼鼠海马PI3K/Akt信号通路相关蛋白相对表达水平比较
2.5 各组海马PI3K/Akt信号通路相关蛋白表达与正常对照组比较,另3组海马p-Akt、p70s6k、GSK-3β、Caspase-3蛋白表达均升高(P<0.05),且miR-134抑制组p-Akt、p70s6k、GSK-3β蛋白表达高于TLE模型组和LY294002组(P<0.05),Caspase-3蛋白表达低于TLE模型组和LY294002组(P<0.05),而TLE模型组和LY294002组间上述蛋白表达比较无统计学差异(P>0.05)。结果见表2及图3。
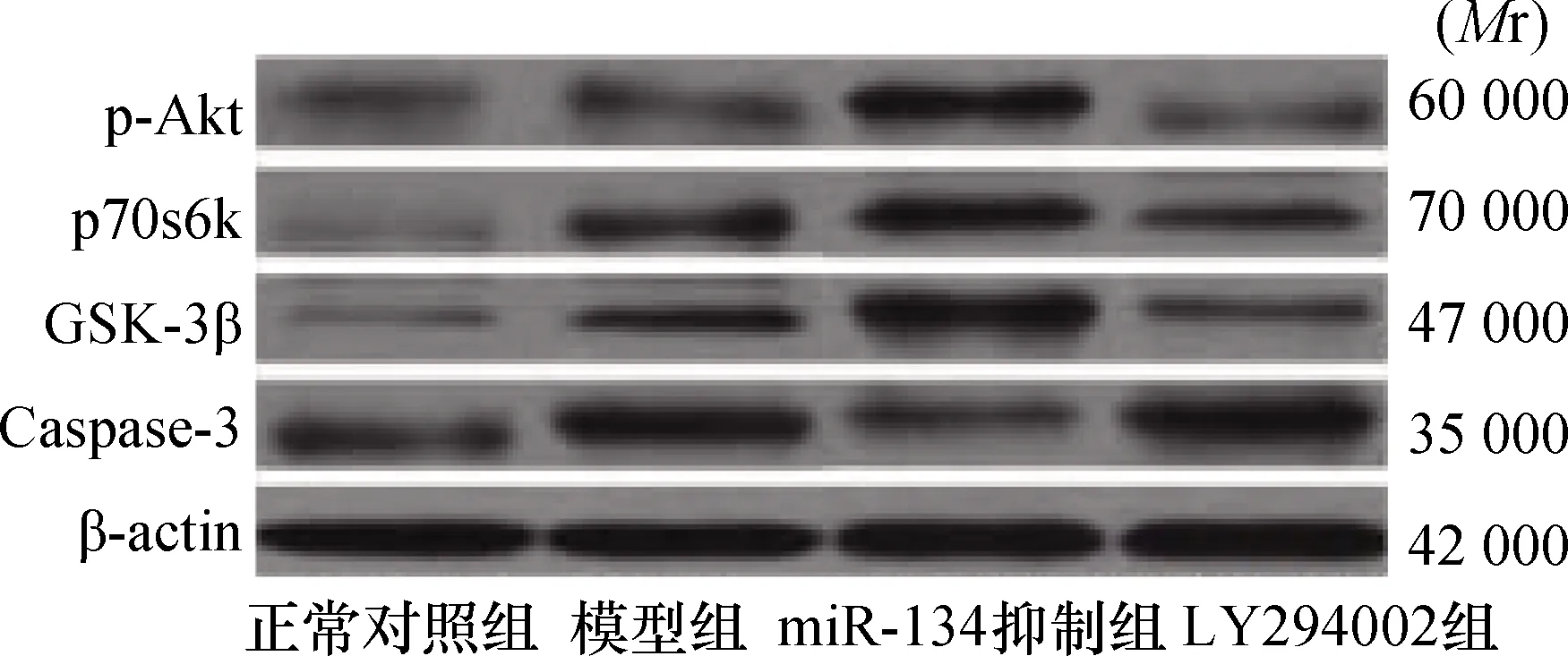
图3 各组SD幼鼠海马PI3K/Akt信号通路相关蛋白表达(Western blot法)
3 讨论
miR-134在神经元增殖分化、凋亡及微观组织结构改变等方面发挥重要作用。研究发现[9],幼鼠海马神经元miR-134呈高表达,当miR-134表达明显升高时可使神经元树突棘呈粗短改变,影响神经元突触的强度及可塑性。国外研究发现[10],TLE患者及动物模型海马组织miR-134表达水平均明显升高,而注射miR-134抑制剂后可有效减少神经元破坏,具有抗癫痫作用[11]。针对癫痫持续状态细胞模型的实验亦发现其miR-134表达水平明显升高,采用miR-134抑制剂作用后可明显减轻神经元的高兴奋性[12]。上述研究提示抑制海马组织miR-134表达具有抗癫痫发生、保护神经元的生物学功能。但miR-134通过何种信号通路发挥保护TLE海马神经元的作用仍不明确[13]。PI3K/Akt信号通路是目前国内外研究较多的促细胞存活的重要通路,其中PI3K家族在较多细胞存活、增殖及分化等生理过程中起关键性作用[14]。PI3K激活后可导致胞膜上肌醇出现磷酸化,合成释放的第二信使结合并激活活化Akt及其他下游效应信号通路[15]。Akt是PI3K的直接下游作用靶点,正常情况下位于细胞质内,其活性表达主要通过PI3K的正性调节作用[16]。Akt磷酸化可直接或间接影响多种转录因子的表达及增强凋亡蛋白的活性功能,最终实现整个信号通路的生物学活性[17]。研究证实[18],PI3K/Akt信号通路的生理功能是抑制细胞凋亡,但在癫痫疾病中可被异常激活活化,促进癫痫的形成。故作者推测miR-134可能通过PI3K/Akt信号通路对TLE海马神经元产生作用。
本研究结果显示,通过给予幼鼠侧脑室注射miR-134抑制剂可有效抑制miR-134表达,行为学及病理学检测均发现TLE幼鼠学习记忆能力、空间记忆能力下降程度及海马区病理表现较正常对照组严重,且miR-134抑制组幼鼠行为学及病理学改变轻于TLE模型组及LY294002组,提示抑制miR-134表达可改善TLE幼鼠学习记忆能力、空间记忆能力及海马区病理严重程度,而经LY294002干预的幼鼠未出现明显改善;免疫组织化学检测结果显示,miR-134组海马CA1、CA3区组织Neu-N阳性细胞数高于TLE模型组,而LY294002组其表达与模型组比较无统计学差异,表明抑制miR-134表达可有效保护海马神经元;进一步对各组海马组织PI3K/Akt信号通路相关蛋白进行检测,结果表明抑制miR-134表达可导致p-Akt、p70s6k和GSK-3β明显升高,而Caspase-3明显下降,而应用LY294002处理后可阻止这种效应,提示其可能通过激活PI3K/Akt信号通路发挥作用。
综上所述,本研究结果显示,抑制miR-134表达具有保护TLE幼鼠海马神经元的作用,其作用机制可能与激活PI3K/Akt信号通路有关。关于miR-134是否同时还通过调控其他信号通路而发挥作用,尚需深入研究。
