血管内皮生长因子对氧糖剥离再灌注诱导的大鼠原代神经元损伤的保护作用及机制
2020-10-12周经霞陈琳陈擘璨邢槐杰闫丽敏曾超胜吴海荣黄裕盛陈接桂
周经霞 陈琳 陈擘璨 邢槐杰 闫丽敏曾超胜 吴海荣 黄裕盛 陈接桂
缺血性脑卒中是临床常见的脑血管疾病,其发病率约占脑血管疾病的70%~80%,严重威胁人类生命健康[1]。据统计,全球每年约有1500万人患缺血性脑卒中,约500万人死于该疾病[2]。研究表明,治疗缺血性脑卒中的首要问题是恢复大脑供血,但血供的恢复会造成再灌注损伤,使大脑发生不可逆性损伤,导致大脑功能受损及神经元大量死亡[3-4]。挽救神经元死亡是减轻缺血再灌注损伤的首要问题。血管内皮生长因子(vascular endothelial growth factor,VEGF)是脑损伤后中枢神经系统表达的一类神经营养因子,具有促进血管生成及细胞外基质降解的作用[5],亦具有神经营养及神经保护作用[6]。脑缺血损伤发生后,VEGF表达量明显增加,给予VEGF能明显促进神经元的存活,其作用机制与抑制炎性反应及氧化应激有关[7-8]。临床已将VEGF应用于缺血性脑卒中的治疗。红系衍生的核因子相关因子2(Nrf2)/血红素氧合酶-1(HO-1)和核因子-κB(NF-κB)通路是调控脑缺血损伤后氧化应激和炎性反应的两条重要通路[9-10],但目前关于VEGF对脑缺血损伤后氧化应激和炎症反应的调控作用是否与Nrf2/HO-1和NF-κB通路有关尚不清楚。本研究对VEGF能否通过调控Nrf2/HO-1和NF-κB通路减轻氧糖剥离再灌注(OGD/R)诱导的大鼠原代神经元损伤以及其具体作用机制进行探究。
1 材料和方法
1.1 动物取8周龄雄性SD大鼠5只及SD雌性大鼠10只,均购自成都达硕实验动物公司。
1.2 主要试剂VEGF购自美国Peprotech Inc.公司,神经元培养液及B27购自美国Invitrogen公司。CCK8试剂盒、Hoechst染色试剂盒、RIPA裂解液及BCA试剂盒购自碧云天生物科技公司。乳酸盐脱氢酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malonaldehyde,MDA)试剂盒由南京建成生物工程研究所提供。Pro-Caspase-3、Bax、Bcl-2、NF-κB p65和磷酸化NF-κB 抑制因子α(phosphorylated-NF-κB α,p-IκBα)一抗购自美国Santa Cruz公司,cleaved Caspase-3、Nrf2、醌氧化还原酶(nuinine oxidoreductase 1,NQO1)、HO-1和IκBα一抗购自英国Abcam公司。反转录试剂盒、实时定量PCR试剂盒、LipofectamineTM3000转染试剂盒由美国Invitrogen公司生产提供,siRNA Nrf2(si-Nrf2)由上海汉恒生物科技公司设计合成。Nrf2、NF-κB和GAPDH引物由美国Invitrogen公司设计合成。
1.3 方法
1.3.1神经元细胞培养:根据文献[7]报道方法操作。取怀孕18 d的孕鼠,对其腹部进行灭菌处理后,连同胎盘将乳鼠取出,于75%(体积分数)酒精中浸泡2 min中后迅速取出大脑,剥离大脑皮层并剪至1 mm3大小,用0.125%(体积分数)胰蛋白酶于37 ℃消化4 min,随后将细胞密度调整至1×106个/mL,用含有2%(体积分数)B27、0.5 mmol/L谷氨酰胺的神经元基础培养液进行培养,隔天换液1/2,7~8 d用于后续实验。
1.3.2细胞分组及处理:将培养的神经元细胞随机分为对照组、OGD/R组以及VEGF 25 ng/mL、VEGF 50 ng/mL、VEGF 100 ng/mL组,每组6个复孔。除对照组外,另4组细胞根据文献[9]报道方法进行OGD/R,将细胞加入无糖DMEM培养液,同时加入0(OGD/R组)、25、50、100 ng/mL VEGF,置缺氧培养箱中培养1.5 h。对照组细胞置正常培养液、5%(体积分数)CO2培养箱中进行培养1.5 h。然后将各组细胞培养液更换为含B27的神经元培养液,置5%(体积分数)CO2培养箱中培养24 h后进行后续实验。
1.3.3CCK8检测细胞活性:将神经元培养于96孔板中培养8 d后,将细胞按照1.3.2所描述的方法进行处理后,根据CCK8试剂盒说明书检测各组细胞活性。
1.3.4Hoechst染色检测细胞凋亡:将细胞按照“1.3.2”所描述的分组及处理方法进行处理后,根据Hoechst染色试剂盒进行染色,检测各组细胞凋亡情况。
1.3.5试剂盒检测细胞因子浓度:将细胞按照“1.3.2”描述的方法进行处理后收集各组细胞培养液,以300g离心5 min。随后参照各类细胞因子检测试剂盒说明书对各组细胞培养液中LDH、SOD、GSH-PxH和MDA的浓度进行测定。
1.3.6免疫印迹检测蛋白表达:将细胞按照“1.3.2”描述方法进行分组和处理后,弃去培养液,将细胞置于冰上并用RIPA裂解液提取蛋白,BCA试剂盒检测蛋白浓度并调平。随后每组精密取30 μg等量蛋白用10%(质量浓度)SDS-PAGE进行分离,利用半干转膜仪将蛋白质转移到PVDF膜,用浓度为5%(质量浓度)脱脂牛奶室温条件下封闭蛋白2 h,随后加入一抗,采用保鲜膜封闭后置于4 ℃冰箱中孵育过夜。次日洗去未结合一抗,加入二抗室温孵育1 h后用ECL显色液在暗室条件下曝光显影。
1.3.7细胞转染:将神经元随机分为对照组、OGD/R组、VEGF (100 ng/mL)组和VEGF+si-Nrf2组,VEGF+si-Nrf2组根据转染试剂盒说明书转染si-Nrf2,转染6 h后更换为正常培养液。除对照组外,其余组采用OGD/R诱导神经元损伤,VEGF (100 ng/mL)组和VEGF+si-Nrf2组同时给予100 ng/mL的VEGF,对照组采用正常培养液。置5%(体积分数)CO2培养箱中培养24 h,用于后续对细胞Nrf2 mRNA和NF-κB mRNA表达、细胞活性、细胞凋亡情况、氧化应激因子(SOD、MDA和GSH-Px)浓度进行检测。
1.3.8RT-PCR:将细胞按照1.3.7所描述的方法进行处理后,用缓冲液洗净细胞表面培养液,根据说明书加入适量的Trizol试剂提取细胞RNA,随后根据逆转录试剂盒说明书合成cDNA,用PCR仪对cDNA进行扩增后,采用实时定量PCR试剂盒对各组细胞的Nrf2 mRNA和NF-κB mRNA表达情况进行定量分析。
1.4 统计学处理采用统计学软件SPSS 19.0进行统计处理,对数据进行方差齐性及正态性检验,符合正态分布的计量资料采用均数±标准差表示,两组间比较采用t检验,多组均数间比较采用单因素方差分析,两两比较采用SNK检验。以P<0.05认为差异有统计学意义。
2 结果
2.1 VEGF对神经元活性的影响与对照组比较,OGD/R组神经元活性降低(t=9.079,P<0.01)。OGD/R组及不同浓度VEGF组间神经元活性比较差异有统计学意义(F=13.921,P<0.01),两两比较结果显示,与OGD/R组比较,VEGF 25 ng/mL组、VEGF 50 ng/mL和VEGF 100 ng/mL组神经元细胞活性均明显升高(P<0.05)。结果见图1。
2.2 VEGF对神经元凋亡的影响结果见图2~4。与对照组比较,OGD/R组细胞凋亡率(t= -21.694,P<0.01)、Bax/Bcl-2(t=-18.225,P<0.01)和cleaved Caspase-3/pro-Caspase-3(t= -16.679,P<0.01)比值均明显升高。OGD/R组及不同浓度VEGF组间细胞凋亡率(F=54.375,P<0.01)、Bax/Bcl-2(F=86.402,P<0.01)及cleaved Caspase-3/pro-Caspase-3(F=67.969,P<0.01)比较均有统计学差异,两两比较结果显示,与OGD/R组比较,VEGF 25、50、100 ng/mL组细胞凋亡率、Bax/Bcl-2和cleaved Caspase-3/pro-Caspase-3比值均较低(P<0.05)。

注:与对照组比较,aP<0.01;与OGD/R组比较,bP<0.05 图3 各组神经元凋亡相关蛋白表达水平及神经元凋亡率定量分析

注:A:对照组;B:OGD/R组;C:VEGF 25 ng/mL组;D:VEGF 50 ng/mL组;E:VEGF 100 ng/mL组 图4 各组神经元凋亡情况(Hoechst染色,×200)
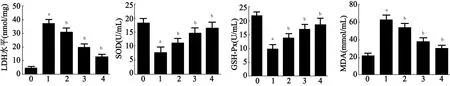
注:LDH:乳酸盐脱氢酶,SOD:超氧化物歧化酶,GSH-Px:谷胱甘肽过氧化物酶,MDA:丙二醛;下图同。与对照组比较,aP<0.01;与OGD/R组比较,bP<0.05 图5 各组神经元培养液中细胞因子表达水平比较
2.3 VEGF对氧化应激的影响与对照组比较,OGD/R组细胞培养液上清液SOD(t=9.992,P<0.01)和GSH-Px(t=13.073,P<0.01)水平明显降低,LDH(t=-25.521,P<0.01)和MDA(t=-15.609,P<0.01)水平升高。OGD/R组及不同浓度VEGF组间细胞培养液上清液SOD(F=19.609,P<0.01)、GSH-Px(F=26.7,P<0.01)、LDH(F=28.032,P<0.01)及MDA(F=60.474,P<0.01)水平比较差异均有统计学意义,两两比较结果显示,与OGD/R组比较,VEGF 25、50、100 ng/mL组细胞培养液上清液SOD和GSH-Px水平均升高(P<0.05),而LDH和MDA水平均降低(P<0.05)。结果见图5。

注:Nrf2:核因子相关因子2,NQO1:醌氧化还原酶,HO-1:血红素氧合酶-1,p-IκBα:磷酸化核因子κB抑制因子α,NF-κB:核因子-κB;下图同 图6 各组细胞Nrf2、NQO1、HO-1、p-IκBα和NF-κB p65蛋白表达比较(免疫印迹法)
2.4 VEGF对Nrf2及NF-κB信号通路的影响与对照组比较,OGD/R组细胞Nrf2(t=39.192,P<0.01)、NQO1(t=33.313,P<0.01)和HO-1(t=35.763,P<0.01)蛋白表达水平被抑制,p-IκBα(t=16.233,P<0.01)、NF-κB p65(t=26.816,P<0.01)蛋白表达水平升高。OGD/R组及不同浓度VEGF组间细胞Nrf2(F=62.841,P<0.01)、NQO1(F=53.043,P<0.01)、HO-1(F=52.529,P<0.01)、p-IκB(F=16.233,P<0.01)、NF-κB(F=26.816,P<0.01)蛋白水平比较差异均有统计学意义,两两比较结果显示,与OGD/R组比较,VEGF 25、50、100 ng/mL组细胞Nrf2、NQO1及HO-1蛋白水平均升高(P<0.05或P<0.01),而p-IκBα和NF-κB p65蛋白水平均降低(P<0.05或P<0.01)。结果见图6~7。
2.5 沉默Nrf2对VEGF减轻神经元损伤作用的影响RT-PCR检测结果显示,与对照组比较,OGD/R组细胞Nrf2 mRNA水平降低(t=41.029,P<0.01),NF-κB mRNA水平升高(t=-13.313,P<0.01);VEGF(100 ng/mL)能明显促进受损神经元Nrf2的表达(t=11.425,P<0.01),抑制NF-κB表达(t=-8.355,P<0.01);si-Nrf2能显著减弱VEGF对受损神经元Nrf2 (t=15.05,P<0.01)和NF-κB mRNA(t= -13.282,P<0.01)表达的调控作用(图8)。si-Nrf2能明显减弱VEGF增强受损神经元活性、抑制神经元凋亡的作用,减弱VEGF对SOD、GSH-Px分泌的促进作用及对MDA分泌的抑制作用(图9~12)。
3 讨论
缺血再灌注是指组织缺血后血管的恢复导致组织损伤加重的现象。研究表明,脑缺血可导致脑组织氧及营养物质的缺乏,但血供的恢复又可通过调控氧化应激等通路导致细胞损伤及死亡[11-12]。神经元细胞死亡是导致脑缺血后神经功能紊乱的主要原因[13]。研究结果显示,促进缺血再灌注损伤后神经元的修复及再生与大鼠脑损伤后的修复程度呈正比[14]。因此,保护神经元是治疗缺血再灌注损伤的策略之一。VEGF在中枢神经系统疾病发展过程中发挥重要的调控作用,大量体内外实验研究表明VEGF对神经元具有明显的保护作用,对缺血再灌注损伤的修复具有明确的促进作用[7,15-17]。本研究亦发现,VEGF 25、50、100 ng/mL时均能明显提高OGD/R损伤后的神经元活性,抑制神经元凋亡,对抗凋亡蛋白Bcl-2的表达具有明显的促进作用,对促凋亡蛋白Bax和cleaved Caspase-3的表达具有明显的抑制作用,表明VEGF对神经元具有明显的保护作用。
缺血组织再灌注会导致大量活性氧及氮的产生,导致氧化还原紊乱及永久性的线粒体损伤,最终导致大量神经细胞凋亡[18]。抑制氧化应激能显著减轻缺血再灌注损伤[19-20]。本研究结果显示,OGD/R能显著降低神经元培养液上清液中抗氧化酶SOD、GSH-Px水平并升高脂质过氧化产物MDA水平。SOD和GSH-Px是人体抵抗氧化损伤的首要防线,能通过清除体内氧化自由基及过氧化产物等减轻组织损伤[21]。VEGF能显著促进受损后神经元SOD和GSH-Px的分泌,减少MDA的分泌,提示VEGF能通过抑制氧化应激减轻OGD/R诱导神经元的损伤。
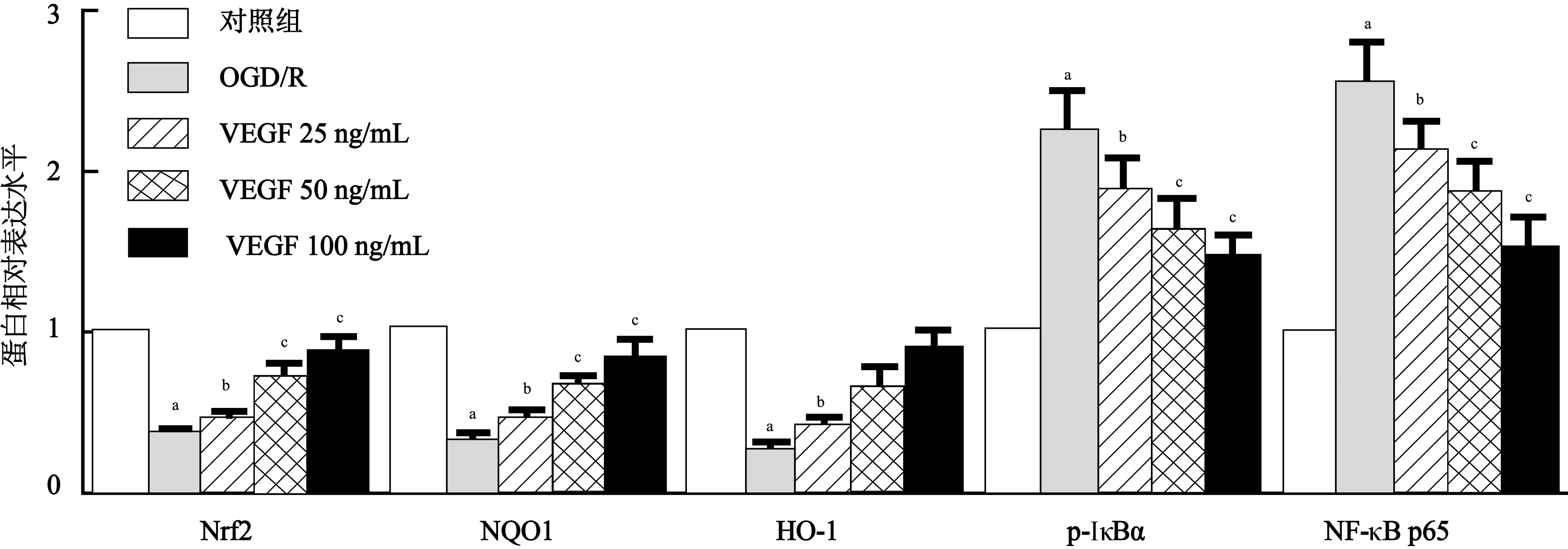
注:与对照组比较,aP<0.01;与OGD/R组比较,bP<0.05,cP<0.01 图7 各组细胞Nrf2、NQO1、HO-1、p-IκBα和NF-κB p65蛋白表达水平比较
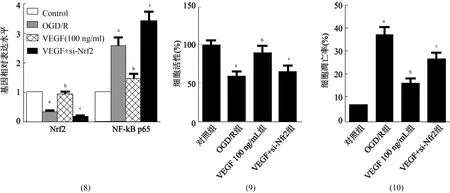
注:与对照组比较,aP<0.01;与OGD/R组比较,bP<0.01;与VEGF 100 ng/mL组比较,cP<0.05 图8 RT-PCR检测各组SD孕鼠大脑神经元Nrf2 mRNA和NF-κB mRNA表达水平比较与对照组比较,aP<0.01;与OGD/R组比较,bP<0.01;与VEGF 100 ng/mL组比较,cP<0.05 图9 CCK8法检测各组细胞活性结果 图10 各组神经元细胞凋亡率定量分析
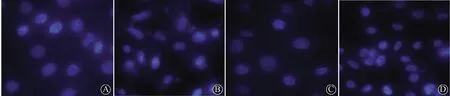
注:A:对照组;B:OGD/R组;C:VEGF 100 ng/mL组;D:VEGF+si-Nrf2组 图11 各组细胞凋亡情况比较(Hoechst染色,×200)

注:与对照组比较,aP<0.01;与OGD/R组比较,bP<0.01;与VEGF 100 ng/mL组比较,cP<0.05 图12 各组神经元培养液中细胞因子表达水平比较
Nrf2是一类亮氨酸拉链转录因子,具有调控包括抗氧化蛋白、药物转运蛋白、解毒酶及一些细胞保护蛋白表达的作用[22]。研究表明,Nrf2/HO-1信号通路活性在缺血再灌注损伤后明显被抑制,激活Nrf2/HO-1信号通路能明显促进抗氧化的表达和药物代谢酶的表达,从而减轻活性氧诱导的组织损伤[23]。Wang等研究发现,VEGF能通过减轻双侧颈总动脉结扎法(2-VO)诱导的神经元氧化应激损伤[5],但作用机制是否与调控氧化应激经典通路Nrf2/HO-1信号通路有关尚不清楚。本研究结果显示,VEGF能促进受损神经元Nrf2、HO-1和NOQ1蛋白的表达,利用si-Nrf2沉默Nrf2表达后,VEGF对神经元活性的促进作用及抑制神经元凋亡的作用减弱。HO-1和NOQ1均为Nrf2发挥抗氧化作用的重要下游靶蛋白,Nrf2转移入核能通过促进HO-1和NOQ1表达促进抗氧化酶的表达[24]。结合上述研究结果表明VEGF对OGD/R诱导神经元损伤的保护作用与激活Nrf2/HO-1通路密切相关。
NF-κB信号通路是调控细胞炎性反应的重要信号通路,在神经元受损后激活程度明显升高[8]。Mo等[8]研究表明,VEGF可通过调控NF-κB信号通路减轻缺氧诱导的PC12细胞损伤。本研究发现,VEGF还能明显抑制受损神经元NF-κB p65和p-IκBα的蛋白表达,沉默Nrf2表达能明显抑制NF-κB基因的表达,提示VEGF减轻OGD/R诱导的神经元损伤作用可能与抑制NF-κB信号通路有关。
综上所述,本研究结果显示,VEGF能明显减轻OGD/R诱导的神经元损伤及神经元细胞凋亡,促进受损神经元抗氧化酶的分泌,减少氧化产物的产生,促进Nrf2/HO-1通路蛋白表达,抑制NF-κB通路蛋白的表达,沉默Nrf2能明显抑制NF-κB基因表达,减弱VEGF对受损神经元的保护作用及对氧化应激的抑制作用,其作用机制与促进Nrf2信号通路激活并抑制NF-κB通路激活有关。有关VEGF对OGD/R的具体作用机制还需一步研究,为VEGF应用于临床缺血性脑卒中的治疗提供更多实验数据。
