猪繁殖与呼吸综合征病毒GP5蛋白的原核表达及多克隆抗体制备
2020-10-10乌吉斯古楞刘亭岐巨敏莹刘建奇宋庆庆关平原
乌吉斯古楞,刘亭岐,巨敏莹,张 斌,韩 宇,刘建奇,宋庆庆,关平原
(1.内蒙古农业大学兽医学院,农业部动物疾病临床诊疗技术重点实验室,内蒙古呼和浩特 010018;2.金宇保灵生物药品有限公司,兽医疫苗国家工程实验室,内蒙古呼和浩特 010020)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起的猪的一种传染性疾病,又称为“猪蓝耳病”[1]。各品种和日龄的猪均可感染该病,主要引起妊娠母猪早产、流产、产死胎或木乃伊胎,仔猪呼吸困难。1987年美国首次发现该病,1996年我国郭宝清等[2]从流产死胎中分离到PRRSV并命名为CH-1a株,从而首次证实我国存在该病,其后我国大部分地区相继检出PRRSV[3]。根据全球范围内的流行状况和病毒基因特征可将PRRSV分为欧洲型和美洲型,其中在我国主要流行的是美洲型[4]。
PRRSV为囊膜病毒,属于套式病毒目(Nidoviraie)、动脉炎病毒科(Arterivirdae)、动脉炎病毒属(Arterivirus),病毒粒子直径为50~65 nm,核衣壳大小为25~35 nm,核衣壳呈现立体对称的二十面体,其表面具有明显的纤突状结构[5]。其核酸不分节段,为单股正链RNA,大小约为15 kb,包括8个开放阅读框架,共编码RNA聚合酶(非结构蛋白)以及GP2、GP3、GP4、GP5、M(基质蛋白)和N(核衣壳蛋白)等7种蛋白[6]。
GP5蛋白是由ORF5开放阅读框编码的糖基化囊膜蛋白,又称E蛋白,相对分子质量为25 kDa左右[7]。研究发现,GP5蛋白的糖基化可能引起病毒的免疫逃逸,降低机体免疫力和抗体产生的能力,其功能区一旦缺失了糖基化的残基,可导致PRRSV对中和抗体的敏感性提高,同时中和位点的抗原性将增强[8]。到目前为止,对PRRSV的复制机制和致病机理还不甚了解[9]。因此,至今未能找到有效防控PRRS的方法。本研究在原核表达PRRSV GP5蛋白的基础上制备其多克隆抗体,为进一步研究相关免疫保护性提供了试验依据。
1 材料与方法
1.1 材料
1.1.1 毒株与细胞 PRRSV PC株、Marc-145细胞,均由金宇保灵生物药品有限公司提供。
1.1.2 试剂 Axyprep体液病毒DNA/RNA提取试剂盒,购自康宁生命科学(吴江)有限公司;pMD19-T克隆载体、限制性内切酶(HindIII、KpnI),均购自于大连宝生物(TaKaRa)工程有限公司;SuperScript&TRADE III反转录试剂盒、MiniBEST Agarose Gel DNA Extraction Kit试剂盒、Thermo Scientific GeneJET质粒小提试剂盒、NuPAGE™12%、Bis-Tris以及Mini Protein Gel,均购自赛默飞世尔科技(中国)有限公司;弗氏完全佐剂和不完全佐剂,为美国Sigma公司产品;HRP标记的山羊抗猪、山羊抗兔IgG,购自艾博抗(上海)贸易有限公司;His标签抗体,购自上海仝元生物科技有限公司;PRRSV阳性血清,由金宇保灵生物药品有限公司提供;超敏型辣根过氧化氢酶DAB显色试剂盒,购自生工生物工程(上海)股份有限公司;FITC标记的山羊抗兔IgG、DAPI染色液,购自碧云天生物技术有限公司。
1.1.3 实验动物 2月龄、体质量约1.8 kg的北京大耳白兔1只,购自达拉特旗永恒农牧业开发有限公司。
1.1.4 主要仪器 生物安全柜、PCR仪、高速冷冻离心机、5% CO2恒温培养箱、恒温振荡器、超声波细胞粉碎机、聚丙烯酰胺凝胶电泳仪、化学发光成像仪、蛋白质电泳系统和湿式转印系统、倒置荧光显微镜等,均由金宇保灵生物药品有限公司提供。
1.2 方法
1.2.1 PRRSV GP5蛋白生物信息学分析 使用DNAstar软件分析PRRSV GP5蛋白质的氨基酸、相对分子质量和等电点等指标。使用在线分析软件SignalP 4.1 Server、TMHMM、NetOGlyc 4.0 Server、NetPhos server等,分析GP5蛋白氨基酸序列的信号肽、跨膜区、糖基化位点和磷酸化位点。
1.2.2 目的基因扩增及表达载体构建 使用Axyprep体液病毒DNA/RNA提取试剂盒提取PRRSV PC株的总RNA。按照SuperScriptTMIII反转录试剂盒说明书,将提取得到的PRRSV PC株RNA反转录为cDNA。将所预测的序列信号肽去除,使用软件Primer 5.0设计GP5基因PCR扩增引物(上游引物:5'-GGTACCATGTTGGGGAAGTGCTTGA-3';下游引物:5'-AGCTTCTAGACGACCCCATTGTTC-3'),引物送生工生物工程(上海)股份有限公司合成。PCR扩增采用50 μL反应体系:Mix 25 μL、ddH2O 20 μL、上游引物2 μL、下游引物2 μL、模板1 μL。反应条件为:95 ℃预变性2 min;95 ℃变性20 s,58 ℃退火30 s,72 ℃延伸1 min,共30个循环;最后72 ℃延伸5 min。目的基因片段与pMD19-T载体在16 ℃条件下连接,构建重组质粒pMD19-T-GP5。pMD19-T-GP5和pET-32a(+)分别使用限制性内切酶HindIII和KpnI双酶切,经琼脂糖凝胶回收试剂盒分别回收GP5基因片段和pET-32a(+)载体。将回收的产物进行连接,构建重组质粒pET-32a-GP5。然后将重组质粒转化至大肠杆菌BL21(DE3)感受态细胞,次日在氨苄抗性的LB固体培养基上进行阳性克隆筛选,对阳性克隆进行摇菌提取质粒,并进行质粒双酶切鉴定。
1.2.3 GP5蛋白的诱导表达 对于双酶切验证正确的菌株,挑取单菌落接种于5 mL含有氨苄抗性的LB培养液中,37 ℃、130 r/min过夜培养;次日,以1:1 000的比例接菌于1 L含氨苄抗性的LB培养液,37 ℃、150 r/min振荡培养;培养至OD值为0.6~0.8时,加浓度为1 mol/L的IPTG,设置温度为27 ℃,150 r/min振荡培养24 h后离心收集菌体,加上适量的上清Binding Buffer,超声波细胞粉碎器进行破碎;5 000 r/min离心30 min。
1.2.4 GP5蛋白纯化及免疫印迹检测(Western Blot) 菌液离心后,上清用0.22 μm滤器过滤去除杂质;使用亲和层析方法纯化GP5蛋白,并用SDS-PAGE电泳、考马斯亮蓝染色及Western Blot(Western Blot分别用PRRSV阳性血清和His标签抗体)进行鉴定及检测。
1.2.5 GP5蛋白兔源多克隆血清制备 首次,1 mg/只的剂量将GP5蛋白与等体积的弗氏完全佐剂充分乳化,以0.5 mL/只的剂量给予北京大耳白兔背部皮下注射;2周后,以1 mg/只的剂量将GP5蛋白与等体积的不完全弗氏佐剂充分乳化后加强免疫,在加强免疫2次后采集兔血液并分离血清,作为GP5蛋白多抗血清。此外,首次免疫前采集兔血液分离血清,作为后期试验阴性血清对照。
1.2.6 GP5蛋白多抗血清ELISA效价测定 参照张永宁等[10]操作步骤,以纯化的PRRSV GP5蛋白为包被抗原,利用间接ELISA方法对制备的多抗血清进行效价测定。
1.2.7 Western Blot检测GP5多克隆血清反应性 重组蛋白GP5进行SDS-PAGE后,湿转印至PVDF膜上,用鸡卵清白蛋白4 ℃过夜封闭,用PBST缓冲液洗涤3次,每次5 min;加入稀释为1:100的多抗血清,4 ℃过夜孵育;用PBST缓冲液洗涤3次,每次5 min;洗涤完毕加入稀释为1:5 000的山羊抗兔IgG H&L(HRP),4 ℃过夜孵育;用超敏型辣根过氧化氢酶DAB显色试剂盒进行显色拍照。
1.2.8 间接免疫荧光法(IFA)检测GP5多抗血清免疫反应性 Marc-145细胞接种于96孔细胞培养板,当细胞汇合度达到70%时接种PRRSV,同时设阴性对照细胞;放置37 ℃、5% CO2培养箱内继续培养36 h;弃掉培养液,PBS洗涤;加预冷后的丙酮,4 ℃固定细胞30 min;用PBS稀释多抗血清至1:200,37 ℃孵育1 h;PBS洗涤3~5次,用PBS稀释FITC标记的山羊抗兔IgG抗体至1:2 000,37 ℃孵育1 h;用DAPI染液进行染核,倒置荧光显微镜下观察、拍照。
2 结果
2.1 目的片段扩增及原核质粒构建
以PRRSV总RNA反转录的cDNA为模板,用设计的上下游引物对GP5基因进行PCR扩增,得到片段大小为603 bp的目的基因(图1)目的基因与pET-32a(+)载体连接后得到pET-32a-GP5重组质粒,对重组表达质粒进行双酶切,用1%琼脂糖凝胶电泳进行检测,与预期条带相符合(图2)。

图1 GP5基因PCR扩增结果
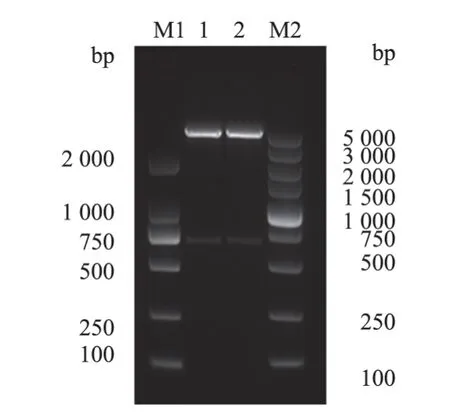
图2 pET-32a-GP5重组质粒双酶切电泳检测结果
2.2 GP5蛋白纯化
利用镍柱,对菌体裂解产物上清中的GP5蛋白进行纯化。SDS-PAGE电泳、考马斯亮蓝染色结果显示,含重组表达质粒pET-32a-GP5的菌体在IPTG的诱导下表达出了一条约30 kDa的蛋白条带(图3),通过纯化、浓缩,获得了GP5蛋白。经BCA试剂盒测定该蛋白的终浓度为223.84 μg/mL。
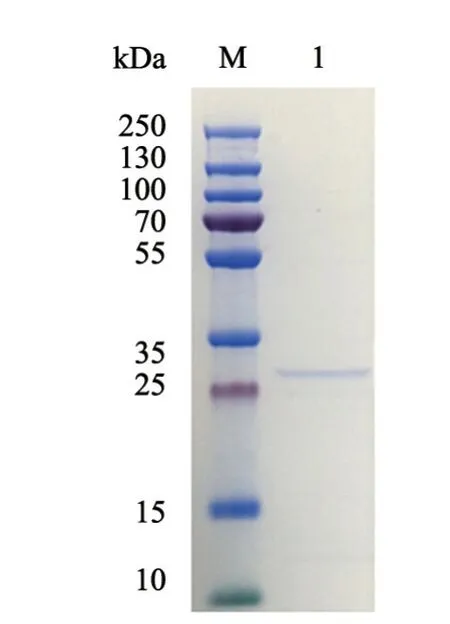
图3 GP5蛋白考马斯亮蓝染色结果
2.3 GP5蛋白Western Blot检测
对纯化后的表达蛋白进行Western Blot鉴定,100 V电压下转膜80 min,一抗分别孵育PRRSV阳性血清(图4)、His标签抗体(图5)后,结果均有较为明显的目的条带。

图4 孵育PRRSV阳性血清后Western Blot检测结果
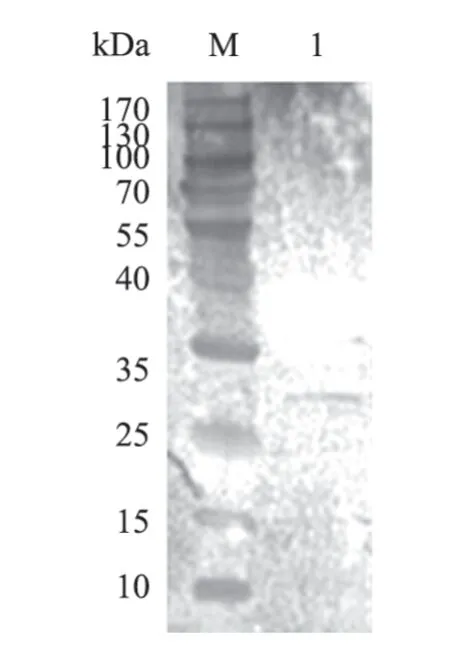
图5 孵育His标签抗体后Western Blot检测结果
2.4 GP5蛋白多抗血清Western Blot检测
利用制备的兔多抗血清对表达蛋白GP5进行Western Blot检测,100 V电压下转膜80 min,孵育制备的多抗血清后有明显的目的条带(图6),说明制备的兔多抗血清与所表达的GP5蛋白有良好的反应性。
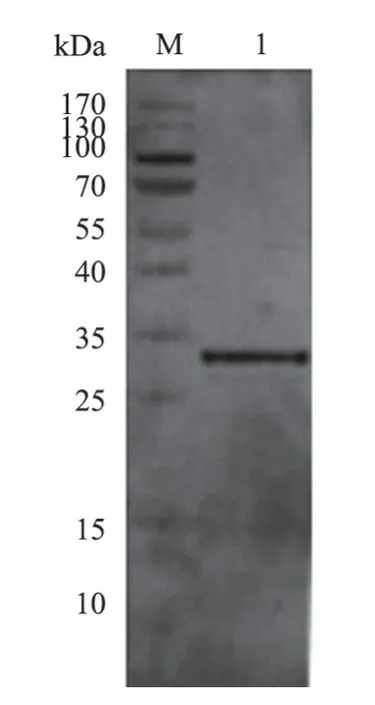
图6 GP5蛋白多抗血清的Western Blot检测结果
2.5 GP5蛋白多克隆抗体ELISA效价测定
当多克隆抗体孔的OD450nm值与阴性对照孔比值(P/N)>2.1时,多克隆抗体的最高稀释度为多克隆抗体的效价。结果(图7)显示,纯化后的兔抗GP5蛋白的多克隆抗体效价可达1:64 000。
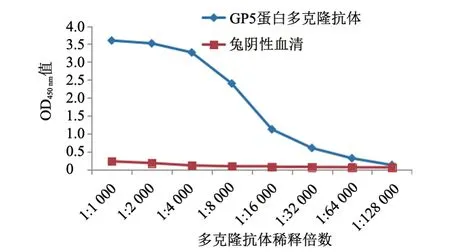
图7 GP5蛋白多克隆抗体ELISA效价测定结果
2.6 GP5蛋白多克隆抗体IFA检测
对感染PRRSV的Marc-145细胞应用GP5蛋白多克隆抗体进行IFA检测。结果(图8)显示,PRRSV感染的Marc-145细胞表现特异性的绿色荧光,而阴性对照细胞没有荧光,说明所制备的GP5蛋白多克隆抗体能够特异性识别PRRSV。
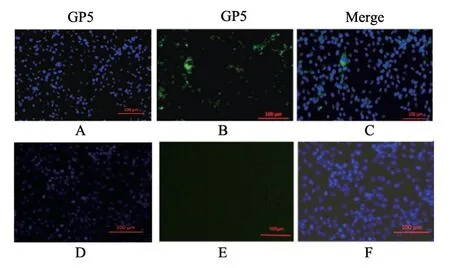
图8 GP5蛋白多克隆抗体IFA检测结果
3 讨论
PRRS是危害世界养猪业的一大疫病,自20世纪80年代在北美洲流行以来迅速波及到全球。PRRSV感染可导致母猪繁殖障碍和育肥猪呼吸道疾病[11-12]。有研究表明,若将GP5全基因序列克隆至原核表达载体中,由于PRRSV GP5蛋白具有疏水跨膜特性,其N端的信号肽序列使表达的蛋白锚定在细胞膜上导致细胞裂解,从而影响GP5蛋白的表达剂量[13-14]。周恩民等[15]将GP5基因去掉信号肽部分26个氨基酸残基编码区后进行了分段表达,获得了大量的GP5重组蛋白。杨国宇等[16]通过10种不同可溶性标签的表达载体,构建10个GP5/M表达载体,并获得高纯度的GP5/M重组蛋白,通过免疫家兔,检测出重组蛋白具有免疫原性并能刺激机体产生较高水平的中和抗体,初步鉴定了重组蛋白的免疫效力。
本试验通过分析PRRSVGP5基因的相关生物学信息,设计扩增引物,利用原核表达载体pET-32a(+)构建了pET-32a-GP5重组表达质粒,并进行GP5蛋白的诱导表达。然后,将纯化获得的GP5蛋白与弗氏佐剂充分乳化后免疫北京大耳白兔制备了GP5蛋白兔多抗血清。Western Blot、ELISA以及IFA检测结果显示,该多抗血清均表现出了特异性免疫反应,但Western Blot和ELISA反应相对较弱,推测与所纯化GP5蛋白浓度较低有关。徐彦召等[17]通过对GP5a蛋白序列分析,应用原核表达系统获得高浓度包涵体形式表达的重组蛋白,并与PRRSV阳性血清进行Western Blot试验,证实目标蛋白具有良好的反应原性。本试验中,由于仅对菌体裂解液上清中的GP5蛋白进行了收集纯化,未纯化包涵体蛋白,因此获得的GP5蛋白浓度偏低,虽然在免疫北京大耳白兔后产生了特异性的多抗血清,但Western Blot和ELISA反应性相对较弱。
综上,本研究成功构建了PRRSV pET-32a-GP5原核表达载体,并对GP5蛋白进行了大量诱导表达及纯化,获得了目的蛋白。通过免疫实验动物成功制备出GP5蛋白的多克隆抗体。PRRSV GP5原核蛋白的体外表达及多克隆抗体的成功制备,为进一步研究PRRSV血清学检测方法以及疫苗免疫效果评价提供了重要依据。
