血清α-突触核蛋白及UCH-L1水平与帕金森病的相关性研究*
2020-10-10孙江萌沈丽华胡春波
孙江萌,沈丽华*,杨 颖,胡春波
(南通大学附属医院神经内科,南通 226001)
帕金森病是老年人常见的神经退行性疾病,临床上主要表现为运动迟缓、肌强直、静止性震颤等典型运动症状。其病因不明,认为老龄、遗传因素、环境因素相互作用导致其发生。目前全球有570万帕金森病患者,我国患病人数达260万[1],为社会和家庭带来沉重的负担。α-突触核蛋白(alpha-synuclein,αsyn)是由SNCA基因编码的一种可溶性蛋白质,在中枢神经系统中高度表达,α-syn在帕金森病状态下可发生病理性聚集,由无序单体聚集成寡聚体、原纤维、纤维等形态,或进行翻译后修饰如磷酸化、硝化等,并参与路易小体的形成[2]。研究[3]发现路易小体中大约90%的α-syn存在磷酸化修饰,远高于生理状态下α-syn发生磷酸化修饰的概率。蛋白降解机制失调是帕金森病发生发展的一个核心因素。泛素蛋白酶体系统是细胞内重要的非溶酶体蛋白降解途径,参与细胞内80%以上蛋白质的降解。泛素羧基末端水解酶L1 (ubiquitin carboxy-terminal hydrolase L1,UCH-L1)是泛素蛋白酶体系统中的一种多功能酶,UCH-L1 S18Y位点基因突变与帕金森病发病存在相关性,目前关于血清UCH-L1改变与急性脑卒中、颅脑外伤等疾病的相关性研究较多,而血清UCHL1在帕金森病中的研究甚少。本研究通过分析血清α-syn及UCH-L1水平与帕金森病之间的相关性,探讨血清α-syn及UCH-L1作为帕金森病诊断生物标志物的潜在价值。
1 对象和方法
1.1 研究对象 选取2019年4月—2020年2月在南通大学附属医院神经内科门诊就诊的帕金森病患者58例(帕金森病组),均符合2015年运动障碍协会《临床帕金森病诊断标准》[4]。排除标准:存在明确病因(如脑部肿瘤、感染、外伤、药物、中毒等)导致的继发性帕金森综合征者;伴帕金森表现的其他神经变性疾病者:如多系统萎缩、核上性麻痹等;近期发生脑卒中或颅脑外伤者;凝血功能异常、全身感染性疾病、恶性肿瘤等严重疾病者。根据Hoehn-Yohr(H-Y)分级表将帕金森病组分为早期组(1~2.5级)42例与中晚期组(3~5级)16例,同时选取性别、年龄与帕金森病患者相匹配的我院同期健康体检者作为对照组,共纳入42例。所有入选对象均签署知情同意书。
1.2 研究方法 抽取所有研究对象晨间空腹肘正中静脉血标本10 mL,高速恒温离心机2~8 ℃条件下2 000 g/min离心10 min,取上清-80 ℃冰箱保存,分别利用酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)检测所有受试者血清总α-syn、磷酸化α-syn水平及UCH-L1水平。
1.3 统计学方法 所有数据均应用SPSS 21.0统计软件进行分析,符合正态分布的计量资料以表示,计数资料以百分比(%)表示。符合正态分布的计量资料两组间比较采用独立样本t检验,非正态分布资料采用秩和检验,计数资料采用χ2检验,采用受试者工作特征(receiver operating characteristic,ROC)曲线,计算相关参数对诊断帕金森病的敏感度和特异度。P<0.05表示差异有统计学意义。
2 结果
2.1 一般资料比较 帕金森病组男28例,女30例,年龄(64.93±9.88)岁;对照组男20例,女22例,年龄(62.05±8.76)岁,两组年龄、性别比较差异均无统计学意义(χ2=0.01、t=-1.51,P=0.95、0.13)。帕金森病早期组与中晚期组年龄、性别、发病年龄比较差异均无统计学意义(均P>0.05),病程比较差异有统计学意义(P<0.01),见表1。
表1 帕金森病早期组与中晚期组一般资料的比较(,n,%)
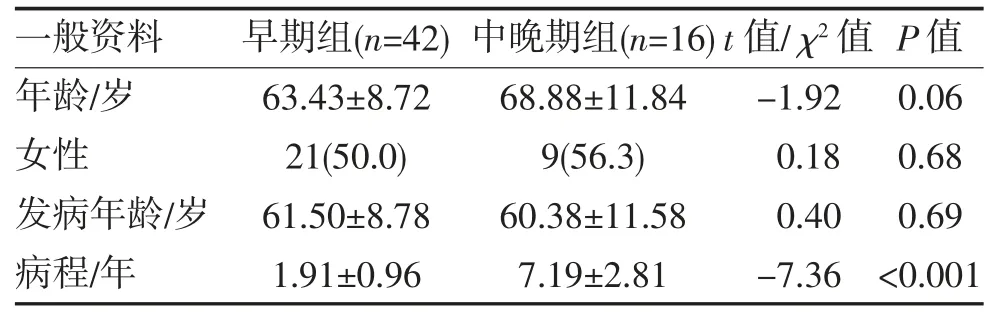
表1 帕金森病早期组与中晚期组一般资料的比较(,n,%)
2.2 各指标水平比较 帕金森病组与对照组血清总α-syn、磷酸化α-syn、UCH-L1比较差异均有统计学意义(均P<0.05),见表2;早期组与中晚期组血清磷酸化α-syn比较差异有统计学意义(P<0.05),血清总α-syn、UCH-L1比较差异无统计学意义(P>0.05),见表3。
表2 帕金森病组与对照组血清α-syn、UCH-L1比较()
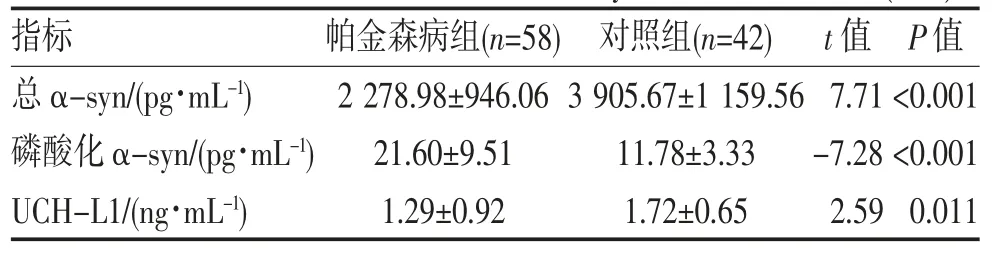
表2 帕金森病组与对照组血清α-syn、UCH-L1比较()
表3 帕金森病早期组与中晚期组血清α-syn、UCH-L1比较()

表3 帕金森病早期组与中晚期组血清α-syn、UCH-L1比较()
2.3 血清总α-syn、磷酸化α-syn、UCH-L1对帕金森病的预测价值 对帕金森病组及对照组血清总α-syn、磷酸化α-syn、UCH-L1行ROC曲线分析,血清总α-syn、磷酸化α-syn、UCH-L1识别帕金森病患者的曲线下面积(area under curve,AUC)分别为0.147(95%CI:0.068~0.227)、0.890(95%CI:0.829~0.952)及0.276(95%CI:0.178~0.375),其中血清磷酸化α-syn识别帕金森病患者的AUC>0.5,截断值为12.33 pg/mL,敏感度为89.7%,特异度为71.4%,对帕金森病有较高的诊断价值,见图1。
3 讨论
目前帕金森病临床诊断主要依靠患者的临床症状及左旋多巴的治疗效果等,对帕金森病早期生物标志物的筛选一直是医学界亟待解决的问题。近年来对帕金森病患者血液α-syn水平的研究较多,但结果有所差异[5-7]。本研究结果显示帕金森病组血清总α-syn水平较对照组低(P<0.05),磷酸化α-syn水平较对照组高(P<0.05);且早期组磷酸化α-syn水平较中晚期组低(P<0.05)。提示血清总α-syn水平、磷酸化α-syn与帕金森病发生可能存在相关性,且磷酸化α-syn可能与帕金森病的病情进展密切相关。本研究结果与Q.X.LI等[8-9]的研究结果相符。ROC曲线分析发现血清磷酸化α-syn对帕金森病有较高的诊断价值,提示血清磷酸化α-syn是诊断帕金森病的较好的潜在生物标志物。
研究[10-11]提示泛素蛋白酶体系统功能失调的溶酶体清除机制也能促进可溶性α-syn低聚物的积累,可能是帕金森病进展的关键因素之一,一氧化氮可通过损害泛素蛋白酶体系统而导致蛋白质异常积累[12]。UCH-L1是泛素蛋白酶体系统中的一种多功能酶,帕金森病模型大鼠中脑黑质区UCH-L1较正常组明显减少。E.LEROY等[13]在一个常染色体显性遗传的帕金森病家系中发现UCH-L1基因的错义突变(I93M);另D.M.MARAGANORE等[14]还发现UCHL1 S18Y位点基因突变与帕金森病发病也存在相关性。有研究[15-16]显示血清UCH-L1在急性脑卒中、颅脑损伤中有变化,但对血UCH-L1水平与帕金森病的相关性研究尚未见报道,本研究结果显示帕金森病血清UCH-L1水平较对照组低(P<0.05),考虑在帕金森病病理状态下,泛素-蛋白酶体系统受损,UCHL1水平下降,细胞内异常蛋白质的清除能力减弱,细胞毒性增强,导致神经元的坏死、丢失。
但本研究作为一项病例对照研究,样本量偏少,可能存在选择偏倚,有待在今后扩大样本量,进一步提高研究质量。
