先天性心脏病术后房、室间隔残余分流的介入治疗
2020-10-09肖家旺王琦光张端珍韩秀敏孟立立庚靖淞赵明朱鲜阳
肖家旺 王琦光 张端珍 韩秀敏 孟立立 庚靖淞 赵明 朱鲜阳
先天性心脏病(congenital heart disease,CHD)是一种常见的先天性畸形,占全部活产婴儿的6%~10%,国内每年估计有15万~20万CHD婴儿出生[1]。大多数CHD患者通过外科手术或介入治疗可治愈。据不完全统计,我国每年CHD总手术量达10万余例,其中介入治疗约3万例,复杂CHD外科手术约4000例,手术治疗量为每年新增病例的70%[2]。无论是外科手术,还是介入封堵,仍有少数患者会有残余病变,其中最常见的就是房、室间隔的残余分流。这部分患者由于局部瘢痕组织粘连,行再次开胸手术不仅难度高、创伤大,而且术后仍有残余分流的可能,多数患者难以接受[3]。20世纪90年代Amplatzer系列封堵器问世后,CHD介入治疗进入发展的快车道,也为CHD术后残余分流提供新的治疗方法。本研究通过观察CHD介入封堵或外科修补术后残余分流患者再次行介入封堵治疗的长期随访结果,评价此类患者介入封堵治疗的安全性及有效性。
1 对象与方法
1.1 研究对象
选取2011年6月—2018年10月于中国人民解放军北部战区总医院先心病内科住院治疗的21例CHD介入封堵或外科修补术后房、室间隔残余分流并接受经导管介入封堵治疗的患者,其中男13例,女8例;年龄4~53(27.1±16.8)岁;介入封堵治疗距离矫治手术时间为1~40(16±12)年。纳入标准:(1)经体格检查、心脏大血管CT血管成像(computed tomography angiography,CTA)或超声心动图检查确诊CHD,并行心外科修补术或介入封堵术;(2)手术治疗后仍有房间隔或室间隔残余分流;(3)参照《儿童常见先天性心脏病介入治疗专家共识》[4],残余分流符合介入封堵治疗适应证;(4)患者本人及家属同意接受介入封堵治疗。排除标准:(1)合并严重肝、肾疾病者;(2)合并感染性心内膜炎者;(3)合并心肌或心脏瓣膜疾病者;(4)严重肺动脉高压,出现艾森曼格综合征;(5)合并其他需外科手术治疗的心脏疾病。
1.2 方法
1.2.1 房间隔残余分流封堵术 局部麻醉或静脉基础麻醉后穿刺右股静脉,送入端孔导管至右心房经房间交通至左心房→左上肺静脉,导入长260 cm加硬导丝,沿导丝送入输送长鞘,根据超声心动图测量房间隔残余分流直径及边缘情况,选择合适类型及型号的封堵器,沿输送长鞘送入左心房,并将封堵器放置于房间隔,进行牵拉试验判断封堵器稳定性,再次行超声心动图判断封堵效果以及二、三尖瓣情况。介入封堵治疗选择国产上海形状记忆合金材料有限公司生产的房间隔缺损(atrial septal defect,ASD)封堵器或动脉导管未闭(patent ductus arteriosus,PDA)封堵器。
1.2.2 室间隔残余分流封堵术 常规消毒、麻醉后穿刺右侧股动、静脉,经右股动脉送入猪尾导管至左心室,左心室造影测量室间隔残余分流直径、形态、部位及与主动脉瓣、三尖瓣的距离,通过残余分流建立右股动脉-静脉轨道,经股静脉端沿轨道送入合适的输送长鞘,根据造影情况选择合适类型和型号的封堵器,经输送鞘管送入封堵器进行封堵。封堵后重复左心室造影及超声心动图检查,评估封堵效果及周围瓣膜情况。介入封堵治疗选择国产上海形状记忆合金材料有限公司生产的室间隔缺损(ventricular septal defect,VSD)封堵器或美国AGA公司生产的第二代动脉导管未闭封堵器(Amplatzer duct occluderll,ADO-Ⅱ)。
1.2.3 封堵术后及随访 所有患者于封堵术后24 h复查X线胸片、心电图及超声心动图检查,术后观察3 d(房间隔残余分流)或7 d(室间隔残余分流)出院,术后1个月、3个月、6个月及每年定期复查心电图及超声心动图,着重观察有无新发房室传导阻滞等心律失常、残余分流、封堵器移位或脱落、心脏瓣膜损伤等严重并发症的发生。
2 结果
2.1 21例患者一般资料情况(表1)
21例患者中ASD术后残余分流3例,VSD修补术后残余分流11例,VSD封堵术后残余分流2例,法洛四联症根治术后VSD残余分流4例,右心室双出口根治术后VSD残余分流1例。
2.2 介入封堵情况
2.2.1 房间隔残余分流 共3例患者发生房间隔残余分流,其中1例ASD封堵术后残余分流,2例ASD修补术后残余分流。ASD封堵术后患者为8岁女孩,经皮球囊肺动脉瓣成形术及ASD封堵术后5年复查超声心动图发现房间隔残余分流,约8 mm,心电图示:窦性心律,不完全性右束支传导阻滞,再次选择16号ASD封堵器进行封堵(图1)。1例ASD补片修补术后残余分流靠近下腔静脉,直径约10 mm,在3D打印技术指导下应用18/20号PDA封堵器进行封堵。
2.2.2 室间隔残余分流 如表1所示,研究共纳入18例CHD术后室间隔残余分流患者,其中封堵术后2例(图2A~D),外科术后16例;女6例,男12例。术前心电图:7例为正常心电图,6例为完全性右束支传导阻滞,2例为不完全性右束支传导阻滞,1例为左心室肥厚,1例为心房颤动,1例为ST-T改变。6例肺动脉平均压大于25 mmHg(1 mmHg=0.133 kPa)。左心室造影测量室间隔残余分流直径为(4.26±1.60)mm。16例成功进行介入封堵治疗,2例未能成功[1例因缺损细长,并与主动脉成角,无法顺利建立轨道(图2E);1例缺损直径过于细小,未行介入封堵治疗(图2F)]。16例患者中4例应用ADO-Ⅱ封堵器,12例应用国产VSD封堵器;封堵术后左心室造影显示3例存在微量分流,1例少量分流。
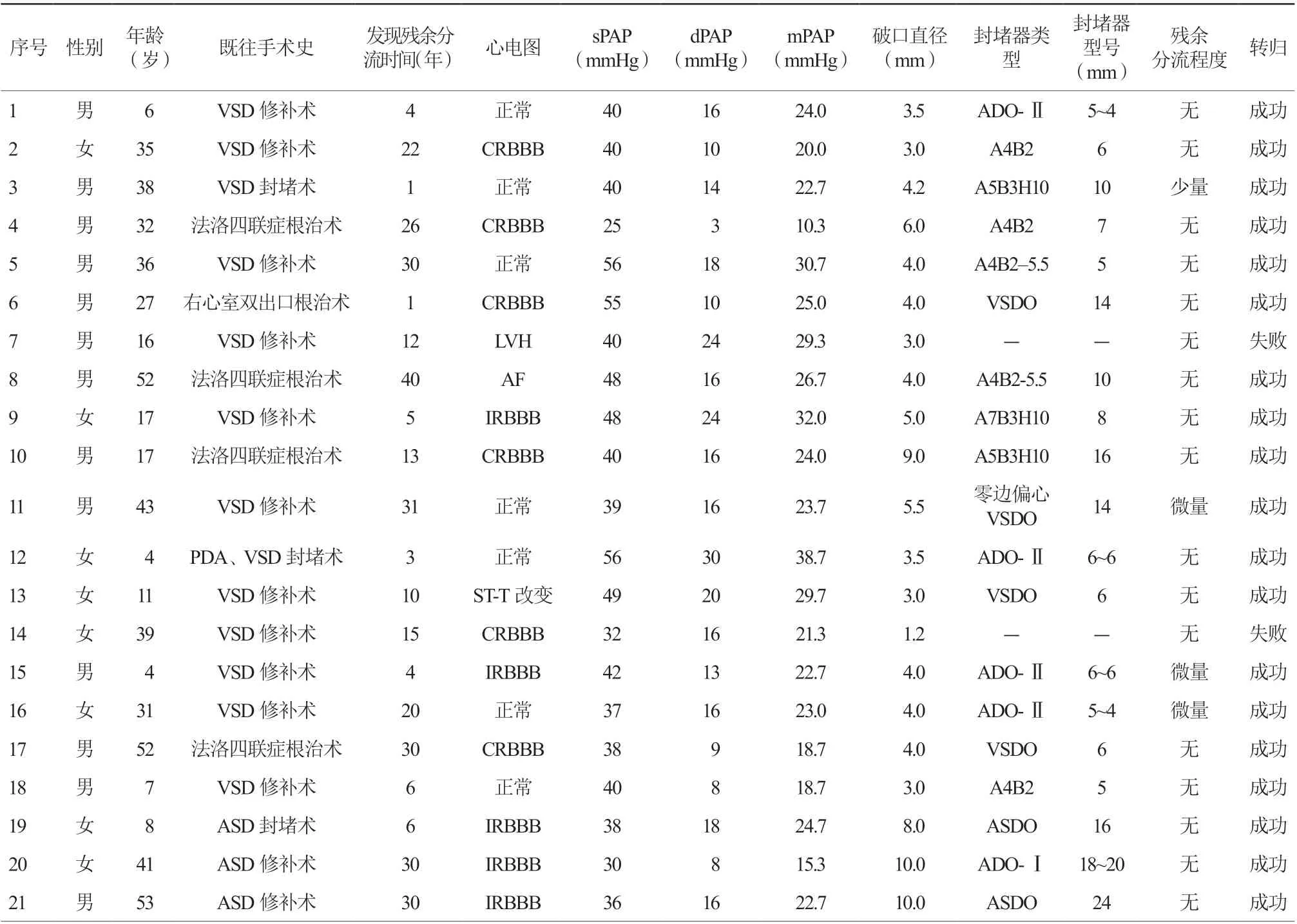
表1 21 例患者基本资料与介入封堵治疗情况
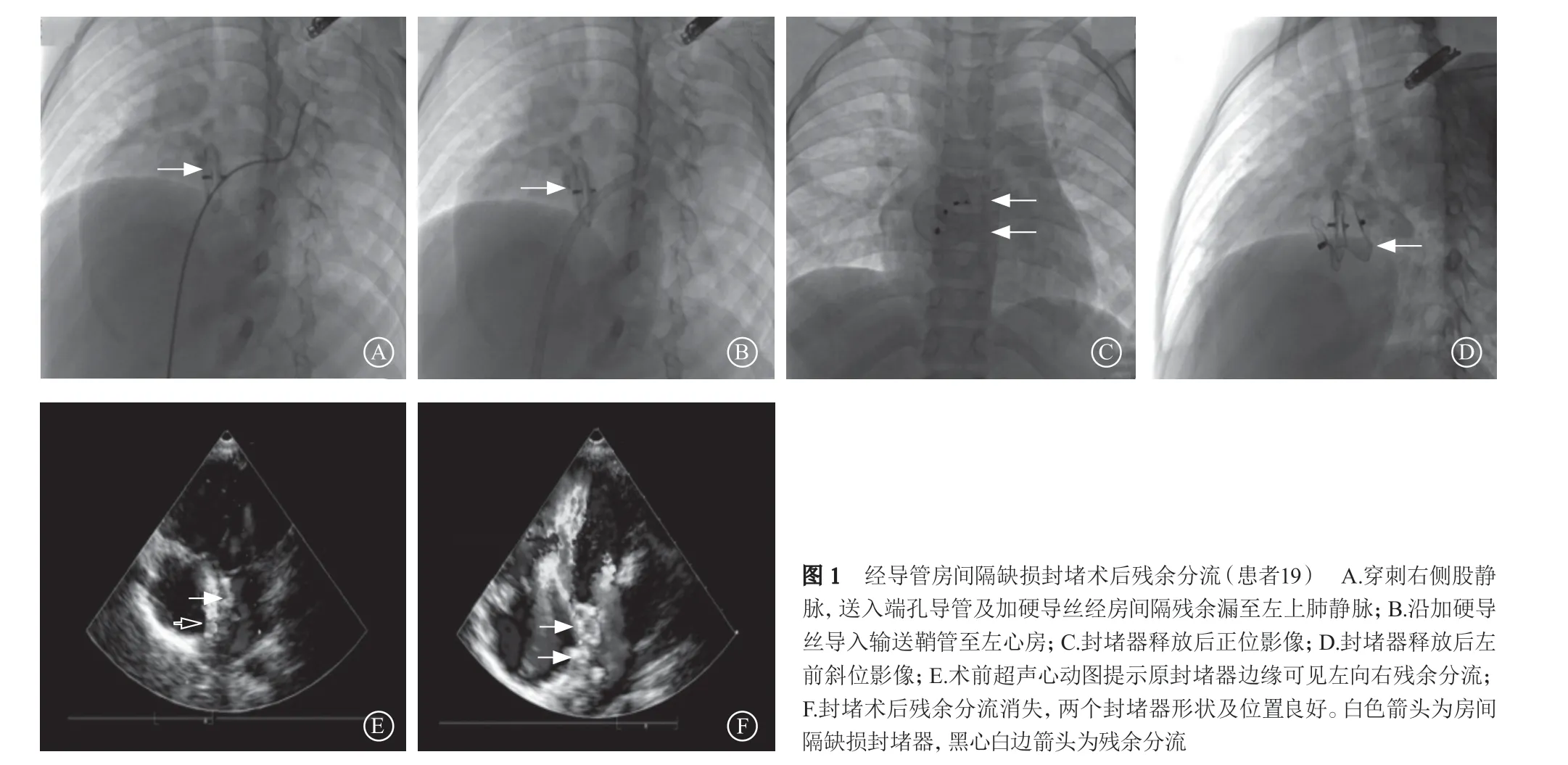
2.3 术后随访
19例成功介入封堵治疗的患者随访39(19,56)个月,术后即刻左心室造影显示2例患者室间隔有微量残余分流,无明显瓣膜反流。3个月随访时复查超声心动图示残余分流均消失。随访期间所有患者均未出现感染性心内膜炎、严重残余分流、血栓形成、封堵器移位、严重主动脉瓣反流、恶性心律失常、死亡等严重并发症。
3 讨论
1966年Rashkind等[5]首先应用球囊房间隔造口术治疗完全性大动脉转位等重症CHD婴儿,开创了CHD介入治疗之先河。尤其是近40年来材料学和方法学的不断改进,经导管介入治疗获得了长足的进展,并已成为CHD治疗的重要手段之一[6]。当然,介入治疗的范围很有限,仅有部分简单畸形可进行,如单纯ASD、VSD、PDA、肺动脉瓣狭窄、主动脉缩窄等,而外科开胸手术仍是绝大多数复杂CHD的标准治疗方法,如法洛四联症、右心室双出口、部分VSD(缺损太大、干下型、伴主动脉窦明显脱垂等)。无论何种手术方法都存在一定的心律失常、心力衰竭、残余分流、残余梗阻等并发症发生,尤其是残余分流的发生。对于外科术后患者而言,由于第一次开胸术后纵隔及胸腔严重粘连,增加手术视野暴露难度,再次开胸手术难度加大,容易损伤心脏及大血管,手术风险增高,患者多难以接受二次手术[3]。因此,无论介入封堵还是外科修补术后残余分流患者更多地选择介入封堵治疗。
CHD外科修补术后室间隔残余分流是心脏外科的主要并发症之一,其发生率为1%~10%,其中文献报道VSD修补术后残余分流的发生率为3.8%~10%[7]。ASD修补术中视野开阔,显露清晰,且左、右心房压差低,术后很少发生残余漏,临床上少有报道。ASD修补术后残余分流发生的原因主要与术式、缺损类型和缝合技术等有关,一般小于5 mm的残余分流无血流动力学意义,无需处理。大于5 mm的残余分流则需治疗,介入封堵是目前首选的治疗方法。外科术后室间隔残余分流发生的原因可能与以下因素有关[8-12]:(1)补片选择过小,缝合时针间距>3 mm,较大缺损采用直接缝合,缝合后张力较大,造成撕脱;(2)CHD修补时缝合太浅,在打结时或心脏复跳后撕脱;(3)打结时线太松导致留有间隙,或打结太紧造成组织撕裂;(4)室间隔膜部瘤多个出口,修补时遗漏;(5)三尖瓣隔瓣基底部瓣膜组织薄弱和缝线受力不均导致缝合线被撕脱;(6)对合并双腔右心室的VSD、法洛四联症或者多发肌部VSD患者,术后未仔细检查残余漏口;(7)伴有VSD的复杂CHD患者,缺损往往较大,位置特殊,对手术缝合技术要求高,术后容易出现残余分流。本研究中外科VSD修补术后残余分流11例,法洛四联症根治术后VSD残余分流4例,右心室双出口根治术后VSD残余分流1例。
而经导管介入封堵治疗术后则很少发生残余分流,仅在少数特殊情况下出现,如封堵器类型及型号选择不当、术后封堵器移位、多孔型缺损等。随着CHD介入封堵治疗随访时间不断延长,随访中逐渐出现封堵术后伞中残余分流或封堵器移位致残余分流而引起关注。本研究中3例为经导管介入封堵术后房、室间隔残余分流,分别为ASD封堵术1例,VSD封堵术后2例。目前认为经导管介入封堵术后残余分流的原因主要有[13-15]:(1)早期国产封堵器内阻流体主要成分为聚氨酯海绵,填充材料工艺尚不成熟,随着封堵器内物质的逐步吸收或破损,残余分流逐渐增多。(2)封堵器选择过大,不能完全恢复原始体外形状,内皮化不完全,远期随访可逐渐出现残余分流。(3)封堵器类型选择不当,对于巨大VSD,早期缺乏大型号的封堵器,部分经验不足的中心选择ASD封堵器进行替代。(4)多发缺损造成遗漏。(5)封堵器选择偏小或边缘软薄,术后发生移位,或房间隔不在一平面、成角,封堵器磨蚀房间隔,从而出现残余分流。本研究中有1例患者就是这种情况。患者经皮球囊肺动脉瓣成形术及ASD封堵术后,首次封堵术后早期复查超声心动图均未见残余分流,术后5年复查时则发现约8 mm房间隔残余分流,推测可能与封堵器磨蚀有关,再次置入一枚封堵器成功进行封堵。
ASD和VSD术后残余分流的介入封堵治疗适应证、技术规范和操作步骤均与CHD常规介入封堵治疗基本一致。术后残余分流能否成功封堵治疗的关键在于轨道建立及输送鞘管的推送。ASD术后分流因操作路径相对简单,轨道建立与鞘管输送难度不大,但是封堵器的选择往往比常规ASD选择难度增大。值得一提的是,本研究中有1例ASD修补术后残余分流为10 mm,且靠近下腔静脉,通过3D打印的心脏模型进行各种封堵器的试验性模拟封堵,发现ASD封堵器置入后形态异常且遮挡右下肺静脉开口,而置入PDA封堵器却与缺损周边结构贴壁良好,位置稳定,因此,选用18/20号PDA封堵器成功进行封堵。外科修补术后VSD的介入封堵治疗往往难度较大,由于术后残余分流形状各异,给顺利建立轨道及鞘管输送带来一定困难。本研究18例室间隔残余分流患者中2例未能成功介入封堵治疗,1例因缺损细长,并与主动脉成角,无法顺利建立轨道;另1例缺损直径过于细小,无血流动力学意义而未行封堵。室间隔残余分流多是补片与缺损边缘的部分撕脱所致,为有利于锚定封堵器,提高完全封堵率,相较于常规VSD封堵,往往需选择更合适的封堵器;因此要备有多种型号、多个厂家所生产的不同形态的封堵器以便于术者选择;此外,残余分流形状多不规则,建立轨道、推送长鞘及封堵器的释放过程中应操作轻柔,以避免补片进一步撕脱[9]。ADO-Ⅱ封堵器材质柔软,操作灵活,可顺向或逆向释放,因其双层双盘、中间腰部的特殊网织结构,可通过4 F输送鞘管,对于形状细长、角度异常的残余分流,具有一定优势。本研究16例成功封堵患者中4例应用ADO-Ⅱ封堵器,效果良好。
综上所述,CHD外科修补或封堵术后房、室间隔残余分流患者采用经导管介入封堵治疗安全、有效,避免了再次开胸的痛苦与风险,治疗效果满意,是一种可行的治疗方法。
