长链非编码RNA XIST通过miR-186调控宫颈癌细胞侵袭迁移及凋亡的分子机制①
2020-09-30杨根岭
徐 倩 杨根岭 张 波 万 斌 张 瑜
(重庆医药高等专科学校药学院,重庆 401331)
宫颈癌是常见的女性恶性肿瘤,目前主要活疗手段为手术治疗及放、化疗,由于手术治疗的局限性及放、化疗的毒副作用,基因治疗成为研究热点[1]。宫颈癌的发生与基因调控相关,基因参与肿瘤细胞侵袭迁移等过程,因此,研究宫颈癌发病机制、寻找有效靶基因备受关注[2]。XIST是机体中有广泛生物学作用的lncRNA,是哺乳动物X染色体失活的调控因子,参与基因组功能发挥、细胞分化等过程[3]。XIST异常表达可能与肿瘤发生相关,高表达XIST的肺癌、前列腺癌等肿瘤细胞恶性程度较高,敲低XIST可抑制肿瘤细胞侵袭并诱导凋亡[4,5]。宫颈癌细胞中XIST表达水平高于癌旁组织,与肿瘤转移、病理分期等相关[6]。本研究以明确XIST在宫颈癌细胞侵袭迁移和凋亡中的作用为目的,探讨其机制,为靶向基因治疗宫颈癌提供新思路。
1 材料与方法
1.1材料 人宫颈癌CaSki细胞购自通派(上海)生物科技有限公司;Lipofectamine 2000购自美国Invitrogen公司;XIST shRNA和shRNA control购自长沙赢润生物技术有限公司;miR-186 inhibitor、inhibitor control购自广州市锐博生物科技有限公司;miR-186 mimics、mimics control购自上海吉玛制药技术有限公司;引物由生工生物工程(上海)股份有限公司合成;Cleaved Caspase-3抗体、MMP-2抗体购自美国Cell Signaling Technology公司;MMP-9抗体购自美国Bio Vision公司。
1.2方法
1.2.1细胞转染 CaSki细胞接种于6孔板,细胞融合度为60%时用转染试剂Lipofectamine 2000将XIST shRNA和shRNA control转染至细胞中。将转染XIST shRNA和shRNA control后的细胞记为sh-XIST和sh-NC,未转染细胞为Control。
1.2.2qRT-PCR检测XIST shRNA对宫颈癌细胞中XIST表达的影响 Control、sh-NC、sh-XIST组细胞转染后继续培养48 h,分别提取总RNA,All-in-oneTMFrist-Strand cDNA Synthesis Kit合成cDNA,步骤同试剂盒说明书。引物序列为:XIST F:5′-CAGACGTGTGCTCTTC-3′R:5′-CGATCTGTAAGTCCA-CCA-3′, GAPDH F:5′-AACGTGTCAGTGGTGGACC-TG-3′,R:5′-AGTGGGTGTCGCTGTTGAAGT-3′。合成的cDNA用SYBR Green荧光定量PCR试剂盒扩增,2-ΔΔCt法计算XIST表达变化。
1.2.3流式细胞术检测XIST shRNA对宫颈癌细胞凋亡的影响 各组细胞转染后继续培养48 h,胰蛋白酶消化,PBS洗涤2次,以1×Binding Buffer细胞,调整细胞浓度为1×107个/ml。收集1 ml细胞,1 000 r/min离心10 min,弃上清,加入Binding Buffer 500 μl,Annexin V-FITC和PI染液孵育15 min。流式细胞仪检测细胞凋亡变化。
1.2.4Transwell小室实验检测XIST shRNA对宫颈癌细胞侵袭和迁移的影响 Transwell小室上室添加不含血清的细胞培养液悬浮的细胞200 μl,下室添加含有10%胎牛血清的细胞培养液500 μl,置于培养箱中孵育48 h,将培养板取出,PBS洗涤,添加4%多聚甲醛溶液在室温中孵育30 min,结晶紫染色,显微镜下观察细胞穿膜数量即为细胞迁移数目。侵袭实验前2 h添加Matrigel湿化小室,其余步骤同迁移实验。
1.2.5Western blot检测XIST shRNA对宫颈癌细胞Cleaved Caspase-3、MMP-2和MMP-9蛋白表达的影响 各组细胞转染后继续培养48 h,添加RIPA裂解液及蛋白酶、磷酸酶抑制剂,置于冰上裂解30 min,低温高速离心10 min。取上清,BCA法定量检测蛋白。分别配制分离胶(10%)和浓缩胶(5%),每孔添加30 μg蛋白样品,90 V恒压电泳,肉眼可见溴酚蓝进入到凝胶底部后停止电泳,4℃、70 V电压下转移至NC膜,转膜时间为60 min。NC膜于5%脱脂奶粉中室温封闭2 h,置于一抗反应液(Cleaved Caspase-3、MMP-2和MMP-9以1∶400稀释)中4℃过夜,加入1∶2 000稀释的二抗,加入室温孵育2 h,ECL法化学发光。记录目的条带Cleaved Caspase-3、MMP-2、MMP-9及内参条带GAPDH灰度值,分析目的蛋白表达水平。
1.2.6靶基因预测和鉴定 Starbase软件预测XIST与miR-186互补结合位点,将XIST互补结合位点突变,构建突变型荧光素酶报告载体(XIST-MUT)及野生型荧光素酶报告载体(XIST-WT),Lipofectamine 2000分别将XIST-MUT、XIST-WT和miR-186 mimics、mimics control共转染至CaSki细胞,培养48 h,荧光素酶活性测定试剂盒检测荧光素酶活性。
1.2.7qRT-PCR检测XIST shRNA对宫颈癌细胞miR-186表达的影响 各组细胞转染后继续培养48 h,按照1.2.2各组测定细胞miR-186表达变化,评估XIST对miR-186的调控作用,内参为U6,引物为:U6 F:5′-CTCGCTTCGGCAGCACA-3′,R:5′-AACG-CTTCACGAATTTGCGT-3′,miR-186 F:5′-CGACGCGT-CGGTTTACAGAACAGGGATCA-3′,R:5′-CCATCGATGGGGCACAGCAACAAAAGACT-3′。
1.2.8miR-186 inhibitor对XIST shRNA影响宫颈癌细胞侵袭迁移和凋亡的影响 Lipofectamine 2000分别将inhibitor control、XIST shRNA和miR-186 inhibitor、XIST shRNA共转染至CaSki细胞,记为sh-XIST+Anti-NC和sh-XIST+Anti-miR-186,培养 48 h,qRT-PCR检测细胞miR-186表达变化,流式细胞术检测细胞凋亡,Transwell小室检测细胞侵袭和迁移,Western blot检测细胞Cleaved Caspase-3、MMP-2和MMP-9蛋白表达水平。
2 结果
2.1XIST shRNA抑制宫颈癌细胞XIST表达 宫颈癌细胞中转染XIST shRNA后,XIST表达水平明显降低(P<0.01),说明XIST shRNA可抑制宫颈癌细胞XIST表达,见表1。
表1 XIST shRNA转染后宫颈癌细胞中 XIST表达变化
2.2下调XIST对宫颈癌细胞侵袭迁移和凋亡的影响 转染XIST shRNA后宫颈癌细胞凋亡率升高,细胞侵袭和迁移数目降低,说明下调XIST可抑制宫颈癌细胞侵袭和迁移,诱导细胞凋亡,见图1、表2。
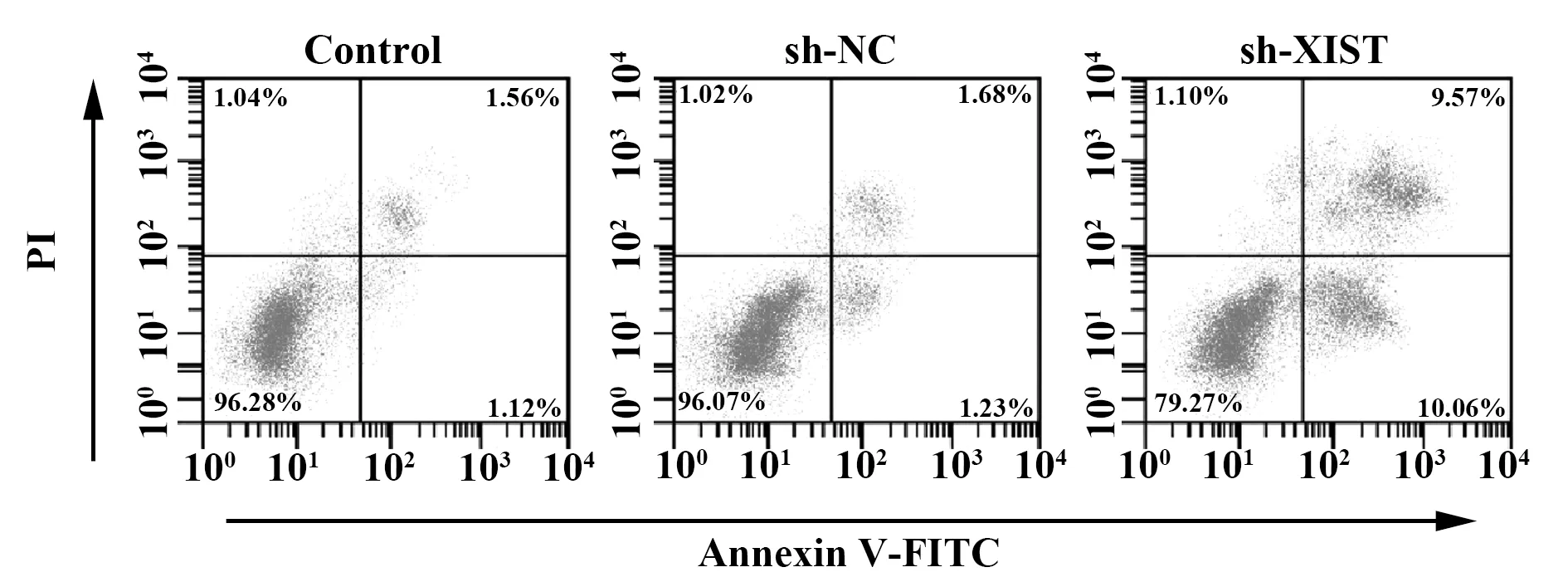
图1 流式细胞术检测XIST shRNA转染后宫颈癌细胞凋亡Fig.1 Detection of apoptosis in cervical camcer cells after transfection with XIST shRNA by folw cytometry
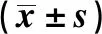
表2 XIST shRNA转染后宫颈癌细胞凋亡率、细胞侵袭和迁移数目
2.3下调XIST对宫颈癌细胞Cleaved Caspase-3、MMP-2和MMP-9蛋白表达的影响 转染XIST shRNA后,宫颈癌细胞MMP-2和MMP-9蛋白表达水平降低,Cleaved Caspase-3蛋白表达水平升高,说明下调XIST可抑制宫颈癌细胞MMP-2和MMP-9蛋白表达并促进Cleaved Caspase-3表达,见图2、表3。
图2 Western blot检测XIST shRNA转染后宫颈癌细胞Cleaved Caspase-3、MMP-2和MMP-9蛋白表达水平Fig.2 Expressions of Cleaved Caspase-3,MMP-2 and MMP-9 in cervical cancer cells after XIST shRNA transfection by Western blot
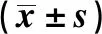
表3 XIST shRNA转染后宫颈癌细胞中Cleaved Caspase-3、MMP-2和MMP-9蛋白水平
2.4XIST靶向调控miR-186 Starbase软件预测到miR-186与XIST存在互补结合位点,XIST-WT与miR-186 mimics共转染下调宫颈癌细胞荧光素酶活性,XIST靶向调控miR-186,见图3、表4。
图3 Starbase软件预测miR-186与XIST互补结合位点Fig.3 Prediction of complementary binding sites between miR-186 and XIST by Starbase software
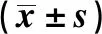
表4 荧光素酶报告载体鉴定靶向关系
2.5XIST shRNA提高宫颈癌细胞miR-186表达 转染XIST shRNA后宫颈癌细胞miR-186表达水平升高,说明下调XIST可促进宫颈癌细胞miR-186表达,见表5。
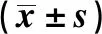
表5 XIST shRNA对宫颈癌细胞miR-186表达的影响
2.6下调miR-186对XIST shRNA抑制宫颈癌细胞侵袭迁移和诱导凋亡的影响 miR-186 inhibitor和XIST shRNA共转染可下调宫颈癌细胞miR-186表达,减少细胞凋亡并促进宫颈癌细胞侵袭和迁移(P<0.05),说明miR-186 inhibitor可逆转XIST shRNA对宫颈癌细胞侵袭迁移和凋亡的影响,见图4、表6。
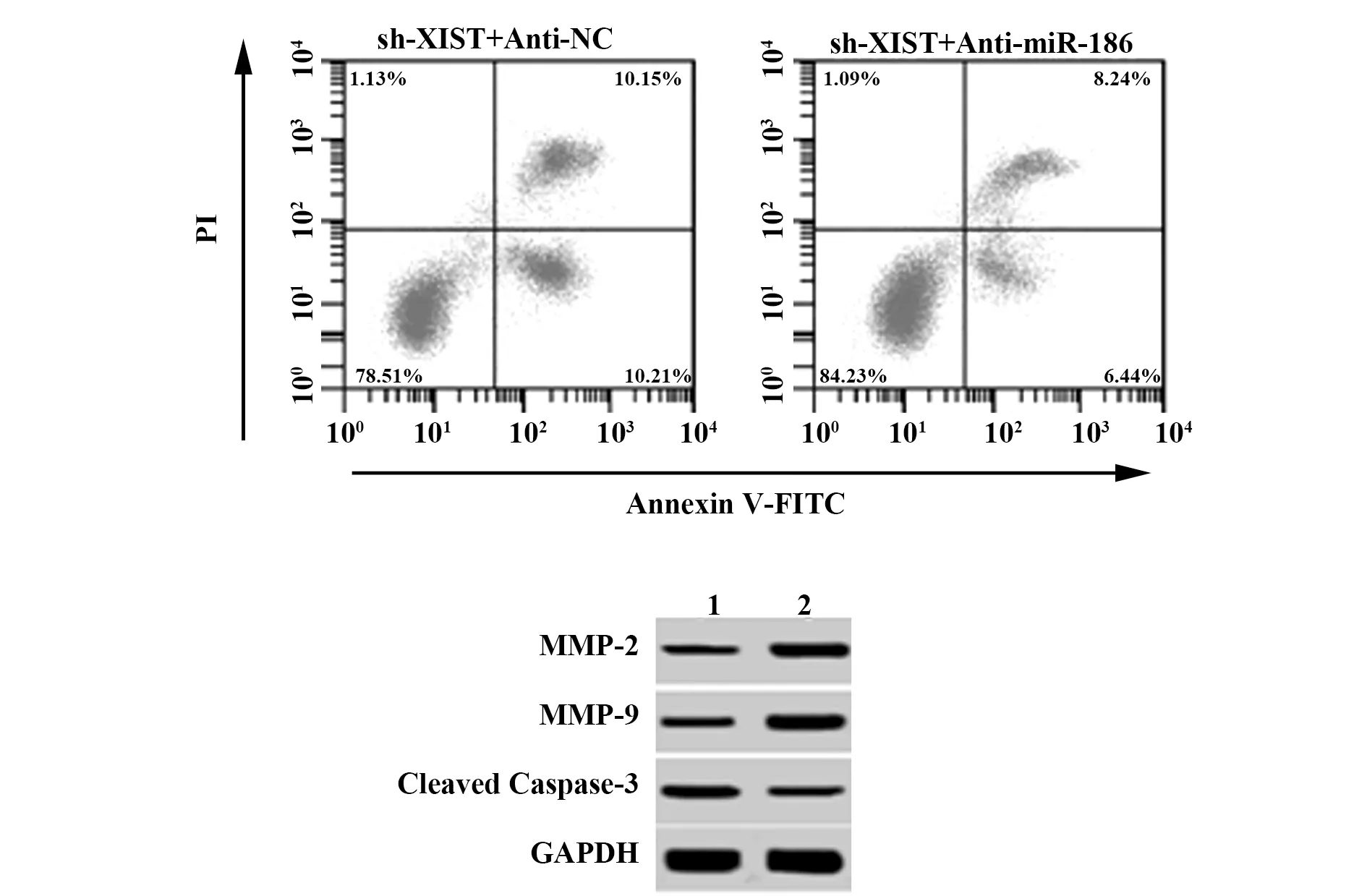
图4 miR-186 inhibitor和XIST shRNA共转染对宫颈癌细胞凋亡和Cleaved Caspase-3、MMP-2、MMP-9蛋白表达影响Fig.4 Effect of co-transfection of miR-186 inhibitor and XIST shRNA on apoptosis and Cleaved Caspase-3,MMP-2,MMP-9 expressions of cervical cancer cellsNote:1.sh-XISF+Anti-NC;2.sh-XIST+Anti-miR-186.
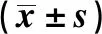
表6 miR-186 inhibitor和XIST shRNA共转染后宫颈癌细胞凋亡、侵袭迁移和Cleaved Caspase-3、MMP-2、MMP-9蛋白表达变化
3 讨论
本研究发现XIST表达降低后宫颈癌细胞凋亡率提高,细胞侵袭和迁移能力下降,说明下调XIST可抑制宫颈癌细胞生长,XIST可能是宫颈癌治疗的潜在靶点。本研究进一步明确了XIST的作用机制,发现miR-186可靶向结合XIST,XIST表达下调可提高细胞miR-186表达,抑制miR-186表达可逆转XIST下调对宫颈癌细胞的抵抗作用,证明下调XIST可靶向提高miR-186诱导宫颈癌细胞凋亡和抑制细胞侵袭迁移。
lncRNA是新近发现的非编码RNA,其表达具有组织、空间或时间特异性,参与干细胞激活、细胞凋亡、细胞分化等生物学过程,与肿瘤的关系备受关注[7-9]。XIST只能从失活的X染色体中转录,与人类基因组维护、细胞凋亡等有关,可通过影响染色质的稳定调控基因表达[10-12]。XIST参与肿瘤进展,在肿瘤组织中异常表达与肿瘤恶性程度相关,在肺癌、胃癌、上皮性卵巢癌等肿瘤中已经发现其可发挥类似癌基因的作用促进肿瘤进展[13-15]。XIST可促进胰腺癌细胞生长,在前列腺癌中发挥癌基因作用,下调XIST可抑制肺癌细胞侵袭和迁移,表明XIST可促进肿瘤恶性进展,与前人研究结果一致,因此,靶向抑制XIST可能是宫颈癌治疗途径之一[5,16,17]。
Cleaved Caspase-3是细胞凋亡的标志因子,Caspase-3是Caspase凋亡反应中的下游执行子,活化后形成Cleaved Caspase-3促进细胞凋亡[18]。MMP-2和MMP-9均属于基质金属蛋白酶家族,可降解细胞外基质,促进肿瘤转移[19]。miR-186在肿瘤中低表达,可抑制宫颈癌细胞侵袭和迁移,抑制宫颈癌恶性进展[20]。本研究证实XIST下调可抑制宫颈癌细胞MMP-9和MMP-2蛋白表达,并促进Cleaved Caspase-3蛋白表达,此作用机制与靶向负调控miR-186表达相关,下调XIST可通过促进宫颈癌细胞miR-186表达减少细胞合成MMP-9、MMP-2,并促进Cleaved Caspase-3表达,这可能是下调XIST抑制宫颈癌细胞侵袭迁移和诱导凋亡的机制,miR-186如何调控MMP-9、MMP-2、Cleaved Caspase-3蛋白表达的具体机制尚不明确,需要进一步探讨。
综上,XIST可能是宫颈癌治疗的潜在靶点,下调XIST靶向miR-186作用可抑制宫颈癌细胞侵袭迁移并诱导凋亡,为研究XIST在肿瘤中的调控网络提供参考。