强直性脊柱炎患者外周血CD4+CD25highCD127low、CD8+CD28-调节性T细胞水平变化及临床意义①
2020-09-30吴青青
张 宇 马 莉 吴青青 沈 雪
(贵州医科大学医学检验学院,贵阳 550004)
强直性脊柱炎(ankylosing spondylitis,AS)是以骶髂关节和脊柱附着点炎症及椎间盘纤维环及附近结缔组织纤维化、骨化和关节强直为主要特征的慢性炎症性自身免疫性疾病,在我国的患病率约为0.2%~0.3%,以青年男性为主,病程较长,致残率较高[1-3]。目前AS病因及发病机制尚未完全明确,研究认为其发生发展与T细胞异常激活、细胞免疫调节功能紊乱、淋巴细胞亚群比例失衡或功能异常相关[4-6]。
调节性T细胞(regulatory T cells,Treg)是一类具有免疫负调控功能的CD4+T细胞亚群,可通过分泌抑制性细胞因子(IL-10,TGF-β)或抑制细胞间接触等途径抑制效应T细胞(Th)增殖、活化和炎症细胞因子分泌,维持自身免疫耐受并发挥抗炎作用[7,8]。多种自身免疫性疾病已证实不同表型的调节性T细胞存在数量和功能上的失衡,但不同表型Treg在AS患者体内是否均存在异常及其与病情活动度、炎症动指标的关系尚未阐明。因此,本研究通过流式细胞术(FCM)及流式细胞微球芯片捕获术(CBA)检测不同活动期AS患者外周血CD4+CD25highCD127lowTreg、CD8+CD28-Treg、IL-2、IL-6、TNF-α、IFN-γ、IL-17A水平,分析Treg与疾病活动度、炎症活动指标的关系,并探讨其在AS发生发展中的临床意义。
1 资料与方法
1.1资料
1.1.1研究对象 选取2017年9月~2019年3月于我院骨科、风湿免疫科门诊首次确诊的AS患者77例,其中男性67例,女性10例,年龄14~48岁,平均年龄(28.61±8.26)岁,病程1个月~32年,平均病程(5.62±5.80)年,HLA-B27均为阳性,诊断标准符合美国风湿病协会(ACR)1984年修订的AS诊断标准,且未接受过抗风湿药物及生物制剂等治疗[9]。根据Bath AS疾病活动指数评分(BASDAI)将AS患者分为AS非活动组47例(inactive AS group,BASDAI<4,男性42例、女性5例)和AS活动组30例(active AS group,BASDAI≥4,男性25例、女性5例)。另选择同期在我院体检中心体检的健康志愿者59例作为健康对照组(healthy control group,HC组),男性43例,女性16例,年龄19~42岁,平均年龄(27.40±5.01)岁,心、肝、肾功能正常,排除标准同实验组。本研究经贵州医科大学附属医院伦理学委员会审核批准(批件号:2019030K),所有研究对象均知情同意。所有志愿者入组后指导填写病例调查表和Bath AS BASDAI评分表,检测疾病炎性活动指标红细胞沉降率(ESR)和超敏C反应蛋白(Hs-CRP)水平。
1.1.2排除标准 ①合并风湿病、其他自身免疫性疾病及炎症疾病者;②合并血液系统及肝肾疾病者;③近3个月内接受糖皮质激素、羟氯喹或其他免疫抑制剂治疗者;④妊娠期或哺乳期女性;⑤病程少于1个月者。
1.1.3仪器与试剂 仪器 FACSCantoTMⅡ流式细胞仪(美国BD公司),WXH微型旋涡混合器(上海跃进医疗器械厂),低速离心机(上海手术器械厂);试剂 FITC-鼠抗人CD8、FITC-鼠抗人CD4、PE-鼠抗人CD127、PE-鼠抗人CD28、APC-鼠抗人CD25、PE-CY7-鼠抗人CD3抗体,同型对照抗体FITC-鼠抗人IgG1、PE-鼠抗人IgG1、APC-鼠抗人IgG1,HLA-B27检测试剂盒,磷酸缓冲液(PBS),FACSTM Lysing solution红细胞裂解液均购自美国BD公司,Th1/Th2/Th17细胞因子检测试剂盒(杭州赛基生物有限公司)。
1.2方法
1.2.1标本采集 上午8:00~9:30空腹采集静脉全血2 ml,EDTA-K2抗凝,用于Treg细胞检测;采集外周静脉血5 ml于不添加抗凝剂的干燥管,3 800 r/min 离心15 min,收集血清,-80℃储存,待细胞因子检测。
1.2.2Treg检测 取抗凝静脉全血50 μl于4支流式检测管,编号为1、2、3、4,分别向流式检测管1和同型对照管3加入FITC-鼠抗人CD4、PE-鼠抗人CD127、APC-鼠抗人CD25荧光抗体及对应的同型抗体,流式检测管2和同型对照管4加入FITC-鼠抗人CD8、PE-鼠抗人CD28、PE-CY7-鼠抗人CD3荧光抗体及对应的同型对照抗体,每种抗体量均为5 μl,涡旋混匀,室温避光孵育30 min,加入10×红细胞裂解液2 ml,摇匀后室温避光孵育10 min,待红细胞完全溶解后,加入3 ml PBS充分混匀,1 500 r/min离心5 min,弃上清,重复1次,加入500 μl PBS重悬细胞,上机检测。利用前向散射角(FSC)和侧向散射角(SSC)设置门圈取淋巴细胞,再分别利用SSC和CD4、SSC和CD8设门圈取CD4+淋巴细胞、CD8+淋巴细胞,检测CD4+淋巴细胞上CD25与CD127和CD8+淋巴细胞上CD28表达,计算CD4+CD25highCD127lowTreg占CD4+T淋巴细胞、CD8+CD28-Treg占总淋巴细胞的比例。Diva和Flowjo软件分析数据,各样本细胞数至少为1×105个/次。
1.2.3细胞因子测定 ①孵育捕获微球:取捕获微球混合液于试管中并标记,旋涡振荡10~15 s,1 000 r/min 离心5 min,弃上清,加入与所弃上清等量的微球缓冲液重悬微球,旋涡振荡3~5 s,避光孵育30 min;②配制标准品:根据试剂说明书将最高浓度标准品5 000 pg/ml依次按1∶2,1∶4,1∶8,1∶16,1∶32,1∶64,1∶128,1∶256,1∶512稀释;③配置样本管:取25 μl患者血清加入检测管,每管分别加入25 μl 孵育好的捕获微球,振荡混匀;④向标记为1∶2,1∶4,1∶8至1:512的标准管中加入25 μl对应浓度的标准品,再加入25 μl捕获微球;⑤向上述标准管和样本管中分别加入25 μl PE荧光标记的捕获抗体,振荡混匀,室温避光孵育2.5 h;⑥每管加入1 ml PBS溶液洗涤,200 g离心5 min,弃上清;⑦每管加入100 μl PBS溶液,振荡重悬后行流式细胞检测,FCAP Array软件分析计算结果。
1.2.4炎症活动指标检测 魏氏法检测ESR,散射比浊法检测Hs-CRP。
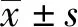
2 结果
2.1临床特征比较 AS活动组、非活动组和健康对照组年龄和性别差异均无统计学意义(P>0.05),AS活动组病程明显长于AS非活动组(P<0.05),AS活动组中ESR、Hs-CRP水平均高于AS非活动组(P<0.01)。见表1。
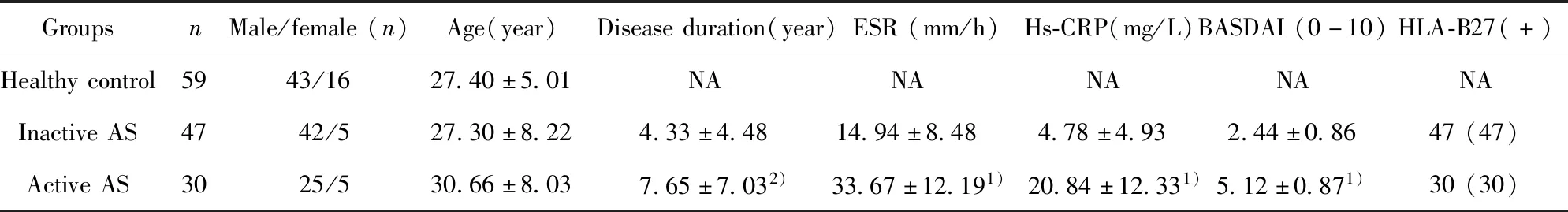
表1 临床资料
2.2各组志愿者外周血CD4+CD25highCD127lowTreg、CD8+CD28-Treg、CD8+CD28+Tc细胞比例及CD8+CD28+/CD8+CD28-AS活动组CD4+CD25highCD127lowTreg比例低于AS非活动组和健康对照组(P<0.05);但AS非活动组和健康对照组差异无统计学意义(P>0.05)。与健康对照组相比,AS活动组和非活动组CD8+CD28-Treg比例均显著降低(P<0.05),但AS活动组与AS非活动组差异无统计学意义(P>0.05)。AS活动组CD8+CD28+Tc细胞比例和CD8+CD28+/CD8+CD28-明显高于AS非活动组和正常对照组(P<0.05),且AS非活动组CD8+CD28+/CD8+CD28-明显高于健康对照组(P<0.05),3组CD8+CD28+Tc细胞比例差异无统计学意义(P>0.05)。见图1、表2。
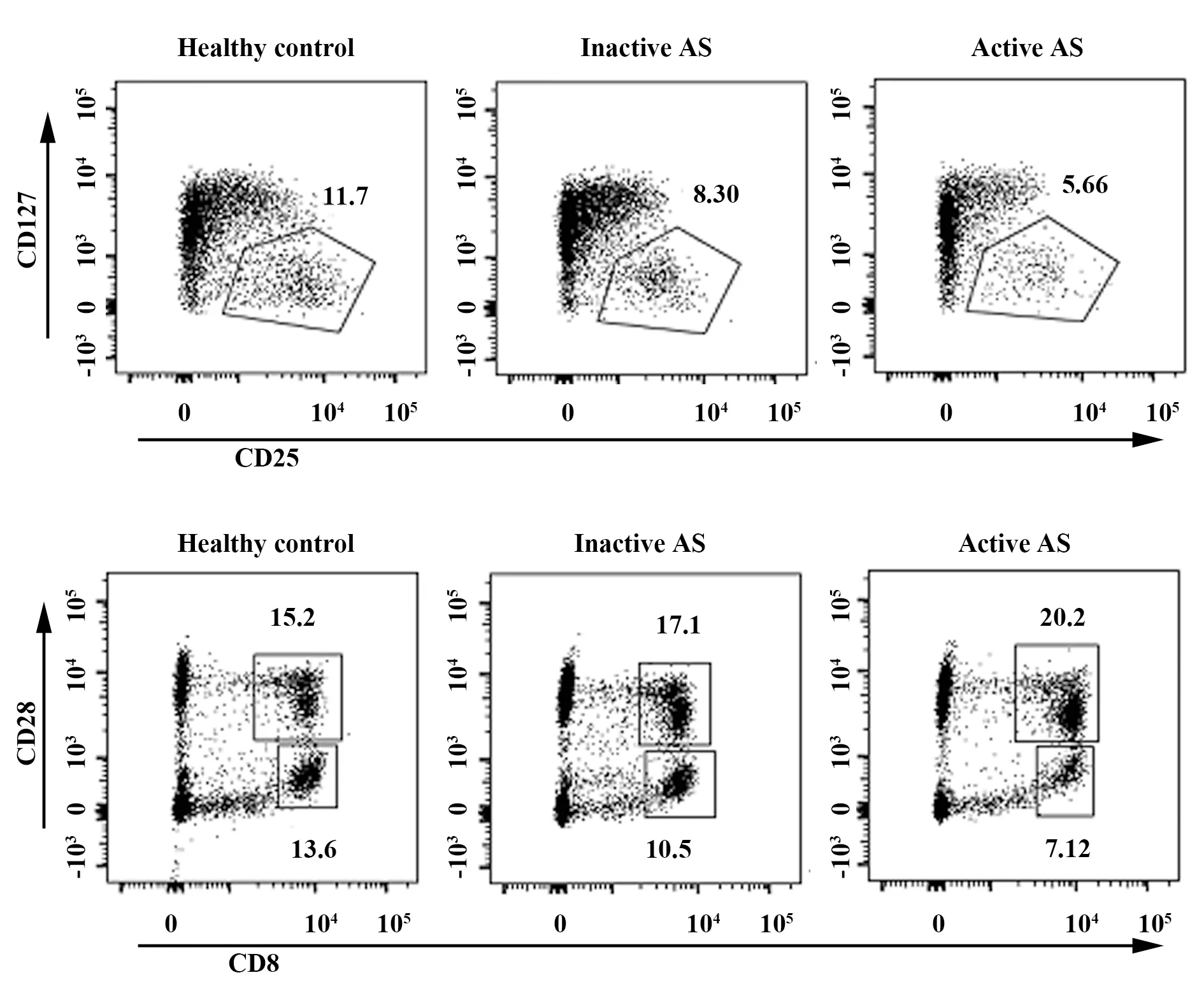
图1 各组CD4+CD25highCD127lowTreg、CD8+CD28-Treg及CD8+CD28+Tc细胞流式图Fig.1 Diagram of CD4+CD25highCD127lowTreg,CD8+CD28-Treg,CD8+CD28+Tc cells of each group by flow cytometry

表2 各组志愿者外周血CD4+CD25highCD127lowTreg、CD8+CD28-Treg、CD8+CD28+Tc细胞比例和
2.3各组志愿者血清IL-2、IL-6、TNF-α、IFN-γ、IL-17A水平 与健康对照组相比,AS活动组和非活动组患者血清IL-6、TNF-α、IL-17A水平均显著升高,且AS活动组患者血清IL-6、IL-17A水平均高于AS非活动组(P<0.05)。AS活动组患者血清IFN-γ水平明显高于AS非活动组和健康对照组(P<0.05);但AS非活动组和健康对照组差异无统计学意义(P>0.05)。3组志愿者血清IL-2水平差异均无统计学意义(P>0.05)。见表3。
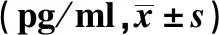
表3 各组IL-2、IL-6、TNF-α、IFN-γ、IL-17A水平
2.4AS患者CD4+CD25highCD127lowTreg、CD8+CD28-Treg、CD8+CD28+Tc细胞比例和CD8+CD28+/CD8+CD28-与BASDAI、ESR、Hs-CRP水平的相关性分析 AS患者CD4+CD25highCD127lowTreg细胞比例与BASDAI、ESR和Hs-CRP呈显著负相关(r=-0.654、-0.517、-0.577,P<0.01),CD8+CD28-Treg细胞比例与BASDAI、ESR、Hs-CRP水平无相关性(P>0.05)。CD8+CD28+Tc细胞比例和CD8+CD28+/CD8+CD28-与BASDAI呈正相关(r=0.276、0.246,P<0.05)。见表4。
表4 CD4+CD25highCD127lowTreg、CD8+CD28-Treg、CD8+CD28+Tc细胞和CD8+CD28+/CD8+CD28-与BASDAI、ESR、Hs-CRP的相关性分析
3 讨论
AS是常见于青年男性的慢性、炎症性自身免疫性疾病,以中轴脊柱、骶髂关节受累为主,伴有外周关节症状,严重者可发生脊柱畸形和关节强直[10]。目前AS的病因及发病机制尚未明确,但机体免疫功能异常在AS发病中的作用已得到认可,尤其是T细胞的免疫功能异常。
Treg是一类控制体内自身免疫反应的T细胞亚群,按其来源可分为天然产生的自然调节性T细胞(nTreg)和诱导产生的适应性调节性T细胞(iTreg),通过细胞间直接接触或分泌抑制性细胞因子(IL-10、TGF-β)等途径抑制Th细胞及抗原提呈细胞功能,减少炎症细胞因子及抗体分泌,发挥免疫效应[7]。根据免疫表型不同,Treg可分为CD4+CD25+、CD4+CD25highCD127low、CD4+CD25highFoxp3+、CD8+CD28-和NKT细胞。不同表型Treg细胞与多种疾病发生发展相关,表达差异较大,韦巍等[11]发现与健康对照者相比,Graves病患者外周血CD4+CD25+Treg表达明显降低,CD8+CD28-Treg表达水平明显升高。另有相关报道发现多发性硬化症患者外周血CD4+CD25+Foxp3+Treg水平显著低于正常对照组,而CD8+CD28-Treg水平与健康对照组差异无统计学意义[12]。目前对AS患者中不同表型Treg的研究鲜有报道。
本研究中发现AS活动期患者外周血CD4+CD25highCD127lowTreg细胞水平较正常对照组明显降低,且AS活动期患者外周血CD4+CD25highCD127lowTreg细胞水平明显低于AS非活动期患者,随着病情加重,CD4+CD25highCD127lowTreg比例逐渐降低。相关性分析显示,CD4+CD25highCD127low与BASDAI、ESR、Hs-CRP均呈负相关,与既往研究结果一致[13,14]。提示CD4+CD125highCD127lowTreg细胞水平可能是反映AS患者病情活动性和病情严重度的有效指标之一。
CD28分子是一种由链间二硫键相连,以同源二聚体形式存在于T细胞表面的Ⅰ型糖蛋白,与抗原提呈细胞(APCs)表面B7家族分子(CD80、CD86)构成一对重要的共刺激分子,为T细胞活化必需的第二信号[15,16]。根据细胞膜是否表达CD28分子,可将CD8+T细胞分为CD8+CD28+杀伤性T细胞(Tc细胞)和CD8+CD28-Treg细胞。CD8+CD28+Tc细胞可特异性识别抗原,执行免疫杀伤作用。CD8+CD28-Treg细胞可通过上调APCs表面的抑制性受体(ILT3、ILT4)和下调共刺激分子(CD80、CD86)表达,阻止效应性T细胞活化,发挥其免疫抑制功能[17]。本研究发现,与健康对照组相比,AS活动期和非活动期患者外周血CD8+CD28-Treg细胞水平降低,而AS活动组和非活动组间差异无统计学意义,与Tulunay等[18]在系统性红斑狼疮(SLE)中得出的结论相同。此外,本研究还发现AS活动期患者CD8+CD28+Tc和CD8+CD28+/CD8+CD28-水平均高于AS非活动期患者和正常对照人群,且AS非活动组CD8+CD28+/CD8+CD28-高于正常对照组。相关性分析显示,CD8+CD28-Tc细胞与BASDAI、ESR、Hs-CRP无明显相关,而CD8+CD28+Tc和CD8+CD28+/CD8+CD28-与BASDAI呈正相关。以上结果提示AS患者中CD8+CD28-Treg细胞比例降低,其对CD8+CD28+Tc细胞抑制作用减弱,使CD8+CD28+Tc细胞增殖、活化,二者的免疫平衡功能紊乱可能在该疾病发病过程中起重要作用。
初始CD4+T细胞在不同细胞因子作用下可分化为不同功能的Th细胞,包括Th1、Th2和Th17,Th1细胞主要分泌IL-2、IFN-γ、TNF-α等细胞因子,介导细胞免疫反应和炎症反应;Th2细胞主要分泌IL-6等,促进B细胞活化,介导体液免疫反应;Th17细胞分泌IL-17等炎症因子,在炎症疾病中发挥重要作用[19]。与健康对照组相比,AS活动组和非活动组患者血清炎症因子IL-6、TNF-α、IL-17A表达水平显著升高,且AS活动组IL-6、IL-17A、IFN-γ高于AS非活动组,推测Treg细胞数量减少导致其免疫抑制作用减弱,促Th细胞功能增强导致自身反应性T、B淋巴细胞过度增殖,产生大量炎症因子和自身抗体,机体维持免疫稳定失调,引发自身免疫反应。本研究针对AS患者中两群不同表型Treg检测结果不完全一致,同时,发现一些细胞因子在AS活动组、非活动组与健康对照组之间无显著性差异,可能与本研究样本量较小有关,有待增加病例数后进一步研究;此外,CD4+CD25highCD127low及CD8+CD28-Treg细胞在维持免疫耐受中的作用机制可能不同,导致其作用部位及效应差异。
综上所述,与健康人群相比,AS患者外周血CD4+CD25highCD127lowTreg、CD8+CD28-Treg细胞比例均显著降低,CD8+CD28+Tc细胞比例和IL-6、TNF-α、IFN-γ、IL-17A水平显著升高。CD4+CD25highCD127lowTreg细胞比例与BASDAI、ESR和Hs-CRP水平呈负相关,表明AS患者体内Treg细胞数量减少,炎症细胞因子水平提高,在AS发生发展中发挥重要作用,但具体作用机制有待进一步研究。