miR-125b-5p靶向STAT3调控血管内皮细胞凋亡①
2020-09-30李松涛岳玉林王均乐
李松涛 岳玉林 王均乐 郁 飞 谈 诚 曹 波
(南京医科大学附属儿童医院检验科,南京 210008)
血管内皮是人体内分泌器官,维持机体稳态,血管内皮细胞具有物质转运、凝血、免疫调节、活性物质释放等作用[1]。氧化应激诱导的血管内皮细胞过度凋亡是糖尿病血管并发症和动脉粥样硬化等多种疾病的重要原因[2]。miRNA在机体生理病理过程中扮演重要角色,维持细胞正常生理功能,与疾病进展相关[3]。miR-125b-5p在机体内广泛表达,参与肿瘤、神经损伤等疾病发生,调控细胞生长和凋亡[4,5]。研究显示,miR-125b-5p可引发心血管系统疾病,在冠状动脉狭窄患者中表达水平低于无狭窄的心脏病患者,且表达水平越低患者冠状动脉病变支数越多[6]。miR-125b-5p在过氧化氢诱导的血管内皮细胞损伤模型中表达下调,但其对血管内皮细胞凋亡的影响尚不明确[7]。STAT3是机体中广泛存在的信号转导通路,参与细胞凋亡,促进过氧化氢诱导的血管内皮细胞凋亡[8]。本研究阐明miR-125b-5p在过氧化氢诱导的血管内皮细胞凋亡中的作用和靶向调控机制,为血管内皮损伤相关疾病的靶向基因治疗提供参考。
1 材料与方法
1.1材料 人脐静脉血管内皮细胞购自中科院细胞库;PCNA抗体和C-caspase-3抗体购自武汉艾美捷科技有限公司;pCDNA3.1-STAT3、pCDNA3.1、miR-125b-5p mimics、mimics control由上海吉玛制药技术有限公司构建;STAT3抗体购自上海酶联生物研究所;荧光素酶报告载体由基尔顿生物科技(上海)有限公司构建;p-STAT3抗体购自美国圣克鲁斯公司;Lipofectamine 2000购自美国Invitrogen公司。
1.2方法
1.2.1qPCR测定过氧化氢处理后血管内皮细胞miR-125b-5p水平 血管内皮细胞用0、100 μmol/L过氧化氢细胞培养液(含10%胎牛血清的ECM)培养(每组3个复孔),分别记为Control、H2O2组。培养12 h后,qPCR检测miR-125b-5p表达。Trizol试剂提取细胞总RNA,采用特异性颈环引物及TaqMan MicroRNA Reverse Transcription Kit反转录合成cDNA,SYBR Premix EX Taq进行定量PCR检测,以U6为内参,PCR反应条件为:95℃ 20 s;95℃ 10 s;60℃ 20 s,循环40次。U6引物F:5′-CTCGCTTCGGCAGCACA-3′,R:5′-AACGCTTCACGAATTTG-CGT-3′。miR-125b-5p引物F:5′-ACACTCCAGCTGGGTCCCTGAGACCCTAACT-3′,R:5′-CTCAACTGGTGTGGTGGA-3′。
1.2.2细胞转染和上调效果检测 血管内皮细胞中转染miR-125b-5p mimics和mimics control(转染试剂为Lipofectamine 2000),100 μmol/L过氧化氢细胞培养液培养,分别记为H2O2+miR-125b-5p、H2O2+miR-NC组。H2O2组处理方法同1.2.1。收集培养12 h后的各组细胞,根据1.2.1测定miR-125b-5p水平。
1.2.3MTT检测细胞活力 血管内皮细胞接种于96孔板(每组3个复孔),培养12 h后,将细胞培养板取出,加入MTT溶液各10 μl,培养4 h,弃上清,加DMSO溶液150 μl,振荡5 min,酶标仪检测各孔OD值。
1.2.4流式细胞术检测细胞凋亡 按1.2.1和1.2.2分组处理细胞(每组3个复孔),培养12 h后,加入胰蛋白酶消化液收集细胞,PBS洗涤2次,悬浮于300 μl Binding Buffer溶液,加入Annexin V-FITC及PI染色液各5 μl,加入200 μl Binding Buffer混匀流式细胞仪检测。
1.2.5Western blot检测细胞PCNA和C-caspase-3蛋白表达 按照1×106个/ml加入蛋白提取试剂提取细胞总蛋白,BCA法定量。蛋白中加入等体积的2×Loading Buffer混合,100℃沸水浴孵育5 min。分离胶浓度为12%,浓缩胶浓度为5%。上样孔加入5 μl预染marker或30 μg蛋白样品,在浓缩胶中以90 V电压电泳,在分离胶中以120 V电压电泳。NC膜上垫3张滤纸,凝胶平铺于NC膜,再添加3张滤纸,玻璃棒将气泡赶尽后,250 mA转膜1 h。将NC膜放于封闭液中,4℃孵育过夜。NC膜放于一抗反应液中,室温结合2 h,放于二抗孵育液中,室温结合2 h。ECL试剂显色,扫描条带灰度值,分析PCNA和C-caspase-3蛋白水平,β-actin中间为内参。PCNA和C-caspase-3一抗分别以1∶800和1∶600稀释,二抗以1∶4 000稀释。
1.2.6miR-125b-5p靶基因预测和鉴定 Target-scan在线靶基因预测软件预测miR-125b-5p的靶基因,发现STAT3的3′UTR端与miR-125b-5p存在互补结合位点,构建STAT3 3′UTR突变的MUT荧光素酶报告载体及含有STAT3 3′UTR WT荧光素酶报告载体,将MUT和WT分别与miR-125b-5p mimics和mimics control共转染至血管内皮细胞,培养24 h后,荧光素酶活性测定试剂盒检测细胞荧光素酶活性变化。收集培养12 h后的H2O2+miR-NC、H2O2+miR-125b-5p组细胞,按照1.2.5检测细胞STAT3、p-STAT3蛋白水平。
1.2.7STAT3过表达载体对上调miR-125b-5p的血管内皮细胞活力和凋亡的影响 血管内皮细胞分别共转染阴性对照过表达载体(pCDNA3.1)、miR-125b-5p mimics及STAT3过表达载体(pCDNA3.1-STAT3)、miR-125b-5p mimics,100 μmol/L过氧化氢细胞培养液培养,记为H2O2+miR-125b-5p+Vector、H2O2+miR-125b-5p+STAT3(每组3个复孔),按照1.2.3、1.2.4及1.2.5检测细胞活力、凋亡和PCNA、C-caspase-3、STAT3、p-STAT3蛋白水平。
2 结果
2.1过氧化氢诱导血管内皮细胞miR-125b-5p表达下调 血管内皮细胞经过氧化氢处理后,细胞miR-125b-5p表达水平降低(P<0.05),见图1。
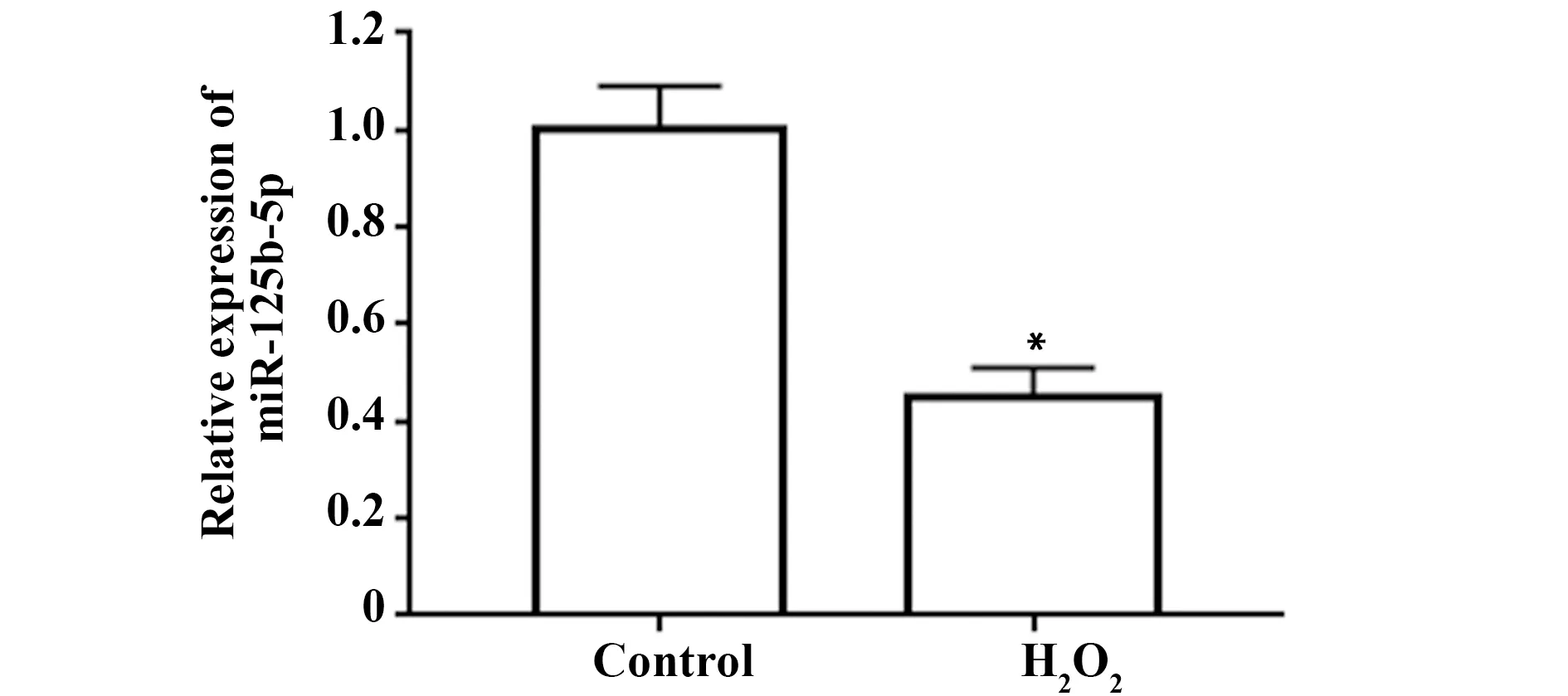
图1 过氧化氢条件下血管内皮细胞miR-125b-5p表达Fig.1 Expression of miR-125b-5p in vascular endothelial cells under hydrogen peroxideNote:Compared with Control,*.P<0.05.
2.2miR-125b-5p mimics提高过氧化氢条件下血管内皮细胞miR-125b-5p表达 转染miR-125b-5p mimics后血管内皮细胞经过氧化氢处理后,细胞miR-125b-5p表达水平升高,见图2。
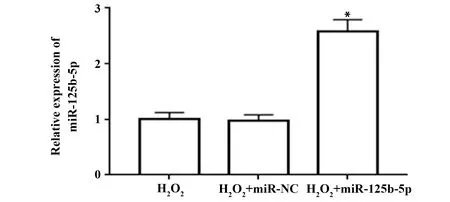
图2 miR-125b-5p mimics转染后对过氧化氢条件下血管内皮细胞miR-125b-5p表达的影响Fig.2 Effects of miR-125b-5p mimics transfection on expression of miR-125b-5p in vascular endothelial cells under hydrogen peroxideNote:Compared with H2O2+miR-NC,*.P<0.05.
2.3上调miR-125b-5p对过氧化氢条件下血管内皮细胞活力和凋亡的影响 过氧化氢处理后血管内皮细胞OD值降低,细胞凋亡率升高,PCNA蛋白水平降低,C-caspase-3蛋白水平升高;而miR-125b-5p mimics可提高过氧化氢条件下血管内皮细胞OD值,降低细胞凋亡率,提高PCNA蛋白表达水平,降低C-caspase-3蛋白水平,见图3。说明上调miR-125b-5p表达可提高过氧化氢条件下血管内皮细胞活力并减少细胞凋亡。
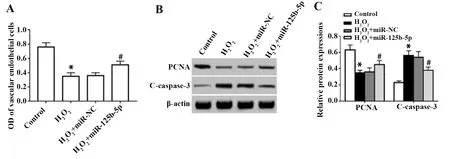
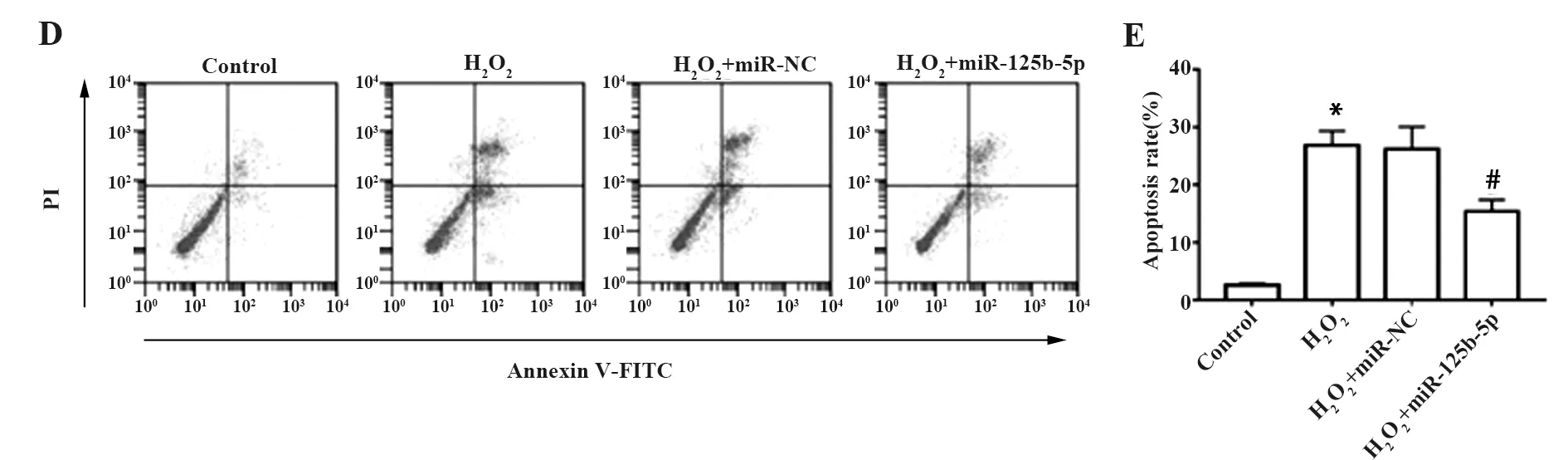
图3 上调miR-125b-5p对过氧化氢条件下血管内皮细胞活力和凋亡的影响Fig.3 Effect of miR-125b-5p up-gregulating on prolifera-tion and apoptosis of vascular endothelial cells under hydrogen peroxide conditionsNote:Compared with Control,*.P<0.05;compared with H2O2+miR-NC,#.P<0.05.
2.4miR-125b-5p靶向调控STAT3 靶基因预测软件发现miR-125b-5p与STAT3的3′UTR端存在互补结合位点,荧光素酶报告系统鉴定发现STAT3为miR-125b-5p的靶基因,见图4。
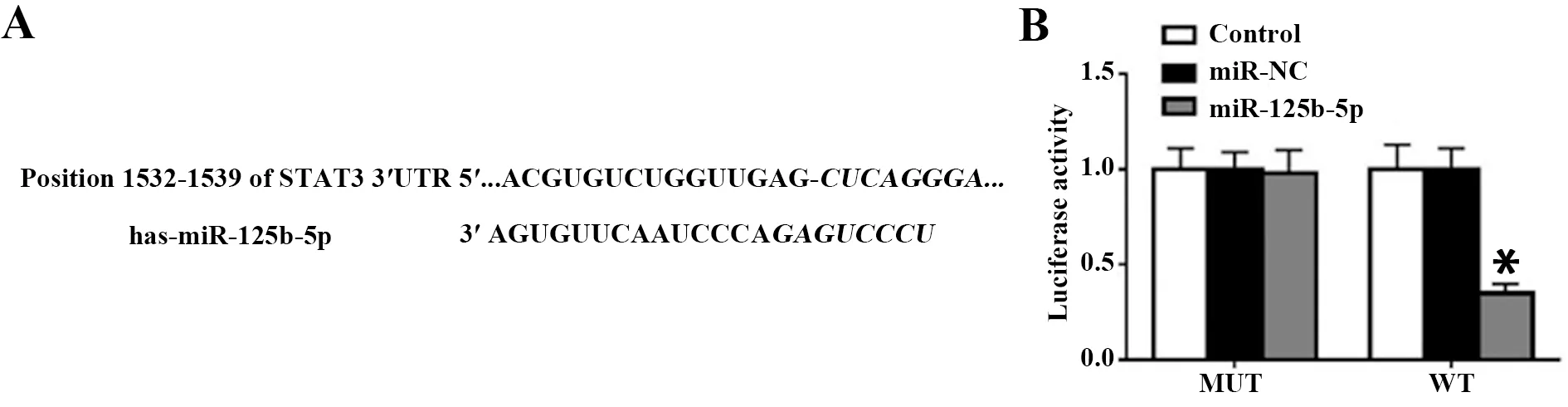
图4 miR-125b-5p靶基因预测和鉴定Fig.4 miR-125b-5p up-regulating targeting gene prediction and identificationNote:Compared with miR-NC,*.P<0.05.
2.5上调miR-125b-5p可降低过氧化氢条件下血管内皮细胞STAT3蛋白表达水平 上调miR-125b-5p的血管内皮细胞经过氧化氢处理后,细胞STAT3、p-STAT3蛋白水平下降,见图5。
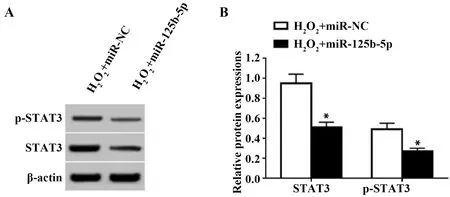
图5 上调miR-125b-5p对过氧化氢条件下血管内皮细胞STAT3、p-STAT3蛋白表达的影响Fig.5 Effect of miR-125b-5p up-regulation on STAT3 and p-STAT3 protein expressions in vascular endothelial cells under hydrogen peroxide conditionsNote:Compared with H2O2+miR-NC,*.P<0.05.
2.6STAT3过表达载体和miR-125b-5p mimics共转染对过氧化氢条件下血管内皮细胞活力、凋亡和p-STAT3、STAT3、PCNA、C-caspase-3蛋白表达的影响 与共转染阴性对照过表达载体和miR-125b-5p mimics的细胞相比,共转染STAT3过表达载体和miR-125b-5p mimics的血管内皮细胞经过氧化氢处理后,细胞OD值降低,凋亡率升高,p-STAT3、STAT3、C-caspase-3蛋白水平升高,PCNA蛋白水平降低,见图6。说明STAT3过表达载体可逆转过表达miR-125b-5p对过氧化氢条件下血管内皮细胞的活力和凋亡作用。
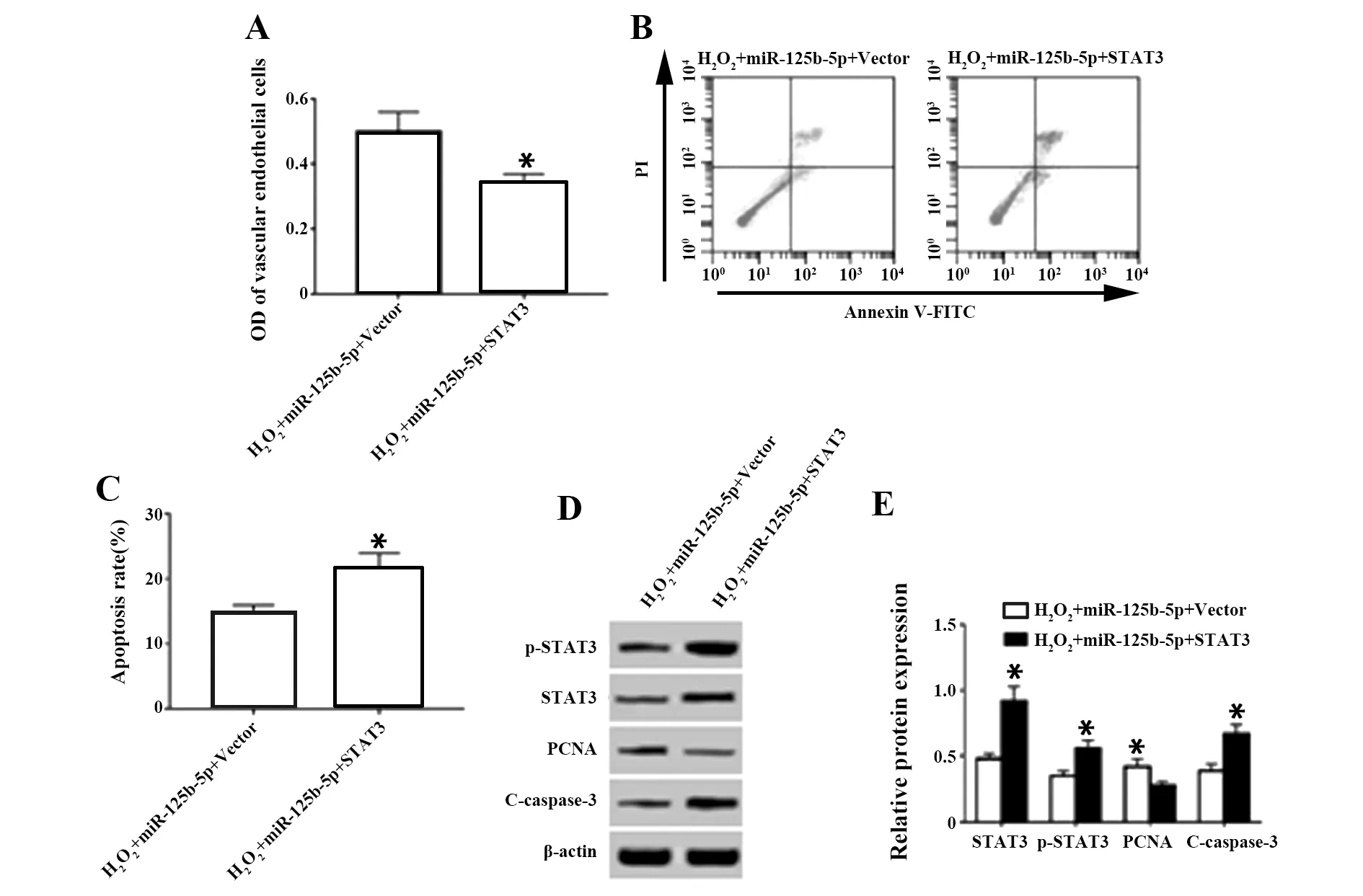
图6 STAT3过表达载体和miR-125b-5p mimics共转染对过氧化氢条件下血管内皮细胞活力、凋亡和p-STAT3、STAT3、PCNA、C-caspase-3蛋白表达的影响Fig.6 Effect of STAT3 overexpression vector and miR-125b-5p mimics co-transfection on proliferation,apoptosis and expressions of p-STAT3,STAT3,PCNA and C-caspase-3 proteins in vascular endothelial cells under hydrogen peroxide conditions Note:Compared with H2O2+miR-125b-5p+Vector,*.P<0.05.
3 讨论
氧化应激可诱导血管内皮细胞凋亡,导致血管内皮组织受损,影响血管内皮功能,过氧化氢是构建血管内皮细胞损伤模型的诱导因子[9]。本研究显示,过氧化氢处理后的血管内皮细胞活力降低,凋亡率升高,说明过氧化氢可诱导血管内皮细胞损伤,提示造模成功。
miRNA参与多种疾病发生发展,在心血管疾病中发挥重要作用[10]。miR-125b-5p与心血管系统疾病有关,心脏病动脉狭窄病变支数越多,miR-125b-5p表达水平越低,其在氧化应激条件下的血管内皮细胞中表达下调[6,7]。本研究结果显示,miR-125b-5p在过氧化氢刺激的血管内皮细胞凋亡过程中表达下调,上调miR-125b-5p可减少血管内皮细胞凋亡,提高细胞活力和PCNA蛋白水平,降低C-caspase-3蛋白表达。PCNA是细胞活力标志蛋白,其表达水平高低提示细胞活力[11]。C-caspase-3是Caspase凋亡反应的执行因子,指标细胞凋亡[12]。上调miR-125b-5p表达可抑制过氧化氢诱导的血管内皮细胞凋亡,证实miR-125b-5p在氧化应激条件下抑制血管内皮细胞凋亡,miR-125b-5p可能是血管内皮损伤的保护因子。
STAT3是与细胞生长、分化、凋亡等密切相关的重要信号转导通路,被磷酸化后形成p-STAT3发挥信号传递作用[13]。STAT3诱导血管内皮损伤,抑制STAT3信号通路可改善动脉粥样硬化患者血管内皮细胞凋亡,STAT3信号抑制剂可缓解氧化应激条件下血管内皮细胞损伤[8,14]。本研究发现,miR-125b-5p靶向调控STAT3表达,上调miR-125b-5p可降低血管内皮细胞STAT3表达水平,而上调STAT3表达可逆转miR-125b-5p对氧化应激条件下血管内皮细胞凋亡的影响,提示miR-125b-5p靶向调控STAT3表达抑制血管内皮细胞凋亡。
综上所述,miR-125b-5p保护免疫血管内皮,靶向作用于STAT3抑制过氧化氢诱导的血管细胞凋亡,但调控机制尚不明确,需要进一步探讨。本研究为阐明miR-125b-5p在血管内皮损伤中的作用机制及其靶向基因治疗提供参考。