miR-138靶向OX40L对实验性自身免疫性脑脊髓炎幼鼠的作用机制研究①
2020-09-30赵秀英符之富符彬莎李文华
赵秀英 符之富 符彬莎 李文华
(海南省人民医院,海南医学院附属海南医院,海口 570311)
自身免疫性脑炎是儿童较常见的脑部疾病。这种脑炎由多种免疫介导,主要症状包括精神障碍、行为异常、记忆衰退、癫痫等症状,严重影响儿童健康,通常需要多学科联合治疗[1]。研究显示,T细胞对全身免疫稳态的维持至关重要[2],然而经过十多年的研究,对自身免疫应答过程中T细胞的分子应答机制尚未完全明确。有研究显示,microRNA(miRNA)是生物体内的关键基因,可调节T细胞的增殖和凋亡等生物学行为,这说明miRNA对T细胞介导的免疫稳态至关重要[3,4]。研究显示,miR-138在大脑中富集,可调节多种生物学过程,如小鼠海马神经元中树突棘的形态发生;也有研究表明miR-138在癌症中具有多方面的作用,但miR-138与免疫系统间的互作机制尚不清楚[5-8]。因此,本研究将通过构建实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠模型,获取自身免疫性脑炎中的关键细胞,在细胞水平探究miR-138对T细胞增殖和凋亡的影响及分子机制。
1 材料与方法
1.1材料
1.1.1实验动物 健康SPF级C57BL/6小鼠购于广东省医学实验动物中心,体质量15~18 g,5周龄,雌雄各半。
1.1.2主要试剂 MOG35-55多肽购于上海翱博生物公司;含卡介苗弗氏完全免疫佐剂(FCA)购于上海远慕生物科技有限公司;百日咳结核杆菌毒素PTX购于美国Sigma公司;percoll分离液、FACS缓冲液购于上海颖心实验室设备有限公司;小鼠FC Block抗体、CD45-PE抗体、TLR3抗体、TLR4抗体及FIZZ-1抗体购于北京百奥莱博科技有限公司;Lipofectamine 2000试剂盒购于美国Invitrogen公司;PrimeScript miRNA cDNA试剂盒购于大连宝生物工程有限公司;TRIzol试剂盒、CD4+T细胞阴性分选免疫磁珠试剂盒、BCA试剂盒、ECL试剂盒及定点诱变试剂盒购于北京赛因坦科技有限公司。
1.2方法
1.2.1构建EAE小鼠模型 取40只C57BL/6小鼠,随机挑选15只作为对照组,其余25只用于构建EAE小鼠模型。将人工合成的MOG35-55多肽(200 μg)溶解于200 μl PBS缓冲液,与200 μl含4 mg/ml卡介苗的FCA在真空中完全混匀,30 min后制备完成。同时,将200 μl PBS缓冲液与等量FCA溶液乳化,用于对照组小鼠。将上述制备好的2种混合乳液在第0天分别注射于小鼠双侧背部脊椎旁分4点皮下,在各组小鼠免疫后的第0天和第2天腹腔注射200 ng PTX,至此EAE小鼠模型构建完成。
1.2.2EAE小鼠模型神经功能评分 本研究中EAE小鼠模型的神经功能评分按照6分法进行,具体评分规则如下:0分:无明显疾病症状;0.5分:尾巴部分无力,出现拖尾症状;1.0分:尾巴完全瘫痪,尾巴变软,完全无力;2.0分:双后肢无力;2.5分:后肢部分瘫痪,单后肢完全瘫痪;3.0分:双后肢完全瘫痪,被动翻身后不能自行恢复;3.5分:双后肢完全瘫痪,前置部分瘫痪;4.0分:四肢完全瘫痪;5.0分:濒死状态;6.0分:死亡。
1.2.3分离活化小胶质细胞 取处于发病高峰期的EAE组小鼠及同时期的对照组小鼠各5只,将小鼠窒息处死后在无菌条件下获取各组小鼠的脑组织及脊髓。在室温条件下将脑组织与脊髓置于含0.25%胰酶及1 mmol/L的EDTA混合液中消化,15 min 后用含10%胎牛血清的IMDM培养基终止消化。消化后的细胞800 g离心10 min,收集离心后的细胞沉淀并使用percoll分离液分离,900 g离心 7 min 后再次收集细胞沉淀。收集的细胞沉淀置于400 μl的FACS缓冲液中重悬,加入FC Block冰浴 30 min 后800 g离心5 min,再次以50 μl的FACS重悬,调整细胞密度为1×106个/ml后加入抗CD11b-FITC及抗CD45-PE流式抗体,避光冰浴30 min 后800 g离心5 min弃上清,用FACS缓冲液重悬后使用流式细胞仪分选小胶质细胞。
1.2.4免疫荧光染色 取处于对数生长期的各组细胞,以1.5×105个/孔的密度接种于带有灭菌盖玻片的6孔板中,接种后于37℃、5%CO2的恒温培养箱中孵育24 h。去除盖玻片后按照二步双染色法处理,在荧光显微镜下观察TLR3、TLR4及FIZZ-1的表达。
1.2.5细胞转染 将各组处于对数生长期的细胞接种至含RPMI1640培养基的6孔板中,在37℃、5%CO2的恒温培养箱中孵育72 h,按照Lipofectamine 2000试剂盒说明书将合成的脂质体转染至各组细胞内,12 h后将各组细胞转移至含完全培养基的6孔板中保存以用于后续实验。
1.2.6RT-qPCR实验 使用TRIzol试剂盒提取各组细胞内的总RNA,使用PrimeScript miRNA cDNA试剂盒合成cDNA,使用Step OnePlusTM实时PCR系统进行反应,反应条件为95℃ 5 min,95℃ 20 s,60℃ 30 s,共进行40个循环。U6及GAPDH分别作为miR-138和OX40L mRNA的内参,使用2-ΔΔCt法计算miR-138及OX40L mRNA的相对表达水平。引物序列如下:miR-138(F:5′-GTATTGACTAGATTAATCACTGT-3′;R:5′-TCTCCGCATCACCACAGAA-G-3′),OX40L mRNA(F:5′-CCTACATCTGCCTGC-ACTTCTC-3′;R:5′-TGATGACTGAGTTGTTCTGCA-CC-3′),U6(F:5′-CTCGCTTCGGCAGCACA-3′;R:5′-AACGCTTCACGAATTTGCGT-3′),GAPDH(F:5′-GTCTCCTCTGACTTCAACAGCG-3′;R:5′-ACCACCC-TGTTGCTGTAGCCAA-3′)。
1.2.7CD4+T细胞的分离 取对照组小鼠5只,在无菌条件下取其外周血,按照小鼠CD4+T细胞阴性分选免疫磁珠试剂盒说明书分离CD4+T细胞,FACS检测获取的CD4+T细胞纯度。
1.2.8CD4+T细胞增殖活性检测 取处于对数生长期的CD4+T细胞及活化小胶质细胞,经胰酶消化后制备成细胞悬液,在37℃、5%CO2的恒温培养箱中间接共培养96 h,每间隔24 h使用MTT比色法检测CD4+T细胞的增殖活性。
1.2.9细胞凋亡检测 自CD4+T细胞及活化小胶质细胞间接共培养后,每24 h收集悬浮的T细胞,按照Annexin V-FITC-PI试剂盒说明书检测T细胞的凋亡水平。
1.2.10Western blot 在各组细胞按照1.2.5中的方法转染48 h后,用RIPA裂解缓冲液提取小胶质细胞内总蛋白,用BCA试剂盒检测蛋白浓度。取适量蛋白质在SDS-PAGE凝胶中分离,并转移至PVDF膜。用含5%脱脂奶粉的缓冲液封闭2 h后在蛋白质样品中加入鼠抗人OX40L抗体(1∶1 000)或GAPDH单克隆抗体(1∶2 000)在4℃条件下孵育过夜。加入相应的山羊抗兔二抗(1∶2 000)后在室温下孵育1 h,使用ECL试剂盒显影后拍照分析。
1.2.11双荧光素酶报告基因实验 使用定点诱变试剂盒诱变产生OX40L-MUT,并将其与OX40L-WT克隆至pMIR-REPORT荧光素酶报告载体中。使用Lipofectamine 2000试剂盒将pMIR-OX40L-WT、pMIR-OX40L-MUT、miR-NC及miR-138 mimics共转染至小胶质细胞内,在37℃、5%CO2的条件下将转染后的细胞置于含10%FBS的DMEM培养基中培养48 h,使用双荧光素酶报告基因系统分析相对荧光素酶活性。
1.3统计学处理 采用SPSS21.0软件分析数据,t检验用于分析两组间差异,单因素方差分析用于比较多组间差异,以P<0.05表示差异具有统计学意义。
2 结果
2.1EAE模型的鉴定 将40只小鼠随机分为对照组(15只)和EAE组(25只)。EAE组小鼠自免疫后的5 d后开始发病,大部分表现为尾部无力,后肢无力等症状。在16 d左右进入发病高峰期,小鼠均出现四肢瘫痪甚至大小便失禁等症状。在25 d左右时进入缓解期,在此期间内EAE组小鼠体重逐渐增加,症状有不同程度的缓解。对照组小鼠在此期间内体重增加正常,未出现不良症状。EAE组与对照组小鼠体重及神经功能评分变化如图1,小鼠发病情况见表1。
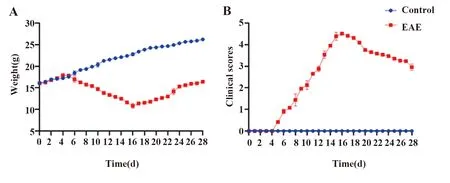
图1 EAE小鼠模型鉴定Fig.1 Identification of EAE mouse modelNote:A.Changes in body weight of mice;B.Changes of neurological function scores in mice.
表1 小鼠发病情况对照表
2.2小胶质细胞的分选与鉴定 经抗体标记处理后的单核细胞利用流式细胞仪分选,结果显示EAE组小鼠中小胶质细胞的活化比例为21%,对照组小鼠小胶质细胞的活化比例为11%,符合预期结果,见图2A。免疫荧光实验结果显示,EAE组活化小胶质细胞TLR3、TLR4及活化小胶质细胞特异性标志物FIZZ-1的表达相较于对照组显著增加,见图2B。
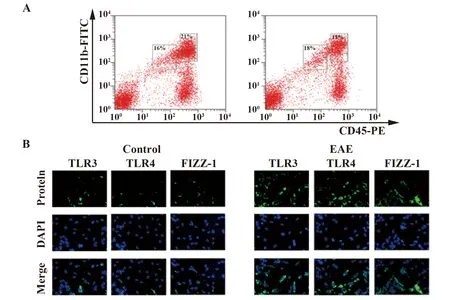
图2 小胶质细胞的分选与鉴定Fig.2 Sorting and identification of microgliaNote:A.Flow cytometry sorting microglial chart;B.TLR3,TLR4 and FIZZ-1 immunofluorescence staining results.
2.3活化小胶质细胞内miR-138的表达水平 RT-qPCR检测结果显示,miR-138在EAE组小鼠模型脑组织中的表达水平显著下调(P<0.05,图3A),同时,在分离的EAE组小鼠活化小胶质细胞内miR-138的表达水平也显著下调(P<0.05,图3B),因此后续实验选择EAE组小鼠活化小胶质细胞(简称活化小胶质细胞)进行。RT-qPCR结果显示,转染miR-138 mimics后活化小胶质细胞内miR-138表达水平较转染miR-NC的细胞显著上升(P<0.05,图3C)。将转染miR-NC或miR-138 mimics的活化小胶质细胞与T细胞共培养,以MTT比色法检测T细胞增殖,结果显示,转染miR-138 mimics的活化小胶质细胞与T细胞共培养会显著抑制T细胞的增殖(P<0.05,图3D)。凋亡结果显示,转染miR-138 mimics的活化小胶质细胞会显著促进T细胞的凋亡(P<0.01,图3E)。

图3 miR-138在活化小胶质细胞内低表达Fig.3 Low expression of miR-138 in activated microgliaNote:A.miR-138 expression in mouse brain tissue;B.miR-138 expression in microglia;C.Transfection efficiency test;D.MTT colorimetric method to detect T cell proliferation;E.Flow cytometry to detect T cell apoptosis.#.P<0.05 vs Control group;*.P<0.05,**.P<0.01 vs miR-NC group.
2.4OX40L是miR-138的下游靶基因 生物信息学数据库预测结果显示,OX40L蛋白是miR-138的下游靶基因,结合位点见图4A。双荧光素酶报告基因实验显示,OX40L-WT组中转染miR-138 mimics的荧光素酶活性显著降低(P<0.01),且OX40L-MUT组中转染miR-138 mimics对荧光素酶活性基本无影响(图4B)。此外,Western blot结果表明,转染miR-138 mimics后会显著抑制活化小胶质细胞OX40L的表达(P<0.01),RT-qPCR检测也显示过表达miR-138会抑制活化小胶质细胞OX40L mRNA的表达(P<0.001,图4C、D)。
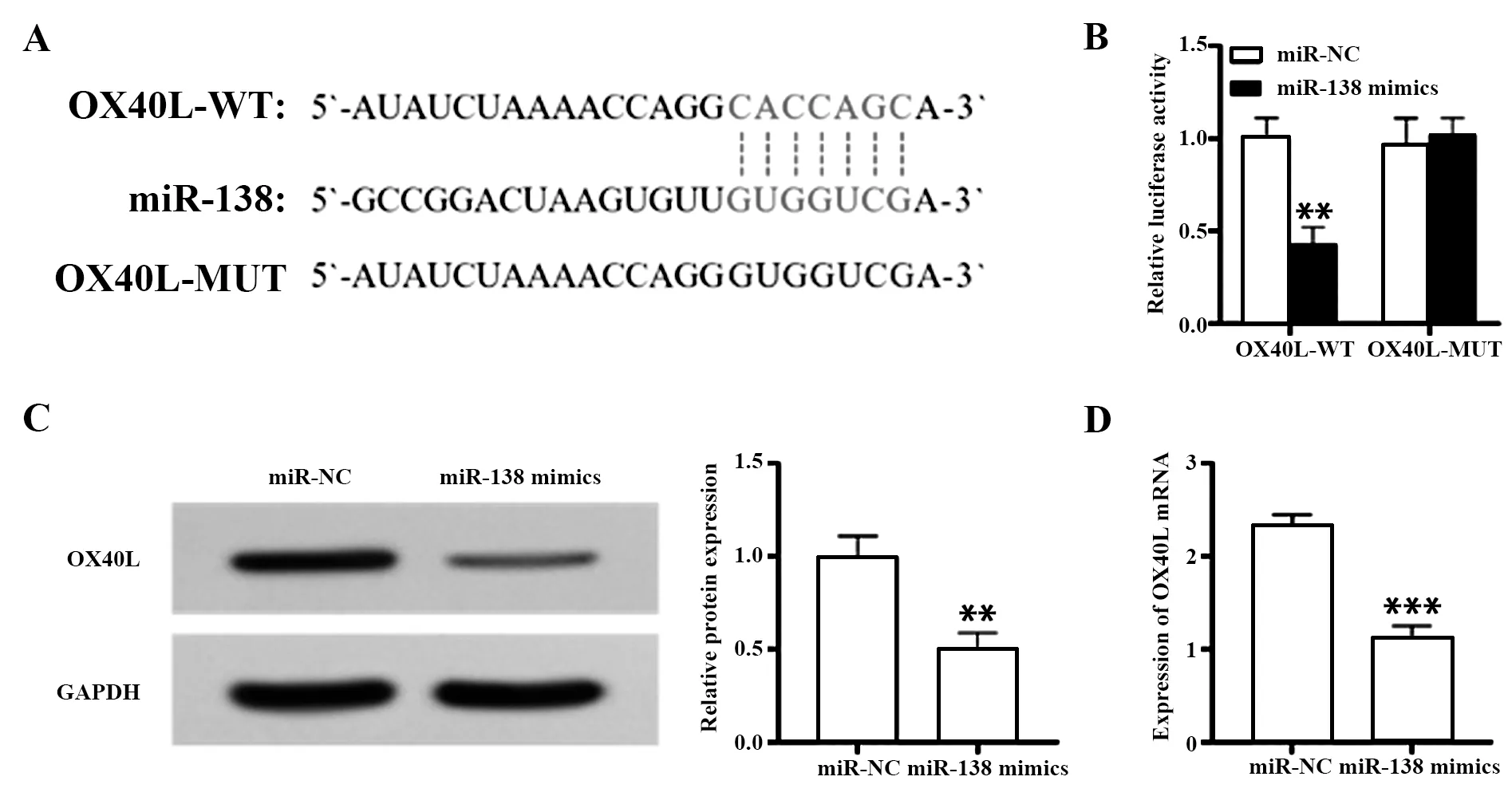
图4 OX40L为miR-138的下游靶基因Fig.4 OX40L is downstream target gene of miR-138Note:A.Binding site of miR-138 and OX40L;B.Dual luciferase reporter gene test;C.Western blot detection of OX40L protein expression;D.RT-qPCR detection of OX40L mRNA protein expression.**.P<0.01,***.P<0.001 vs miR-NC group.
2.5小胶质细胞内miR-138/OX40L分子轴调控T细胞的增殖与凋亡 RT-qPCR结果显示,转染miR-138 mimics会显著上调其在活化小胶质细胞内的表达(P<0.01,图5A)。转染si-OX40L或pc-OX40L会显著下调或上调OX40L mRNA在活化小胶质细胞内的表达(P<0.01),Western blot实验结果与RT-qPCR结果一致,且同时过表达miR-138和OX40L并未对活化小胶质细胞内OX40L的表达量产生显著影响,图5B、C。MTT检测结果显示,敲低活化小胶质细胞内OX40L的表达会显著抑制T细胞的增殖(P<0.05),相反,过表达OX40L会显著促进T细胞的增殖(P<0.05),但同时过表达活化小胶质细胞内miR-138和OX40L并未对T细胞的增殖产生显著影响(P<0.05,图5D)。凋亡结果显示,敲低活化小胶质细胞内OX40L的表达会促进T细胞凋亡(P<0.001),过表达OX40L则会抑制T细胞凋亡(P<0.001),同时过表达活化小胶质细胞内miR-138和OX40L并未对T细胞的凋亡产生影响(图5E)。
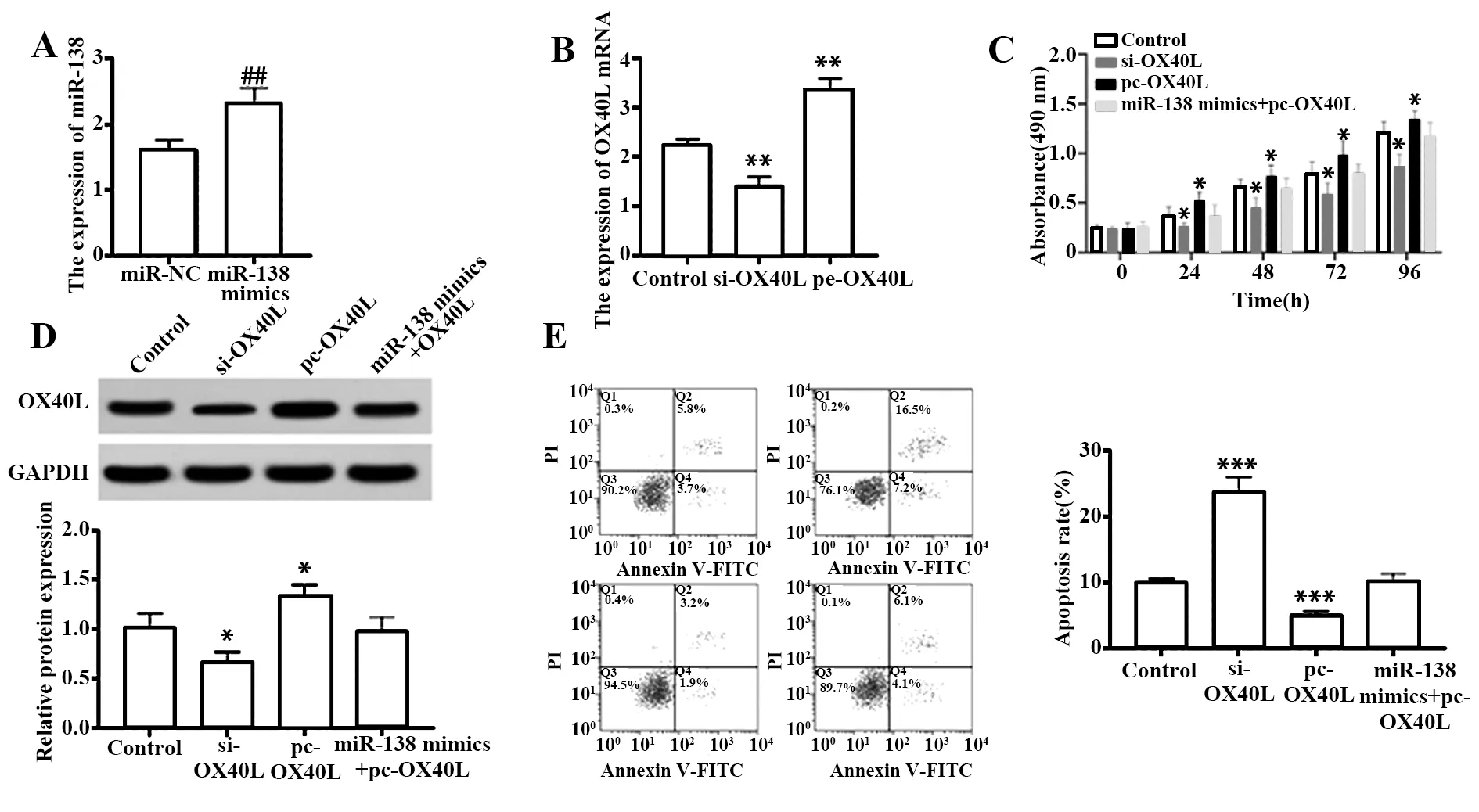
图5 小胶质细胞内miR-138/OX40L分子轴对T细胞的增殖与凋亡的影响Fig.5 Effect of miR-138/OX40L molecular axis in microglia on proliferation and apoptosis of T cellsNote:A,B.Transfection efficiency test;C.MTT colorimetric method to detect T cell proliferation;D.Western blot detection of OX40L protein expression;E.Flow cytometry to detect T cell apoptosis.##.P<0.01 vs miR-NC group;*.P<0.05,**.P<0.01,***.P<0.001 vs Control group.
3 讨论
儿童自身免疫性脑炎系自身免疫性反应导致的中枢神经系统性疾病,是由于神经元蛋白影响神经递质传递及兴奋性的自身免疫性抗体所致。临床中以抗N-甲基-D-天门冬氨酸受体脑炎和自身免疫性边缘叶脑炎最为常见,其中抗N-甲基-D-天门冬氨酸受体脑炎约占所有病例的80%以上[9]。小胶质细胞是中枢神经系统内具有免疫活性的细胞,是中枢神经系统微环境变化检测最敏感的指标之一[10]。在正常中枢神经系统内,小胶质细胞一直处于静止状态,持续监测周围环境变化。当中枢神经系统受到外界刺激后,活化的小胶质细胞会分泌一些重要的免疫因子,在疾病中发挥重要作用。研究显示,小胶质细胞的活化发生在自身免疫性脑炎的发病早期[11],且小鼠的自身免疫性脑炎通过T细胞诱导,结合二者在时间与空间上的联系,笔者推测小胶质细胞与T细胞之间存在一定的互作。
miRNA是一类内源性非编码RNA,可以与mRNA的3′非编码区结合,在转录后影响靶基因的翻译与表达。miR-138是中枢神经系统内重要的调节因子,Ren等[12]研究显示,miR-138通过MLK3/JNK/MAPK信号通路抑制小鼠小胶质细胞的凋亡。本研究发现,miR-138在EAE组小胶质细胞内的水平显著下调,且过表达小胶质细胞内miR-138的表达会显著影响T细胞的增殖活性和凋亡水平,结果表明miR-138在自身免疫性脑炎的过程中发挥重要作用,且证实了笔者的前期推测。免疫共刺激分子OX40及其配体(OX40 ligand,OX40L)与T细胞的凋亡、增殖、细胞因子的表达密切相关[13]。Wang等[14]研究发现,OX40L在小胶质细胞内的表达水平对维持T细胞的增殖及多种因子的分泌提供了分子基础。生物信息学数据库预测结果显示,OX40L与miR-138在3′非翻译区有部分互补结合序列,并通过实验证实OX40L是miR-138的下游靶基因。此外,过表达OX40L在小胶质细胞内的表达会显著促进T细胞的增殖并抑制凋亡,这与Wang等[14]研究结果一致。同时过表达OX40L与miR-138在小胶质细胞内的表达对T细胞的增殖与凋亡并未产生显著影响。
通过上述研究发现,EAE会导致小胶质细胞活化并下调miR-138表达,同时通过miR-138/OX40L分子轴上调OX40L在小胶质细胞内的表达,进而影响T细胞的增殖和凋亡,可能对EAE的治疗产生一定效果。