青岛地区鸡源blaNDM与mcr-1耐药基因的流行性试验
2020-09-29刘志海刘旭东任海燕胡龙飞郝智慧王金泉
王 可,刘志海,赵 莉,刘旭东,,任海燕,胡龙飞,,郝智慧,王金泉
(1.新疆农业大学动物医学学院,新疆 乌鲁木齐 830052;2.中国农业大学动物医学院,北京 海淀 100193;3.青岛农业大学化学与药学院,山东 青岛 266000)
细菌耐药性(AMR)已经成为21世纪人类健康的最大威胁之一[1]。自2009年Yong等[2]首次发现新德里金属β-内酰胺类(NDM-1)以来,该酶能够介导细菌对几乎所有β-内酰胺类药物耐药,包括碳青霉烯类药物。其耐药基因blaNDM已经成为世界范围内最主要的碳青霉烯耐药基因[3]。近年来,多黏菌素一度被认为是对抗碳青霉烯类耐药菌引起的严重感染的最后一道防线[4-5]。携带碳青霉烯耐药基因blaNDM和多黏菌素耐药基因mcr-1超级细菌的出现传播,进一步揭示了细菌耐药对公共卫生安全的威胁。
自2011年中国首次检测到携带blaNDM-1的鲍曼不动杆菌以来,中国多个省份的医院迅速出现blaNDM-1阳性肠科杆菌[6]。携带blaNDM耐药菌株多数源于临床患者,目前在养殖动物与养殖环境中也有报道[7]。同样,自从mcr-1在动物中被发现以后,世界各地超过25个国家从动物、食品、人体中都分离出了mcr-1[8-9]。随着碳青霉烯和多黏菌素耐药肠科杆菌的出现,意味着在大多数多重耐药(MDR)肠杆科细菌引起感染中,几乎无抗生素可用。然而,全世界越来越多的报道显示,人和动物的肠科杆菌中存在blaNDM和mcr-1共存[10-11]。这些菌株的出现无疑是一个危险信号——人类公共卫生安全和养殖业的发展或将面临巨大威胁。目前,我国已经成为动物源细菌耐药性最为严重的国家之一[12]。国内关于养殖动物源肠杆科细菌的研究报道不断,同时大肠杆菌拥有不断积累耐药基因的能力,被认为是耐药基因的天然储存库,因此可能导致耐药基因的散播,并使得人用和兽用药物效果降低。
由于鸡源大肠杆菌同时携mcr-1与blaNDM的相关研究报道不多。本试验调查了山东青岛地区鸡养殖场与鸡屠宰场中大肠杆菌的耐药情况,及黏菌素耐药基因mcr-1与碳青霉烯耐药基因blaNDM的携带情况,以期为鸡养殖业临床用药提供科学依据,同时为耐药菌的产生和传播提供参考。
1 材料与方法
1.1 样品的采集 2018年11月-2019年4月采集山东青岛地区的养殖场鸡泄殖腔拭子105份和屠宰场鸡盲肠90份,共计195份。
1.2 主要试剂Taq酶、Marker,均购自南京诺唯赞生物科技有限公司;阿莫西林(AMX)、多黏菌素E(CL)、四环素(TET)、头孢氨苄(LEX)、替加环素(TGC)、亚胺培南(IMP)、庆大霉素(GEN)、氧氟沙星(OFL)、头孢吡肟(FEP)、头孢噻肟(CTX)等药敏试验药物,均购自武汉威得利化学科技有限公司;LB营养肉汤、伊红美蓝培养基、麦康凯琼脂培养基,均购自北京陆桥生物技术有限责任公司。16S rRNA引物为:上游引物:5′-AGTTTGATCCTGGCTCAG-3′和下游引物:5′-AGGCCCGGGAACGTATTCAC-3′,扩增后目的片段大小1 300 bp。引物合成及一代测序,均由北京六合华大基因科技有限公司负责。
1.3 细菌的分离鉴定 将采集的鸡泄殖腔拭子、鸡盲肠内容物接种于麦康凯琼脂上,37 ℃培养18~24 h。挑选粉红色至红色圆形菌落于LB营养肉汤中富集培养后纯化。对于纯化后的单菌落进行16S rRNA PCR扩增和测序鉴定。
1.4 药敏试验 使用琼脂稀释法确定以下抗生素的最低抑菌浓度(MIC):亚胺培南、阿莫西林、头孢氨苄、头孢噻肟、头孢吡肟、四环素、替加环素、庆大霉素、多黏菌素E 和氧氟沙星。具体操作如下:(1)药物稀释按照美国临床和实验室标准协会(CLSI)制订的指南进行药物原液制备和稀释;(2)挑取培养好的受试菌制备成0.5麦氏单位菌悬液;(3)琼脂稀释法最终接种菌量为104CFU/点进行接种;(4)接种完毕后将培养基放入35 ℃培养箱中培养16~20 h;(5)肉眼观察结果并分析。大肠杆菌ATCC 25922作为质量控制菌株。耐药折点及相关操作均遵循CLSI指南。多重耐药(MDR)分离株被定义为对3种以上抗生素具有耐药性。
1.5 耐药基因检测 对于分离的菌株用水煮法提取细菌DNA。碳青霉烯耐药基因blaNDM、mcr-1到mcr-9耐药基因的检测采用已经报道的引物[11]。碳青霉烯耐药基因包括blaIMP、blaOXA、blaNDM、blaKPC。PCR反应体系为:Taq酶15 μL,上、下游引物各0.5 μL,DNA模板1 μL,水13 μL。反应条件:95 ℃预变性3 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸45 s,30个循环;72 ℃终延伸5 min。用2%的琼脂糖凝胶电泳,并在凝胶成像系统上观察结果并拍照。PCR产物送至北京六合华大基因科技有限公司测序,并利用NCBI进行同源性分析。
2 结果
2.1 细菌分离鉴定 采集的195份样品中,共分离到186株(95.4%)大肠杆菌,其中鸡养殖场98株(93.3%),鸡屠宰场88株(98%)。
2.2 药敏试验 186株鸡源大肠杆菌对四环素、阿莫西林、头孢氨苄耐药率较高,均达到95%以上,分别为98.9%、97.3%、95.2%。其他依次为庆大霉素(88.7%)、头孢噻肟钠(87.1%)、氧氟沙星(86.6%)、多黏菌素E(81.2%)、头孢吡肟(76.9%)、亚胺培南(45.2%)、替加环素(4.8%)(见图1)。除替加环素和亚胺培南外,鸡屠宰场大肠杆菌的耐药率均高于鸡养殖场。鸡屠宰场大肠杆菌对阿莫西林、四环素、头孢氨苄、头孢噻肟4种抗生素的耐药率高达100%;其MIC分别为256 μg/mL、16 μg/mL、256 μg/mL和16 μg/mL。鸡屠宰场大肠杆菌的多重耐药情况比鸡养殖场严重。所有分离株对8种抗生素耐药的大肠杆菌占35.4%(n= 66);对9种抗生素耐药的大肠杆菌占24.7%(n= 46)。主要的耐药谱型为AMX、LEX、CTX、FEP、TET、GEN、CL和OFL。甚至出现5株对10种抗生素全部耐药的情况(图2)。
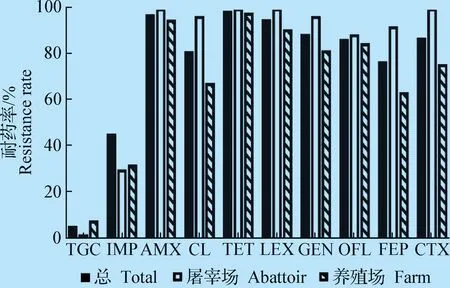
图1 鸡源大肠杆菌对10种抗菌药物的耐药率Fig.1 The resistance rate of chicken E.coli to ten antibacterial drugs
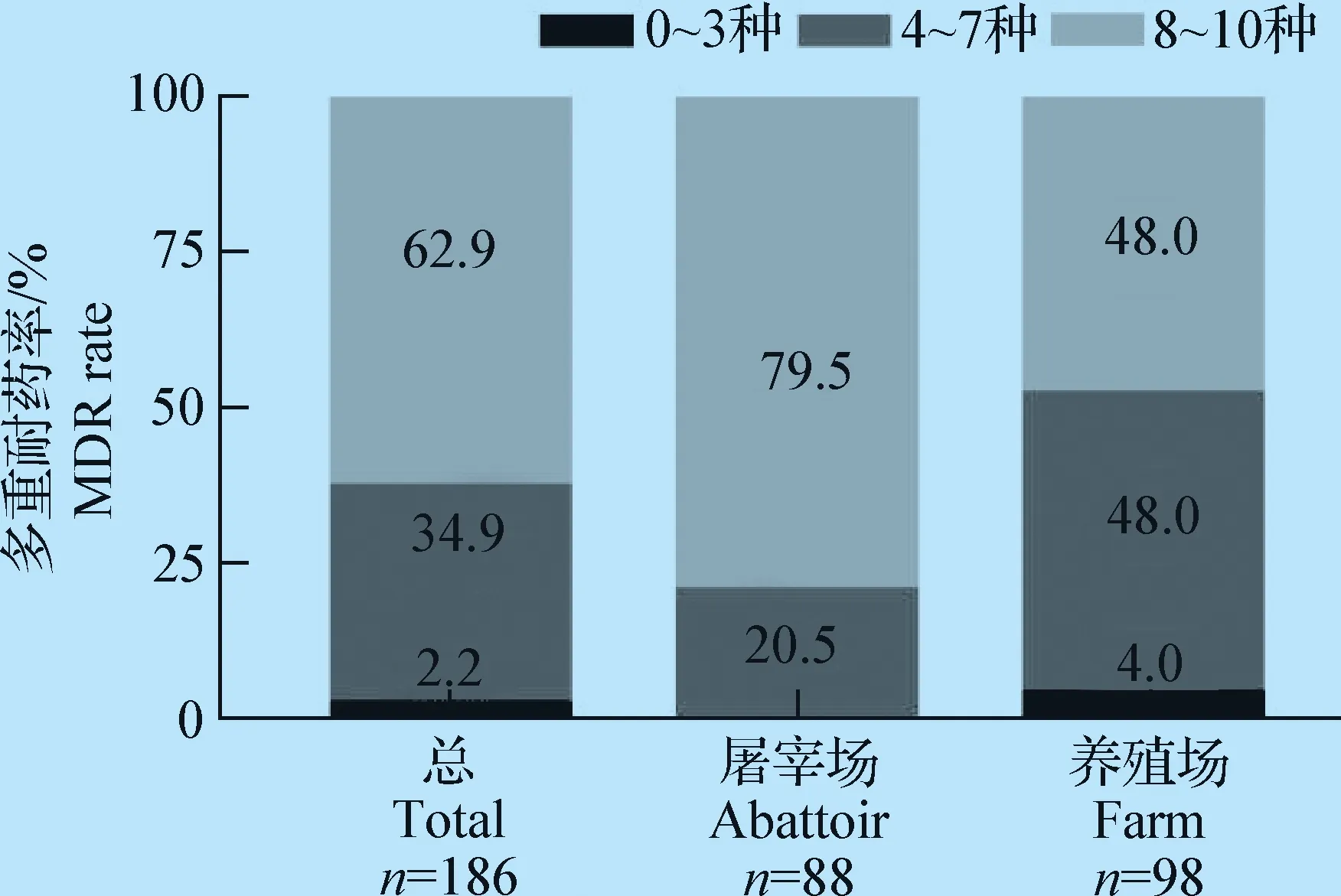
图2 鸡源大肠杆菌的多重耐药率Fig.2 Multidrug resistance rate of chicken E.coli
186株鸡源大肠杆菌的MIC50与MIC90相差较大,主要体现在鸡养殖场大肠杆菌。鸡屠宰场大肠杆菌除对四环素、庆大霉素、氧氟沙星外的MIC50与MIC90相差较大外,对头孢吡肟、头孢噻肟钠、头孢氨苄、阿莫西林的MIC50与MIC90相同,分别为16 μg/mL、16 μg/mL、256 μg/mL、256 μg/mL(见表1)。
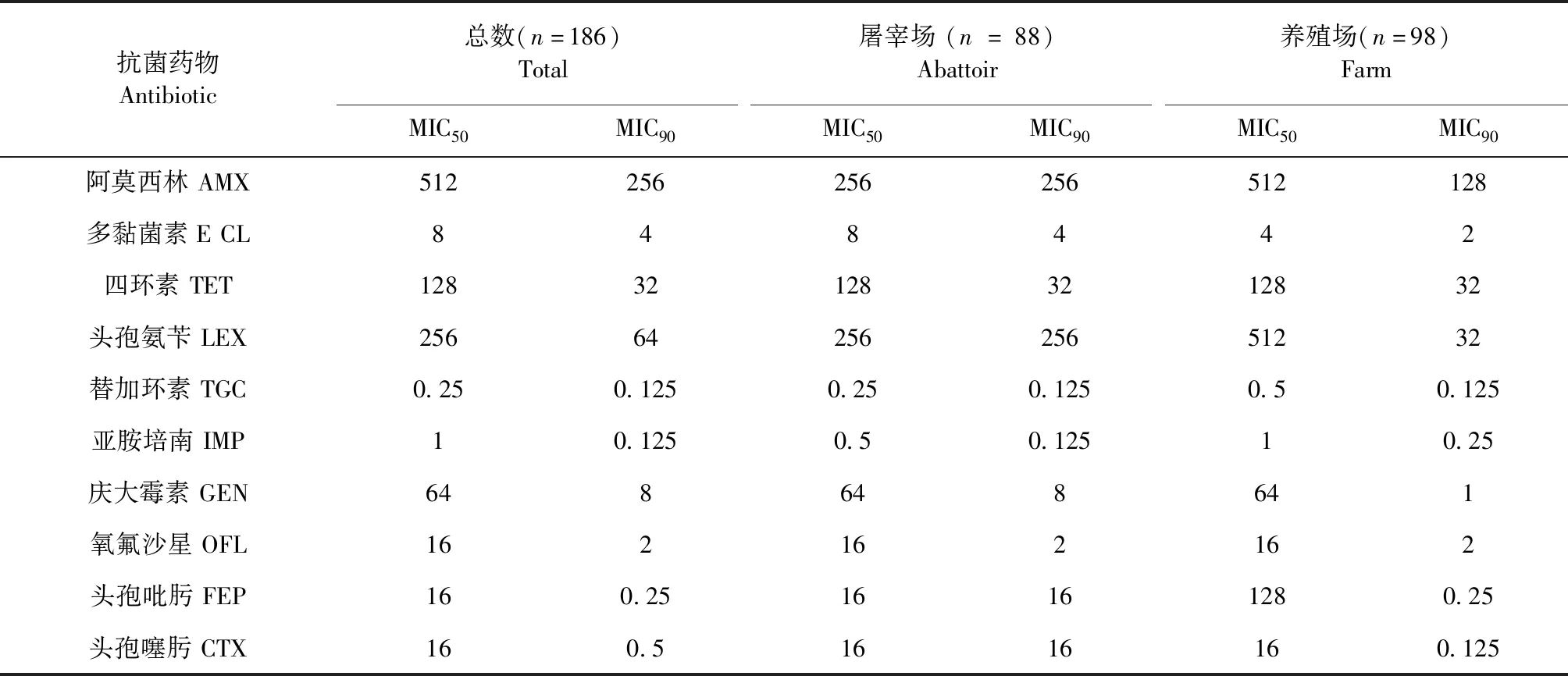
表1 鸡源大肠杆菌的MIC50和MIC90Table 1 MIC50 and MIC90 of E.coli from chicken (μg/mL)
2.3 耐药基因检测 186株大肠杆菌中共检测出42株(22.6%)携带mcr-1基因(见表2),未发现其他mcr亚型,其中鸡养殖场源(18株,18.4%)低于鸡屠宰场源(30株,34.1%);碳青霉烯耐药基因blaNDM的检出率为7.5%(n= 14),blaNDM-5为主要的亚型,其次为blaNDM-1,未发现其他碳青霉烯耐药基因,其中鸡养殖场源和鸡屠宰场源分别为6.1%(n=6)、9.1%(n= 8)。值得注意的是,只有养殖场中发现了6株(3.2%)大肠杆菌同时含有多黏菌素耐药基因mcr-1与碳青霉烯耐药基因blaNDM,分别为5株(blaNDM-5+mcr-1)、1株(blaNDM-9+mcr-1)。
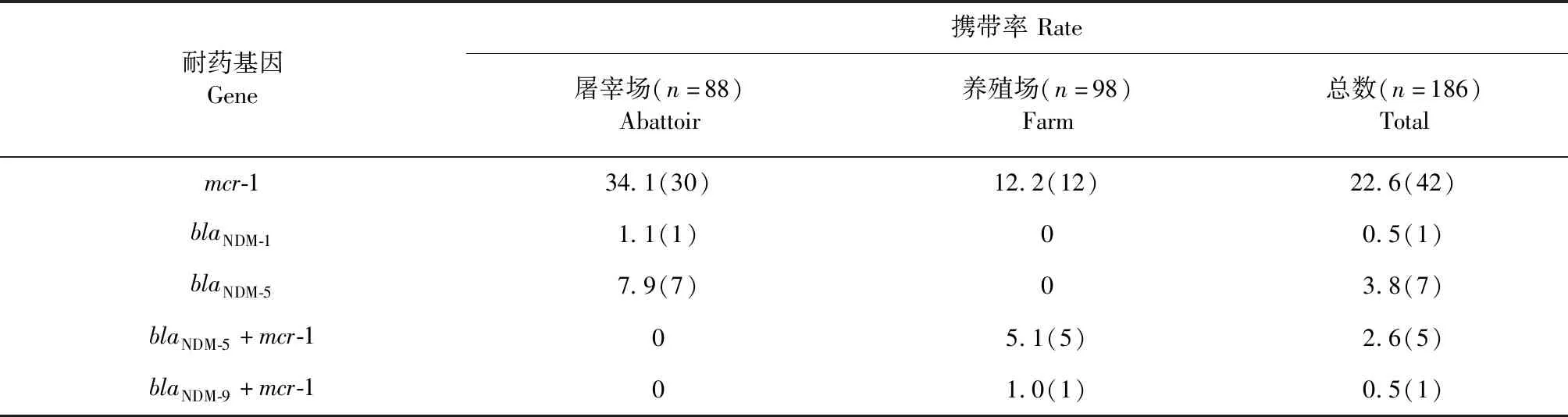
表2 鸡源大肠杆菌的mcr-1与blaNDM检测结果Table 2 Detection results of mcr-1 and blaNDM of chicken E.coli [%(株)]
3 讨论
本试验对山东青岛地区鸡源大肠杆菌进行10种抗生素的药敏试验,结果显示,试验菌株对阿莫西林、头孢氨苄、庆大霉素、多黏菌素E等8种抗生素耐药率均在76.9%以上。邵志勇等[13]报道了武汉鸡源大肠杆菌对青霉素、氨苄西林的耐药率达到100%;对头孢拉定、链霉素、氯霉素、氟苯尼考、四环素的耐药率超过80%。岳秀英等[14]对四川省1 458株鸡源大肠杆菌进行药敏试验,发现其耐药率为:青霉素类(85.01%)、磺胺类(83.40%~89.41%)、四环素类(58.90%~83.01%)、氟喹诺酮类(63.37%~72.03%)、头孢类(46.9%)、氨基糖苷类(33.91%~50.52%)。这与本试验的结果基本一致。表明我国鸡源大肠杆菌耐药十分严重。试验还发现鸡屠宰场大肠杆菌的MIC90要普遍大于鸡养殖场,两者的MIC50相差不大。本试验还发现,除替加环素和亚胺培南外,鸡屠宰场大肠杆菌的耐药率均高于养殖场。说明该地区屠宰场大肠杆菌耐药情况较养殖场严重。
赖婧等[15]对800株大肠杆菌进行检测,发现耐受3种以上药物的菌株占92.6%;王娟等[16]发现多重耐药菌株占分离菌株的96.28%。毛福超等[17]报道了豫西地区禽源大肠杆菌耐药种类最高的菌株对18种抗生素耐药,9~14种耐药菌株有76株(77.55%)。冯敏燕等[18]在2008-2014年对山东省不同地区鸡场的210株大肠杆菌进行14种抗生素的药敏试验,结果显示,其中对10种抗生素的耐受性在7年间增长1倍以上。而本试验中对8种以上抗菌药物多重耐药率高达62.9%,与国内的一些报道相一致,表明我国禽源大肠杆菌耐药十分严重,且山东青岛地区存在多重耐药的现象。
大肠杆菌作为人和动物重要肠道菌,被认为是可移动耐药元件的储存库[19]。耐药基因blaNDM能使目前人类临床的重要的抗菌药物碳青霉烯类抗生素(如亚胺培南等)失效。同样,mcr-1则能导致多黏菌素无作用,其中mcr-1的多见于禽源。Shen Z等[20]从全国8个省份内收集了1 611株鸡源大肠杆菌,发现在20世纪80年代已经存在多黏菌素耐药的现象,且从2009-2014年耐药率持续上升,到2014年已经达30%;朱家杭等[21]对山东地区鸡源大肠杆菌碳青霉烯耐药基因检测发现blaNDM的检出率为31%,且blaNDM-5为主要的亚型。这与我们的结果相一致,提示blaNDM-5可能为山东青岛地区主要的流行亚型。
mcr-1和blaNDM共出现和传播引起了广泛的关注。我们在养殖场中还发现了6株同时携带mcr-1与blaNDM的大肠杆菌,mcr-1+blaNDM-5型与mcr-1+blaNDM-9型分别为5株、1株,且对几乎所有测试抗菌药物都耐药。国内也有学者在1只鸡体内分离得到mcr-1与blaNDM-9的大肠杆菌和板琦肠杆菌[22],这与我们的结果相一致。Du H等[23]在医院的病人中发现了mcr-1与blaNDM-5共存的肺炎克雷伯菌,且对多种抗生素耐药。这种共存菌株的不断出现对公共卫生安全和养殖业的健康发展影响越来越大,应该引起我们的重视。
