模块化微反应系统内溴化间甲基苯甲醚连续合成
2020-09-29谢沛王凯邓建骆广生
谢沛,王凯,邓建,骆广生
(化学工程联合国家重点实验室,清华大学,北京100084)
引 言
溴化反应是一类重要的有机合成过程,即利用溴化剂中的溴取代有机化合物分子中的氢,生成相应的溴代产物[1]。Br2资源丰富,廉价易得,是目前最受欢迎的溴化剂。事实上,目前所有的溴化剂,例如,N−溴代丁二酰亚胺,溴化盐甚至HBr 等都是由Br2制备得到的[2−4]。但是由于溴的反应活性很高、反应过程复杂、体系毒性大且具有易挥发和强腐蚀性等特点,使得溴化反应的过程调控十分困难。首先,溴化反应速率较快,而传统的搅拌混合无法满足其混合和传质的要求,一方面会降低反应的速率,另一方面也使溴在反应体系中局部过量,易产生多溴副产物[5];其次,该反应过程中所采用的原料Br2以及取代副产物HBr,都具有一定的毒性和腐蚀性,对反应器的安全及防腐性能要求较高[6]。
4−溴−3−甲基苯甲醚是一种重要的溴代芳香醚,是间甲基苯甲醚与Br2−HBr 溶液发生溴代反应之后的产物,常被用作染料、医药中间体[7]。根据之前的报道[8−9],该反应属于芳环亲电取代,Br2为亲电试剂,由于苯环上甲氧基的给电子能力更强,亲电试剂更倾向于攻击其对位,因此,该反应的主产物是4−溴−3−甲基苯甲醚。然而,当溴局部过量时,4−溴−3−甲基苯甲醚还会继续与溴发生取代反应,生成相应的多溴代物,如图1所示。
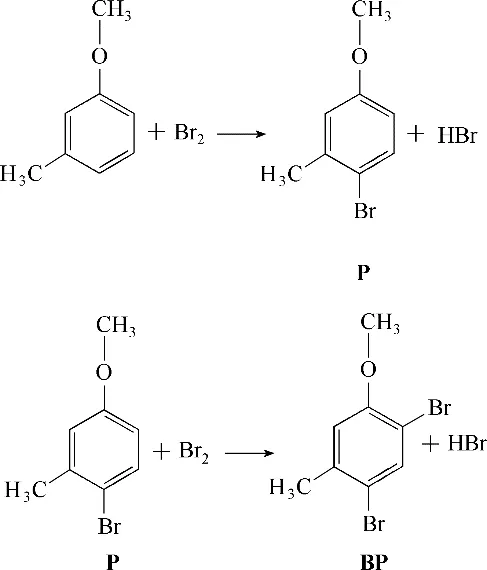
图1 间甲基苯甲醚溴化反应网络Fig.1 Reactions in methylanisole bromination process
目前工业生产中,4−溴−3−甲基苯甲醚是在搅拌釜中合成的,间甲基苯甲醚与Br2−HBr 溶液通过机械搅拌的方式进行混合。由于该反应过程强放热,所以一般采用滴加进料的方式控制反应温度,即间甲基苯甲醚先加入搅拌釜中,当温度下降至0~5℃时,Br2−HBr溶液再缓慢滴加进搅拌釜进行反应,其滴加速度根据温度的变化情况而定,反应温度需维持在4~8℃。在Br2−HBr 溶液滴加完毕之后,反应釜需再低温搅拌大约30 min,然后静置2 h,得到的上层油相就是以4−溴−3−甲基苯甲醚为主的物料。该间歇操作过程的反应效率极低,且由于停留时间很长,返混严重,会加剧多溴副反应的发生。因此,迫切需要开发4−溴−3−甲基苯甲醚连续高效合成技术。
微反应器的特征尺寸较小(仅为10 μm~1 mm),在实现物料混合及分散方面有着十分明显的优势,近年来在化学化工领域受到广泛关注[10−17]。相比于传统的化工设备,微反应器具有其独特的优势:①传递阻力小,传递距离短,接触面积大,传递性能好,停留时间可控[18−21];②可将传统的间歇过程连续化,提高反应的效率以及过程的可控性[12,20,22−23];③设备体积小,密闭性能好,可以有效地规避有毒、易腐蚀反应带来的风险,实现本质安全[2,5,24−25];④易于放大集成,微设备可以通过通道数目的增加实现可靠放大,微化工系统可方便地通过模块化微设备组装,快速实现微化工技术的产业应用[26−30]。
因此,本文以4−溴−3−甲基苯甲醚的合成为代表,针对非均相溴化反应存在的关键难题,根据溴化反应的基本规律,提出以微筛孔反应器和玻璃微珠填充床为核心构建模块化微反应系统,并在此模块化微反应系统内对液−液非均相连续溴化合成4−溴−3−甲基苯甲醚开展系统性研究。通过改变操作条件,研究反应起始温度、物料配比、HBr 浓度(质量分数)以及Br2浓度(质量分数)对间甲基苯甲醚溴化反应的影响规律,并将微反应技术与常规间歇反应技术进行对比,为4−溴−3−甲基苯甲醚的可控和连续化生产提供技术和设备依据。
1 实验部分
1.1 实验试剂
反应及分析过程使用到的试剂为:间甲基苯甲醚(山东道可化学有限公司)、Br2(>99.5%,国药集团化学试剂有限公司)、HBr 溶液(>40%,麦克林化学试剂有限公司)、NaOH(>98.5%,百灵威科技有限公司)、Na2S2O5(>96%,百灵威科技有限公司)、乙腈(色谱纯,百灵威科技有限公司)。
所有试剂均为购买后直接使用,无进一步纯化过程。
1.2 模块化微化工系统构建原理和微系统操作
模块化微化工系统的构建是微化工技术发展的基础,需要根据反应过程的基本要求和反应体系的物性进行设计和构建。液液非均相间甲基苯甲醚溴化反应虽然是快速反应,但要求满足反应转化率大于99%,选择性高。反应体系界面张力大,液液分散困难,液滴易聚并分相,且腐蚀性强、毒性大。由此可以看出,该反应过程对液滴分散尺寸、停留时间控制和分散体系在流动过程中的稳定性均有严格的要求。为此,本文提出由模块化的微筛孔设备实现微小液滴的可控制备,由6 个模块化玻璃微填充床实现液液微分散体系的稳定流动及控制反应时间,进而构建了如图2 所示的模块化微化工反应系统。
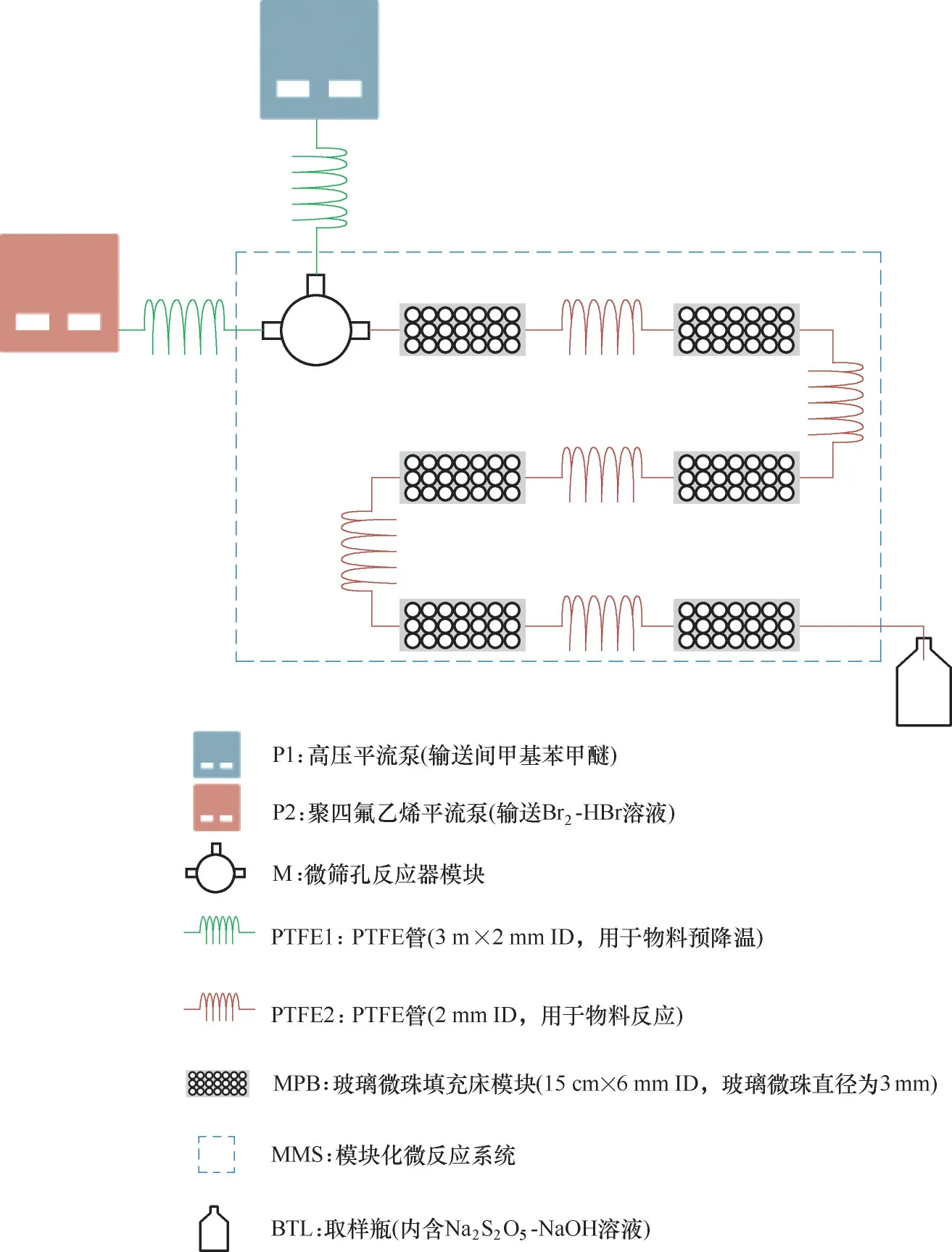
图2 实验装置示意图Fig.2 Experimental set−up of the methylanisole bromination reaction system
实验中反应所用的两股溶液分别为:纯间甲基苯甲醚(无稀释)和一定配比的Br2−HBr 溶液。本文选择HBr 溶液作Br2溶剂的原因主要有两个:一是HBr 溶液可以溶解、稀释Br2,降低反应速率,减少多溴副产物的发生;二是HBr 溶液可以溶解溴代之后的产物——HBr,反应物经静置、分相之后,可以将得到的HBr 溶液循环利用。Br2通过常温搅拌的方式即可溶于HBr 溶液,得到所需的Br2−HBr 溶液,然而Br2−HBr 溶液并不稳定,见光易分解,一般采用棕色玻璃瓶进行配制,且即配即用。终止液采用的是NaOH 和Na2S2O5的 混 合 水 溶 液(xNaOH:5%, xNa2S2O5:10%,均为质量分数),需在反应开始前,提前配制。
实验过程中间甲基苯甲醚和Br2−HBr 溶液分别通过高压平流泵(北京卫星厂)和聚四氟乙烯(PTFE)平流泵(上海同田生物)进行输送,然后分别通过一段PTFE 预冷盘管(置于低温水浴中)控制反应起始温度。反应温度在化工过程中是扮演着非常重要的角色,高温通常意味着更快的反应速率。然而,在该反应中,为了减少多溴副反应的发生,一般需要控制体系保持低温。相比于传统搅拌釜,模块化微反应系统的优势在于只需控制原料处于低温即可,整个微反应系统的温度处于室温。这在工业操作中是非常容易实现的,将节省大量的低温能耗。冷却后的间甲基苯甲醚和Br2−HBr 溶液进入模块化微反应系统,开始溴化反应。料液首先经过微筛孔反应器,进行初步的分散和混合。根据本课题组之前的研究[31],微筛孔反应器很适合液−液两相反应,可有效强化传质,减少副产物的产生。微筛孔反应器组成如图3 所示,总共包括五部分:1 和5 为PTFE 模块,模块1 用来提供间甲基苯甲醚的入口,模块5 有两个孔分别用来提供Br2−HBr 溶液的入口和混合料液的出口;2、3、4 均为PTFE 垫片(0.5 mm 厚),垫片4 用作间甲基苯甲醚的缓冲槽,垫片3 包含三个微筛孔(直径0.6 mm),用于强化分散,垫片2 主要提供两股物料混合的微通道(长14 mm,宽0.5 mm)。从微筛孔反应器流出后,尚未完成反应的料液经过PTFE 盘管流入模块化玻璃微珠填充床(内径6 mm,玻璃微珠直径3 mm),以实现反应过程停留时间的有效调控,同时在反应过程中对料液进行二次破碎,防止分相。当反应过程稳定后,将出口处样品引入正在搅拌的NaOH 和Na2S2O5的混合水溶液中,以中和产品中剩余的HBr和Br2,经过10 min 静置分相之后,取上层油相(4−溴−3−甲基苯甲醚)进行分析。
1.3 分析方法

图3 微筛孔反应器结构示意图Fig.3 Detailed structures of micro−sieve micromixer
静置分相之后的上层油相即为以4−溴−3−甲基苯甲醚为主的产品,取少量产品溶于乙腈,通过气相色谱(GC;岛津气相色谱−2014,火焰离子化检测器,色谱柱AESE−54,30 m × 0.32 mm × 0.5 μm)进行分析。其检测条件为:载气为99.999%N2,分流比1∶50,汽化室和检测器温度均为250℃,色谱柱升温流程为150℃→10℃/min →200℃(10 min),进样体积1 μl。
采用面积归一法对产品结果进行定量分析,主要考察的产品参数有:间甲基苯甲醚的转化率(Xconv)、4−溴−3−甲基苯甲醚的收率(Yyield)以及多溴副产物的收率(YBP),可分别通过式(1)~式(3)进行计算:

其中,xM、xP、xBP分别为间甲基苯甲醚、4−溴−3−甲基苯甲醚以及多溴副产物的峰面积比。
为了确保GC 分析方法的准确性,每个样品测量三次。GC分析方法的可重复性良好,间甲基苯甲醚、4−溴−3−甲基苯甲醚以及二溴代物的标准偏差分别为0.01%、0.04%和0.04%,且相对标准偏差均小于4%。
2 结果分析和讨论
2.1 反应起始温度
反应起始温度对间甲基苯甲醚溴化反应性能的影响如图4 所示,反应起始温度为0℃时,多溴副产物含量最少仅为1%。随着反应起始温度由0℃提升至30℃,间甲基苯甲醚的转化率以及4−溴−3−甲基苯甲醚的收率缓慢下降,同时多溴副产物的含量提升接近1 倍。这是因为温度升高,反应速率加快,但传质效率并没有明显的变化,Br2不能在体系中及时、均匀地分散,局部过量,引发了多溴副反应。一般工业上要求多溴代物的含量越小越好,因为去除过多的副产物需要二次精馏,会带来能耗大和流程长的问题,因此,高温对于该反应过程是不利的。

图4 反应起始温度对产物分布的影响(QBr2 −HBr=49.1 ml/min,QM=8.7 ml/min,xBr2=17.5%,xHBr=13.2%,nBr2/nM=1.01,T=0,5.0,10.0,15.0,20.0,25.0,30.0℃,τ=0.78 min,GC测量标准偏差小于0.05%)Fig.4 Effect of initial reaction temperature on the product distribution
2.2 反应物配比
Br2与间甲基苯甲醚的摩尔比对于溴化反应的作用非常明显,可以同时影响间甲基苯甲醚的转化率和产品的选择性,其结果如图5 所示。溴过量可以提升间甲基苯甲醚的转化率和4−溴−3−甲基苯甲醚的收率,当Br2过量2%时,间甲基苯甲醚的转化率可达99%,4−溴−3−甲基苯甲醚的收率达到98%。但同时,串联副反应也被增强,副产物含量明显提升,当溴过量超过1%时,YBP也超过1%。因此,nBr2/nM需要严格控制在1~1.01 之间,以确保产品的质量。由此可以看出,该反应过程物料配比的准确控制十分关键。
2.3 HBr浓度
在液液非均相溴化反应过程中,Br2先溶解在HBr水溶液中,然后再通过萃取的方式,进入间甲基苯甲醚油相发生溴化反应。这种液−液两相反应的方式,可以降低反应的速率,实现过程调控,但是对于该体系而言,HBr浓度还会影响溴化反应性能,如表1 所示。随着HBr 质量分数由10.0% 提升至33.0%,多溴副产物的含量由0.78%升高至2.38%,说明HBr 浓度的提高会加强多溴副反应的发生。Xconv和Yyield在HBr 质量分数为20.0%时存在最优值,这应是主反应与串联副反应竞争的结果,在HBr 浓度较低时,主反应的竞争力更强;而当其浓度高于一定值时,副反应的竞争力会被加强,从而造成了Xconv和Yyield先升高后下降的趋势。
2.4 Br2浓度
通常情况下,反应物料浓度的增加有利于反应速率的加快以及产能的提升。在该体系中,Br2浓度对反应规律的影响如表2 所示。随着Br2的质量分数从15%提升至25%,间甲基苯甲醚的转化率由96.8%提升至99.7%,但同时YBP也增长为原来的三倍。因此,综合考虑原料的转化率和产品的选择性,xBr2不能太高,在该体系内,Br2质量分数为17.5%时可以将多溴副产物含量控制在1%左右。

图5 反应物配比对产物分布的影响(QBr2 −HBr=49.1 ml/min,QM=8.5 ~9.1 ml/min,xBr2=17.5%,xHBr=13.2%,nBr2/nM=0.96,0.97,0.99,1.00,1.01,1.02,1.03,T=0℃,τ=0.78 min,GC测量标准偏差小于0.05%)Fig.5 Effect of molar ratio of reactants on the product distribution
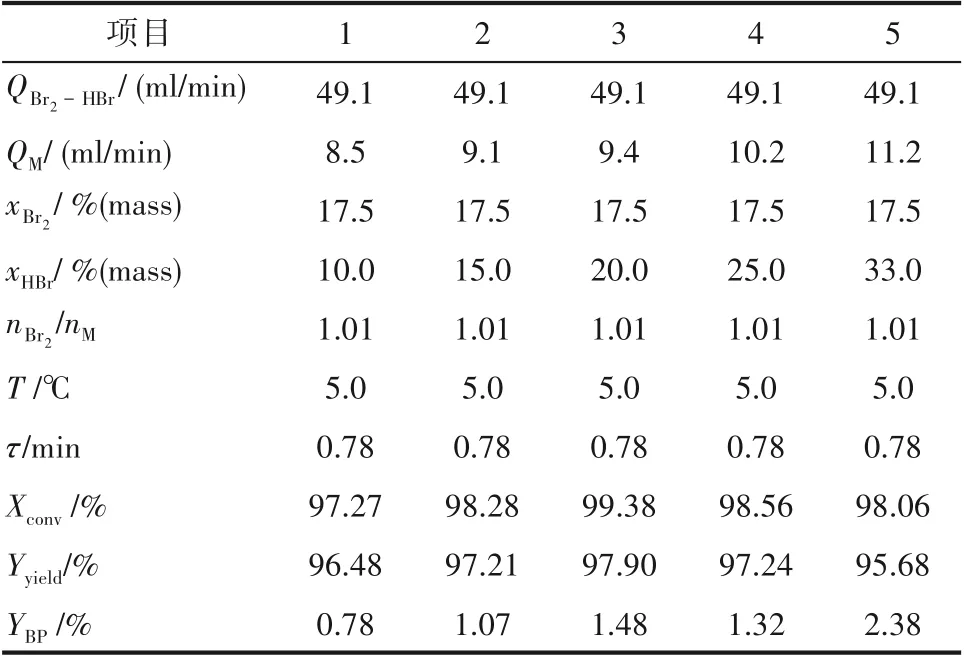
表1 HBr浓度对产物分布的影响Table 1 Effect of HBr concentration on the product distribution
2.5 微反应工艺优化以及微反应结果与传统搅拌反应的对比
前面通过考察各因素对反应性能的影响,可以得到该模块化微反应体系内的最优操作条件为:
xBr2=17.5%, xHBr=13.2%, nBr2/nM=1.01, T=0℃, τ=0.78 min,在此反应条件下反应的转化率达到99.56%,收率为98.37%,多溴代产物仅1.05%。将微反应的最优结果与传统工业搅拌釜数据进行对比,结果如表3 所示。首先,微反应系统极大地提升了反应的效率,其时空收率高达6.5×104kg/(m3·h),比传统搅拌釜高三个数量级(传统搅拌釜时空收率仅为45 kg/(m3·h))。另外,微反应系统还极大地提升了产品选择性,多溴副产物含量相对于搅拌釜减少一半,显示了连续微反应技术的巨大优势。
一般而言,溴化反应速度是非常快的,根据Bhore 等[32]的研究可知,邻硝基苯酚、间硝基苯酚和对硝基苯酚的溴化反应速率常数分别为7294、6147和9286 L/(mol·s)。基于该文献值,可以通过式(4)计算入田数Ha,来估计反应速率和传质速率的影响:
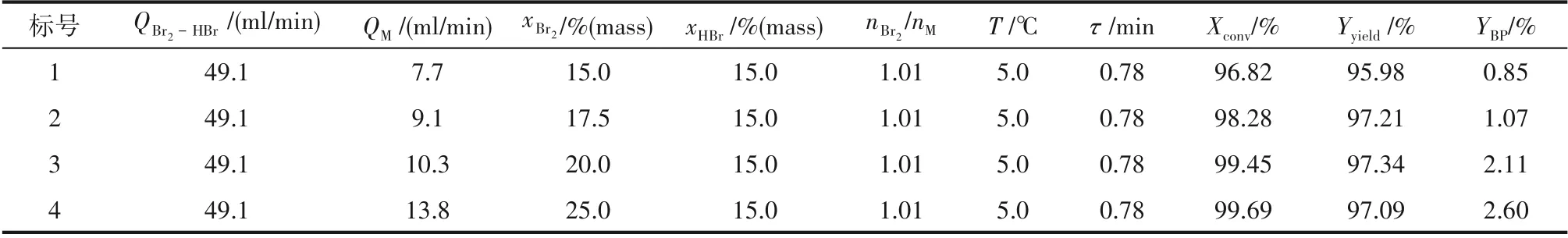
表2 Br2浓度对产物分布的影响Table 2 Effect of Br2 concentration on the product distribution
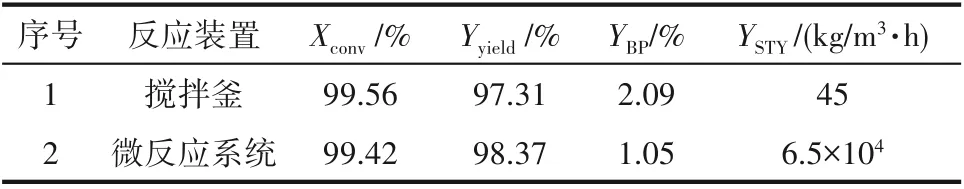
表3 微反应系统与搅拌釜的溴化结果对比Table 3 Comparison of bromination results between batch and microreaction system

其中,k 为溴化反应速率常数,这里采用邻硝基苯酚的溴化反应速率常数7294 L/(mol·s)来进行估算。DA为Br2在间甲基苯甲醚中的扩散系数,因为这两者之间会发生反应,难以直接测量,因此,采用Br2在正己烷内的扩散系数代替,约为3.72×10−7m2/s。CB为间甲基苯甲醚的摩尔浓度,可按照7.93 mol/L进行计算。K 为传质系数,其与传质比表面积a 一起决定了传质性能,这两个参数可以通过式(5)和式(6)进行计算[33−34]:

其中,CaC为连续相的毛细管准数;φD为分散相的相含率;d 为液滴的平均粒径。根据Wang 等[34]的研究,微筛孔器内的液滴直径(d)可以通过下面的半经验公式(7)进行计算:

其中,de为微通道的水力学直径;μ 为反应物黏度;Q 为反应物流量;下标C 和D 分别代表连续相和分散相。经计算,微筛孔反应器所得液滴直径大约为280 μm,远小于传统搅拌釜的分散尺寸。液滴尺寸的减小有利于传质效率的提升,由式(5)和式(6)可得,微筛孔反应器的传质系数约为5.75×10−5m/s,微分散体系的传质比表面积为3.32×105m2/m3。将以上数值全部代入式(4),即可计算相应的Ha,约为2550,远大于1。这也就意味着间甲基苯甲醚的溴化反应是一个快反应,受传质控制,因此,该模块化微反应系统可通过加强液液相间传质性能来强化该液−液溴化反应过程,即液滴分散尺寸越小越有利于实现反应过程的快速进行和高选择性。
3 结 论
本文提出利用模块化微反应系统对液−液非均相溴化反应合成4−溴−3−甲基苯甲醚过程进行强化,系统研究了在不同反应起始温度、物料配比、HBr 浓度以及Br2浓度条件下,原料转化率以及产品选择性的变化规律,提出了优化的微反应技术参数,并与传统的间歇反应过程进行比较。主要结论如下。
(1)以“微筛孔微反应器+玻璃微珠填充床”为核心构成的模块化微反应系统可有效强化液−液两相反应,且防止反应过程中相分离,保证反应过程的稳定性和可控性,具有很好的反应性能,这为气−液体系的均匀分散提供了一个很好的借鉴。
(2)模块化微反应系统可对间甲基苯甲醚的溴化反应过程进行有效强化,最优操作条件为:xBr2=17.5%, xHBr=13.2%, nBr2/nM=1.01, T=0℃, τ=0.78 min。在该反应条件下,间甲基苯甲醚的转化率可达99%以上,4−溴−3−甲基苯甲醚的收率大于98%,多溴副产物的含量仅约为1%。
(3)与传统搅拌釜间歇反应相比,模块化微反应系统内连续溴化反应具有十分明显的优势:可将间歇过程连续化,在保证安全的基础上极大地提升了反应的效率(时空收率为6.5×104kg/(m3·h));另外,该过程是由传质控制的,微反应器的传质性能优异,可极大地改善产品的选择性(多溴含量降为搅拌釜的一半),是微反应器强化反应过程的一个典型案例。
符 号 说 明
a——传质比表面积,m2/m3
CaC——连续相的毛细管准数
CB——传质速率估算中间甲基苯甲醚的摩尔浓度,mol/L
DA——Br2在间甲基苯甲醚中的扩散系数
d——液滴的平均粒径,μm
de——微通道的水力学直径,mm
Ha——八田数
K——传质系数
k——溴化反应速率常数,L/(mol·s)
nBr2/nM——溴与间甲基苯甲醚的摩尔比
nNaOH/nBr2——氢氧化钠与溴的摩尔比
QBr2−HBr——液/液间甲基苯甲醚溴化反应中溴溶液流量,ml/min
Qbase——终止碱液流量,ml/min
QM——间甲基苯甲醚流量,ml/min
T——反应起始温度,℃
Xconv——间甲基苯甲醚的转化率,%
xBP——多溴副产物的峰面积比,%
xBr2——Br2在溶液中的质量分数,%
xHBr——HBr的质量分数,%
xM——间甲基苯甲醚峰面积比,%
xNaOH——NaOH的质量分数,%
xNa2S2O5——Na2S2O5的质量分数,%
xP——4−溴−3−甲基苯甲醚的峰面积比,%
YBP——多溴代间甲基苯甲醚的收率,%
YSTY——时空收率,kg/(m3·h)
Yyield——4−溴−3−甲基苯甲醚的收率,%
μ——体系黏度,mPa·s
τ——停留时间,min
φD——分散相的相含率,%
