右美托咪定对糖尿病小鼠肾缺血再灌注损伤的保护作用①
2020-09-29刘晓艳山东省淄博市第一医院手术麻醉科淄博255200
杜 刚 陈 娜 刘晓艳 赵 亮 (山东省淄博市第一医院手术麻醉科,淄博 255200)
糖尿病(diabetes mellitus,DM)是一种代谢紊乱性疾病,伴有多种并发症,包括微血管和大血管病变及缺血再灌注性(ischemia/reperfusion,IR)损伤等[1]。IR是造成急性肾损伤的高危因素,可造成肾组织细胞损害,如肾小管内皮细胞凋亡和坏死[2,3]。内质网(endoplasmic reticulum,ER)是具有多种生物学功能的细胞器,包括对细胞各种压力的响应,如低氧、饥饿、感染和分泌需要的变化[4]。ER应激是对IR损伤的应激反应,IR损伤会产生大量活性氧簇(reactive oxygen species,ROS),并造成蛋白质折叠和组装紊乱,这些未折叠或错误折叠的蛋白质积聚后会造成ER应激[5]。右美托咪定(dexmedetomi-dine,DEX)是一种具有高度特异性和α2肾上腺素能的高效抑制剂,具有镇静、止痛和交感神经阻滞的效用[6]。在肾组织中,α2肾上腺素能受体广泛分布于肾小管的近端、远端及其他脉管周围[7]。研究显示,DEX可以在IR性肾损伤中有效减少肾小管上皮细胞凋亡,并促进肾小管结构重建[6-8]。有动物实验表明,DEX可以有效保护IR损伤后的多种器官损伤,包括肾脏、心脏、大脑等,其主要通过抗凋亡、抗炎和抗氧化应激等发挥保护功能[9-11]。本文根据既往研究成果,探究DEX在糖尿病小鼠肾IR损伤中的治疗效果及ER应激和细胞凋亡相关机制,以期为糖尿病肾病的诊治提供参考。
1 材料与方法
1.1材料
1.1.1试剂 血清尿氮素含量测定试剂盒(货号:BC1535)购自北京索莱宝科技有限公司;血清肌酐酸测定试剂盒(货号:GMS70021.1)购自上海杰美基因医药科技有限公司;尿蛋白含量检测试剂盒(货号:GB370S)购自北京九强生物技术股份有限公司;小鼠LDL检测试剂盒(货号:QY-M30023)、小鼠SOD检测试剂盒(货号:QYS-03061)和小鼠MDA检测试剂盒(货号:QYS-03052)购自上海齐一生物科技有限公司;Click-iT®Plus TUNEL assay试剂盒(货号:C10618)购自Invitrogen公司;苏木素伊红(HE)染色试剂盒(货号:C0105)购自碧云天;CHOP(货号:ab11419)、ATF6(货号:ab37149)、Cleaved Caspase-12(货号:ab62484)、GAPDH(货号:1056)一抗购自美国Abcam公司;HRP标记的山羊抗小鼠二抗购自美国Santa Cruz公司。
1.1.2仪器 半干转膜仪、电泳仪均购于美国伯乐公司;Multiskan GO酶标仪购自Thermo;Gel View 6000化学发光凝胶成像仪购于广州云星仪器有限公司;分析天平ME204购自梅特勒托利多国际贸易(上海)有限公司;DW-86L578J -86℃超低温冰箱、DW-25L262h 25℃低温保存箱和HYC-3102~8℃医用冷藏箱购自海尔公司;Eppendorf 5702R台式冷冻离心机购自德国艾本德股份公司。
1.1.3实验动物 50只8周龄糖尿病db/db小鼠购自北京维通利华实验动物公司,许可证号为SYXK (京) 2014-0001,合格证号:0015675。
1.2方法
1.2.1糖尿病小鼠肾IR模型建立 50只糖尿病db/db小鼠适应性饲养一周后随机平均分为假手术组(Sham组)、IR手术组(IR组)及IR手术+DEX组(DEX剂量分别为12.5、25、50 μg/kg)。IR+DEX组小鼠在手术前30 min分别腹腔注射12.5、25、50 μg/kg 的DEX。IR组小鼠经非创伤性血管钳封闭双肾蒂,缺血45 min后解除封闭。Sham组小鼠经相同解剖过程,但不进行肾蒂封闭。手术结束后,青霉素溶液(20万 U/ml)冲洗手术切口,缝合皮肤,并肌注青霉素钠4万U/只以防术后感染。
1.2.2小鼠基本指标检测 各组处理结束后,提取小鼠血清及肾组织标本,检测血清中血清尿氮素(blood urea nitrogen,BUN)、尿蛋白和血清肌酐酸表达;组织经处理后检测相应LDH、SOD和MDA表达水平(详见下述)。
1.2.3HE染色检测糖尿病小鼠肾组织形态 切片经3次二甲苯浓度脱蜡,梯度浓度酒精脱苯后,蒸馏水冲洗5 min×2次;苏木素染核15 min,蒸馏水冲洗;0.5%盐酸酒精分色,蒸馏水冲洗15 min;70%和80%酒精先后浸泡10 min,伊红复染1 min,90%酒精分化10 s;95%酒精脱水2次,各10 min,100%酒精脱水2次,各15 min,二甲苯透明3次,每次时间分别为10 min、15 min、15 min;中性树脂封片观察。
1.2.4TUNEL染色鉴定糖尿病小鼠肾组织细胞凋亡 小鼠处死后肾组织经石蜡包埋,二甲苯中脱蜡5~10 min,换用新鲜二甲苯,再次脱蜡5~10 min;经无水乙醇5 min,经90%乙醇2 min,70%乙醇2 min脱苯,蒸馏水2 min。滴加20 μg/ml不含DNase的蛋白酶K,P0106洗涤液20~37℃下作用15~30 min。PBS洗涤3次。配制适当量TUNEL检测液滴加至样品,37℃避光孵育60 min。洗涤后用抗荧光猝灭封片液封片后显微镜下(激发波长范围为450~500 nm)观察。
1.2.5ELISA检测肾组织细胞炎症因子 ELISA法检测糖尿病小鼠肾组织中相关ER应激分子乳酸脱氢酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)等水平。小鼠肾组织从-86℃超低温冰箱中取出后,冰上溶解,称取0.03 g组织,剪碎研磨,加入1 ml PBS缓冲液,4 000 r/min(离心半径=13.5 cm)低温离心8 min,取上清液用于实验。分别设空白孔,标准品孔,待测样品孔,标准品孔加入标准品50 μl,样品孔先加入样品稀释液40 μl后加待测样品10 μl。封板后37℃孵育30 min。洗涤母液经蒸馏水稀释30后备用。缓慢揭掉封板膜,弃去液体后,每孔加洗涤液清洗30 s,重复5次,拍干酶标板。每孔加酶标试剂50 μl,空白孔不加。再次封板后37℃孵育30 min。重复上述洗涤步骤,各孔加入显色剂A液和B液各50 μl,缓慢振荡混匀后,37℃避光显色10 min。各孔加入50 μl 终止液终止反应(终止后蓝色立即转为黄色)。检测450 nm波长下OD值(测定应在加入终止液后的15 min内进行)。
1.2.6Western blot检测细胞中蛋白表达 检测组织中ER应激及凋亡相关因子CHOP、ATF6和Cleaved Caspase-12表达水平。收集细胞,PBS清洗3次,用添加蛋白酶抑制剂的细胞裂解液进行裂解,RIPA裂解液提取各组细胞总蛋白。BCA试剂盒检测总蛋白浓度,10% SDS-PAGE分离蛋白后用半干转膜仪转移蛋白质至PVDF膜。5%脱脂牛奶室温封闭蛋白2 h后加入一抗,4℃封闭过夜,第2天加入对应二抗室温封闭1 h,最后滴加ECL曝光显影,显色并统计灰度值计算相对表达量。
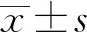
2 结果
2.1DEX改善糖尿病小鼠肾功能异常指标 与Sham组小鼠相比,IR组小鼠BUN、尿蛋白和血清肌酐酸均显著上调(P<0.01)。经DEX治疗后,与IR组小鼠相比IR+DEX各剂量组小鼠BUN、尿蛋白和血清肌苷酸均下降(P<0.05或P<0.01)(图1)。

图1 各组糖尿病小鼠肾功能指标检测
2.2DEX改善糖尿病小鼠体内ER应激相关分子水平 ELISA结果显示,与Sham组相比,IR组ER应激产物LDH和MDA表达升高(P<0.01,图2A、C);SOD表达降低(P<0.01,图2B);与IR组相比,IR+DEX各剂量组ER应激产物LDH和MDA表达降低(P<0.05或P<0.01,图2A、C),而SOD表达升高(P<0.05或P<0.01,图2B)。
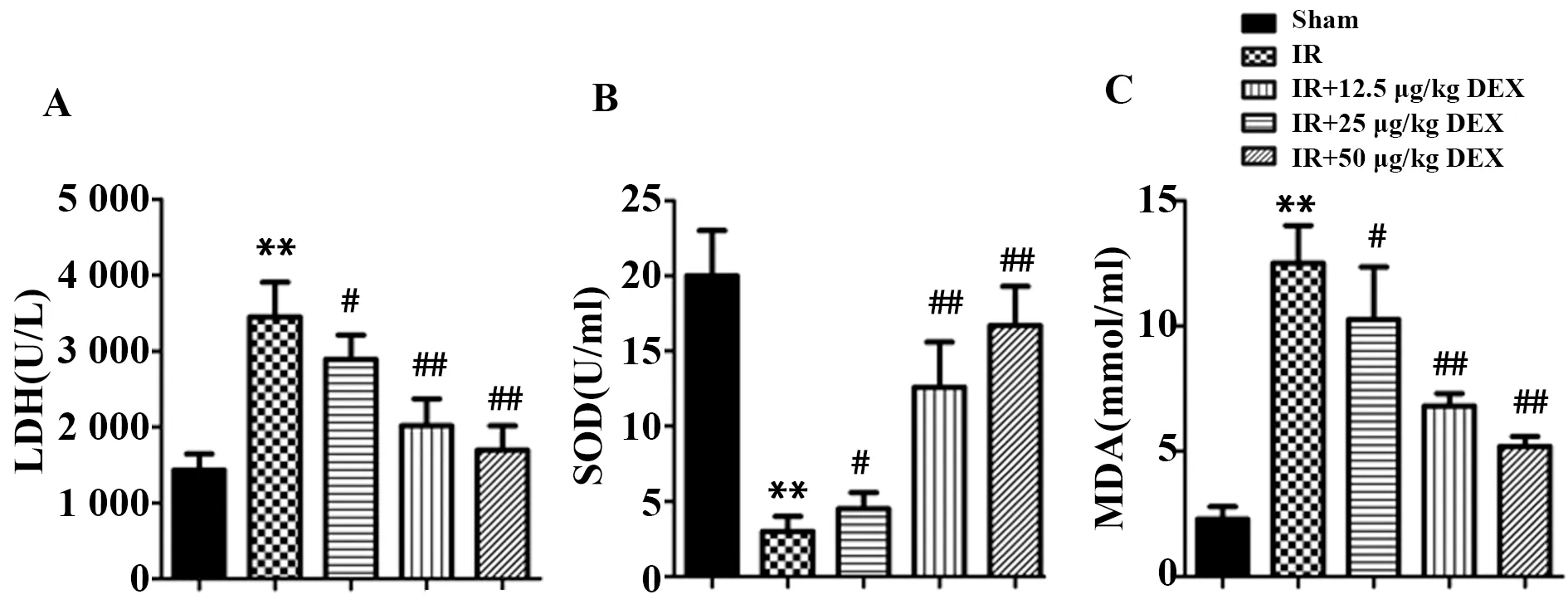
图2 ELISA检测糖尿病小鼠肾组织ER应激相关分子水平
2.3DEX改善糖尿病小鼠肾组织细胞形态 HE染色结果显示,与Sham组相比,IR组糖尿病小鼠肾组织细胞结构不清晰,肾小管扩张,细胞变扁,细胞核浓缩,肾小管中有脱落细胞,同时伴有炎症细胞浸润及充血现象;经DEX治疗后,与IR组相比,IR+DEX各剂量组小鼠肾组织细胞轮廓逐渐清晰,肾小管紧实,细胞核恢复正常,炎症浸润和充血现象得到改善(图3)。
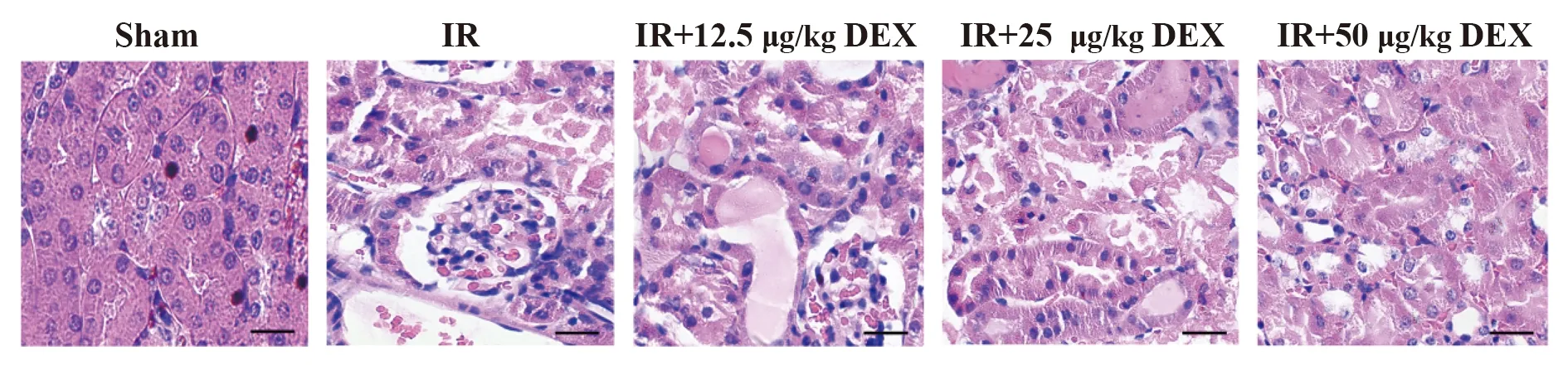
图3 HE染色检测糖尿病小鼠肾组织细胞形态
2.4DEX改善糖尿病小鼠肾组织细胞凋亡程度 TUNEL染色结果表明,与Sham组相比,IR组小鼠肾小管细胞发生明显凋亡(P<0.01);经DEX处理后的各IR+DEX剂量组小鼠肾小管细胞凋亡现象均得到改善(P<0.05或P<0.01,图4)。
图4 TUNEL染色鉴定糖尿病小鼠肾组织细胞凋亡
2.5DEX改善糖尿病小鼠肾组织ER应激及凋亡相关因子水平 Western blot结果显示,与Sham组相比,IR组三者表达均上调(P<0.01);与IR组相比,各IR+DEX剂量组CHOP和Cleaved Caspase-12表达下调(P<0.05或P<0.01),IR+DEX低剂量组ATF6表达差异无统计学意义,IR+DEX中、高剂量组ATF6表达水平降低(P<0.05或P<0.01,图5)。
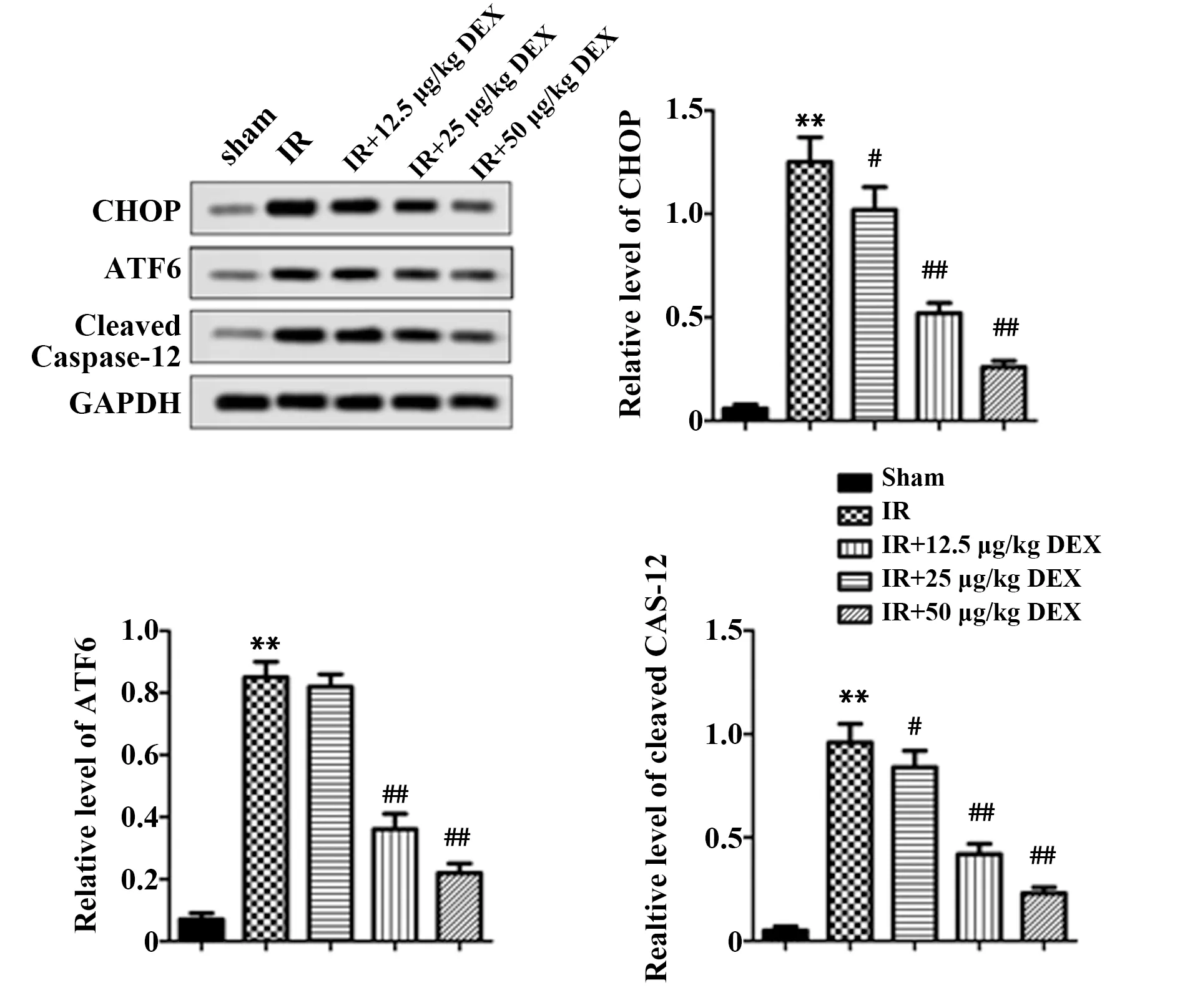
图5 Western blot检测各组ER应激和凋亡相关蛋白表达
3 讨论
糖尿病是常见的疾病类型,全球大约有2.85亿患者正在遭受糖尿病折磨,且这一数据将在2030年增至4.3亿人[12]。糖尿病患者同时会伴有多种并发症,包括微血管和大血管病变及IR损伤等,导致肾损伤和肾功能紊乱[1]。因此针对肾IR损伤相关机制的研究具有重要意义。
肾IR损伤相关的ER应激和细胞凋亡机制尚未阐明。ER功能失调和应激反应不但是Ⅰ型和Ⅱ型糖尿病的主要发病机制,也是其他自体免疫性疾病和神经退化性疾病的基础[13]。大量研究表明,在糖尿病进程中,ER系统内平衡性改变可直接导致胰岛β细胞功能紊乱甚至细胞死亡[14]。本研究建立db/db小鼠糖尿病模型,以双侧肾IR模型为研究体系,发现IR模型组小鼠肾组织细胞发生严重的ER应激反应,肾组织细胞内LDH和MDA表达上调,SOD表达下调。
深入研究糖尿病肾IR损伤发病机制对控制糖尿病急性肾损伤具有重要意义。目前有几种常用方法来治疗IR,药物护理是降低IR损伤风险最常用的手段,如DEX、硫酸镁及胰岛素等[15-17]。本研究探究了DEX对糖尿病小鼠肾IR损伤的保护作用,根据HE染色和免疫组化结果确定DEX可避免由IR导致的肾组织细胞的损伤和凋亡;并且检测到BUN、尿蛋白和血清肌酐酸明显下调。
肾IR损伤是在缺血环境和再次灌注过程中产生的复杂炎症反应过程,伴随一系列细胞炎症活动事件,如炎症细胞浸润增加微血管通透性、组织水肿、肾髓质细胞功能紊乱及肾间质及肾小管形变等症状[18-20]。既往研究表明,DEX预处理对肾脏IR损伤具有保护作用,且是以α2肾上腺素受体依赖性方式发挥作用,并通过PI3K/AKT信号通路活化来发挥抗凋亡活性[21]。本研究表明DEX治疗可改善小鼠受损的肾组织。在抗ER应激方面,IL-4、IL-10等可上调SOD,下调MDA和LDH表达[22,23],本研究结果证实DEX处理后小鼠肾组织中SOD显著上调,LDH和MDA显著下调,ER应激水平降低。Western blot检测DEX处理后小鼠肾组织ER应激相关蛋白表达水平,发现CHOP和ATF6表达降低,说明DEX可以有效降低小鼠ER应激反应。
肾IR损伤不仅伴有严重的ER应激反应,同时还会造成肾小管内皮细胞凋亡和急性肾小管细胞坏死等[18-20]。本研究利用TUNEL染色检测各处理组肾组织细胞后发现,IR组小鼠细胞严重凋亡;经DEX治疗后,细胞凋亡现象得到明显缓解。进一步考察凋亡相关蛋白表达情况后发现,Cleaved Caspase-12在IR组中显著上调,在接受DEX治疗后则恢复至接近Sham组小鼠水平。Su等[24]报道称,内质网应激凋亡途径是重要的内源性凋亡途径之一,Caspase-12是定位于内质网外膜上的促凋亡分子,是该途径的重要凋亡蛋白。表明在糖尿病小鼠IR损伤中,DEX可有效抑制细胞凋亡。
综上所述,DEX对糖尿病小鼠肾IR损伤具有一定治疗效果,其发挥作用的机制可能通过DEX抑制肾组织细胞中ER应激和凋亡相关通路实现。但ER应激反应涉及诸多通路,如Ire1通路、Perk通路及ATF6通路等[5];IR损伤的机制具体涉及哪几种通路还需要进一步明确。
