代谢工程调控策略在生物合成氨基酸及其衍生物中的应用
2020-09-29高虎涛申晓林孙新晓王佳袁其朋
高虎涛,申晓林,孙新晓,王佳,袁其朋
(北京化工大学化工资源有效利用国家重点实验室,北京100029)
引 言
氨基酸是一种同时含有氨基和羧基基团的有机小分子,多个氨基酸残基按照一定的顺序和排列方式,通过肽键连接组成了行使生命活动的蛋白质大分子。氨基酸不仅在生命体新陈代谢过程中发挥十分重要的作用,随着对氨基酸研究的不断深入,其更多的功能被挖掘出来。例如基本氨基酸L−天门冬氨酸是天冬氨酸酐、四氢呋喃胺等多种化学品的前体物质[1−2],一些非蛋白质氨基酸如L−茶氨酸具有保护神经、抗疲劳和降血压等方面的功效[3],还有一些氨基酸的衍生物如5−羟基色氨酸是一种神经递质5−羟色胺的直接前体,能够治疗抑郁、失眠等神经类疾病[4]。随着氨基酸潜在应用价值的不断发掘,工业化的脚步也随之迈进,1980 年后的20 年间,氨基酸市场主要以饲料添加氨基酸(L−赖氨酸、DL−蛋氨酸、L−苏氨酸等)和食品添加氨基酸(L−谷氨酸、L−苯丙氨酸、L−天冬氨酸)为主[5],但21 世纪后人们更青睐于具有特殊价值的氨基酸的专一化生产。全球氨基酸市场分析报告指出:预计到2022 年全球氨基酸市场将达到256 亿 美 元 的 份 额[6]。
1907 年,东京帝国大学Ikeda 从紫菜中发现并提纯具有增鲜作用的味精谷氨酸钠,味之素公司开始从经过酸水解的小麦面筋和经过脱脂处理过的大豆中提纯谷氨酸钠作为增鲜品出售[7],氨基酸的工业化生产由此正式打开了大门。但此时的生产方式仅仅是通过提取法或者化学合成的方法获得。提取法原料需求量大,提取过程繁杂;化工合成成本高,反应条件较为苛刻,有较大的安全隐患[8],而且只能合成外消旋产物。这些问题促使人们寻求更加简便、经济、可持续的生产模式生产氨基酸。随着合成生物学、基因工程、发酵工程等新兴学科的深入研究,到20 世纪50 年代末,发酵技术被应用于生产一部分氨基酸,奠定了现代发酵生产氨基酸的基础[9]。
传统发酵法生产氨基酸最大的问题是盲目性,源于对更高产量的追求,人们不断筛选较高产量的菌株,也就是通过诱变和筛选的方法来改良菌株,但是,随机的突变通常导致基因组产生不确定的改变,因此不易判断其产生的影响[10]。为了使构建的微生物细胞工厂更具工业化竞争力,菌株开发已经转向有针对性的工程策略,建立了集系统生物学的计算技术、合成生物学的精细化设计理论、进化工程合理和随机的诱变方法、发酵工程的最优化培养方案于一体的系统代谢工程[11−13],在确定目标产物及其代谢途径后,通过调控基因表达、削弱竞争途径、调节碳流量分配、提高对某中间产物或终产物的耐受等方式,不断改善菌株的生产性能,以构建适合工业化生产的工程菌株。
本文将综述不同的代谢调控策略在氨基酸及其衍生物的微生物细胞工厂生产中起到的独特作用,分析不同代谢调控策略的优势和缺点,最后提出对利用微生物作为平台生产氨基酸及其衍生物的前景与面临的挑战。
1 代谢工程调控策略
1.1 碳源的高效利用
利用微生物发酵的方法生产目标产物,最重要的是提高碳源的有效利用率。目前,研究者们常利用非磷酸烯醇丙酮酸:糖磷酸转移酶系统(non−phosphotransferase system,非PTS)代替野生菌天然的PTS 系统提高碳源的有效利用率[14−16]。天然的PTS 系统摄取葡萄糖的能力很高,但该系统转运葡萄糖使用磷酸烯醇式丙酮酸(PEP)作为磷酰基供体并将其转化为丙酮酸,导致产物丙酮酸来不及消耗而积累[17],而当PTS 途径中葡萄糖特异性EII 通透酶(PtsG)缺失后,细胞通过半乳糖渗透酶GalP 和甲基半乳糖苷渗透酶MglBAC 的非磷酸化方式摄取葡萄糖,随后在葡萄糖激酶(glk 和ppgK)的催化下以三磷酸腺苷(ATP)或多聚磷酸盐(PolyP,一种线性聚合物,存在于所有活细胞中)而不是PEP 作为磷酰基供体利用葡萄糖[18−19],利用该非PTS系统转运葡萄糖的效率虽然有些降低但却减少了副产物丙酮酸的溢流,使葡萄糖的有效利用率显著提高。左旋鸟氨酸是一种非蛋白质氨基酸,研究发现它能够加速伤口愈合并能有效维持心脏健康。Zhang 等[20]通过敲除肌醇渗透酶(IolT1 和IolT2,分别由iolT1 和iolT2 编码)的一种阻遏蛋白基因iolR[21]和过表达iolT1 激活非PTS 葡萄糖转运系统,与利用PTS 系统的对照菌株相比,在生长速率大致相同的情况下,利用非PTS系统的菌株发酵上清液中检测到浓度更低的葡萄糖,左旋鸟氨酸的产量增加了10%,这说明非PTS途径中葡萄糖的利用率有所提高,最终,在60 h的发酵中得到了43.6 μg/L的左旋鸟氨酸。Vogt等[22]在生产L−亮氨酸的研究中,同样敲除了iolR 并利用非PTS系统,使葡萄糖的利用率提高了40%,L−亮氨酸的产量达到23.7 g/L。更进一步的研究中,Xu 等[17]过表达了iolT1、iolT2 和ppgK,最终在补料分批发酵中利用该工程菌生产L−赖氨酸的最高产量为201.6 g/L[图1(a)]。由于在芳香族氨基酸生产的代谢通路中,PTS 系统与莽草酸途径竞争重要中间代谢物PEP[23−24],因此在大肠杆菌(Escherichia coli)中抑制PTS 系统,使更多的PEP 被用于生产芳香族化合物已经成为一种成熟的代谢工程策略[25]。L−3,4−二羟基苯丙氨酸(L−DOPA)是用于治疗帕金森氏疾病类药物的主要前体物质,Muñoz 等[26]用galP(编码半乳糖渗透酶)和glk(编码葡萄糖激酶)替代PTS 功能,使L−DOPA 的前体L−酪氨酸的生产速率较利用PTS 途径生产提高了3.7 倍,最终L−DOPA 的分批发酵培养产量达到1.51 g/L[图1(b)]。
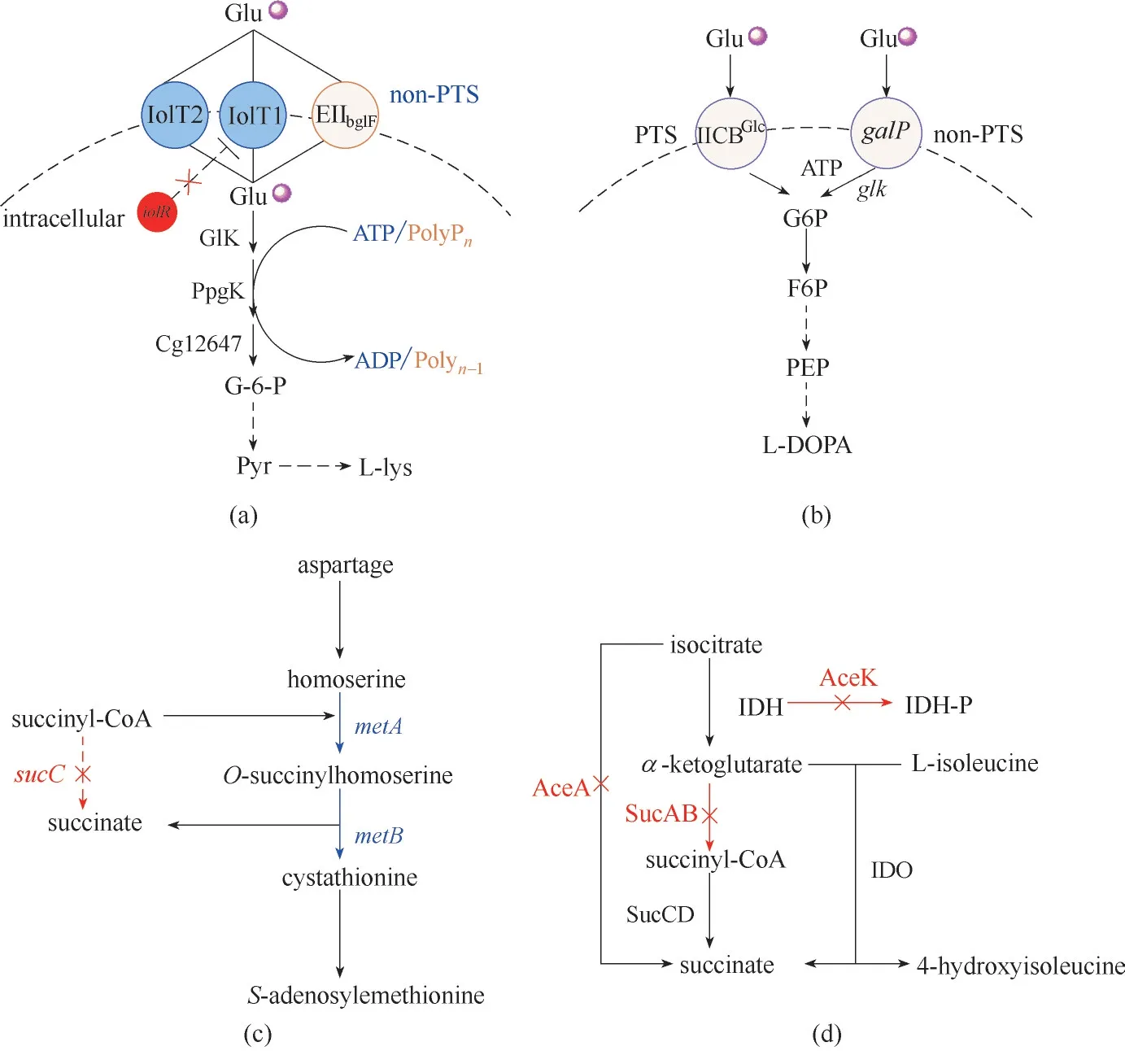
图1 碳源高效利用策略的应用(a)L−赖氨酸在谷氨酸棒状杆菌中的部分生物合成途径;(b)L−3,4−二羟基苯丙氨酸在大肠杆菌中的生物合成途径;(c)S−腺苷甲硫氨酸在解淀粉芽孢杆菌中的生物合成途径;(d)4−羟基异亮氨酸在大肠杆菌中的生物合成途径IolT1,IolT2—肌醇通透酶;EIIbglF—β−葡萄糖苷−PTS渗透酶;GlK,PpgK,Cgl2647—葡萄糖激酶;IICBGlc—整合膜葡萄糖通透酶;galP—半乳糖渗透酶基因;glk—葡萄糖激酶基因;sucC—琥珀酰−CoA合成酶基因;metA—高丝氨酸O−琥珀酰转移酶基因;metB—胱硫醚−γ−半胱氨酸酶基因;IDH—异柠檬酸脱氢酶;IDO—L−异亮氨酸双加氧酶;AceA—异柠檬酸连接酶;AceK—异柠檬酸脱氢酶激酶;SucAB—α−酮戊二酸脱氢酶Fig.1 Application of carbon source efficient utilization strategy(a)partial biosynthetic pathway of L−lysine in Corynebacterium glutamicum;(b)biosynthetic pathway of L−3,4−dihydroxyphenylalanine in E.coli;(c)biosynthetic pathway of S−adenosylmethionine in B.amyloliquefaciens;(d)biosynthetic pathway of 4−hydroxyisoleucine in E.coli
在现阶段的很多研究中,最常利用过表达某些基因的方法提高目标产物的产量,但在连续培养的过程中容易发生质粒的丢失[27],且用于过表达的质粒会给细胞本身带来代谢负担[28],导致较低的碳源利用率和较低的生产效率,Koma 等[29]通过染色体工程利用基因整合构建了PtyrR(tyrR 启动子)和T7RP(T7 启动子控制下的RNA 聚合酶)/PT7lac(T7 启动子和lac 操纵子序列组成的T7lac 启动子)偶联的组成型过表达系统生产苯丙氨酸,结果显示,基于质粒的在T7 启动子控制下的诱导型苯丙氨酸生产菌株大肠杆菌MG1655 在生长阶段的生长速率为0.22 h−1,生产阶段的生长速率仅为0.09 h−1,而基于染色体的在T7 启动子控制下的组成型苯丙氨酸生产菌株M−PAR−200 在相同条件下,生长阶段和生产阶段的生长速率均为0.30 h−1,另外,在发酵培养30 h 后,菌株大肠杆菌MG1655 的苯丙氨酸产量仅为0.3 g/L,而菌株M−PAR−200 在发酵培养27 h 后产量就已达到1.4 g/L。通过染色体重组构建组成型的表达系统会减轻菌体的代谢负担,提高碳源利用率并改善菌株生产。这种方法还减少了高价诱导剂和抗生素的使用,具有广阔的应用前景[29]。
另外,为了提高碳源利用率,将目标化合物的生产与工程细胞的生长相耦合,以生长为驱动力驱动细胞生产的方式也逐渐受到关注。有氧条件下,微生物通常利用糖酵解及三羧酸循环(TCA 循环)实现细胞生长,TCA 循环中的一些化合物往往是目标产物的重要中间体,如果为扩大该中间体的通量而抑制甚至截断TCA 循环会使细胞的生长受阻,也不利于目标化合物的生产[30]。Ruan等[31]在研究利用解淀粉芽孢杆菌(Bacillus amyloliquefaciens)生产S−腺苷甲硫氨酸的研究中指出,TCA 循环的中间体琥珀酰−CoA 能够在高丝氨酸O−琥珀酰转移酶(metA)的催化下与高丝氨酸合成O−琥珀酰高丝氨酸,O−琥珀酰高丝氨酸在胱硫醚−γ−半胱氨酸酶(metB)的催化下分解为胱硫醚和琥珀酸,胱硫醚进一步合成目标产物S−腺苷甲硫氨酸,而琥珀酸重新进入TCA循环,当敲除TCA 循环中琥珀酰−CoA 合成酶基因sucC(催化琥珀酰−CoA 转化为琥珀酸)时,细胞不仅能够正常生长,且由于更多的底物琥珀酰−CoA进入到S−腺苷甲硫氨酸的合成途径当中,S−腺苷甲硫氨酸的产量达到107.47 mg/L,GC−MS分析表明与敲除sucC 之前相比,下游代谢产物蛋氨酸产量增加了41%。这种耦合方式巧妙共用了部分TCA 循环,实现了碳源有效利用和目标产物增加的双赢[图1(c)]。无独有偶,俄罗斯学者Smirnov 等[32]在对大肠杆菌(E.coli)中合成4−羟基异亮氨酸(4−HIL)的研究中也利用了与TCA 循环耦合的方法,4−HIL 是一种非蛋白质氨基酸,由于其2S、3R、4S的特异构型严格取决于葡萄糖的浓度发挥其促胰岛素作用,可用于治疗和预防2−型糖尿病。L−异亮氨酸−4−羟化酶(IDO)因其立体特异性的催化特点而被关注,在该酶的催化下,TCA循环中的α−酮戊二酸与L−异亮氨酸被转化为琥珀酸和4−HIL,在缺失α−酮戊二酸脱氢酶基因sucAB 及异柠檬酸连接酶和异柠檬酸脱氢酶激酶基因aceAK 的菌株中,细胞能够正常生长,并且底物转化率达到82%,发酵培养22 h 后4−HIL 的产量达到24.1 g/L[图1(d)]。
虽然非PTS 系统有利于节省PEP,降低丙酮酸的积累,在利用微生物生产芳香族氨基酸方面更具优势,但该系统摄取葡萄糖的效率较低,限制了产物的产量和菌株的生产能力。目前有研究筛选了更高效的非PTS系统摄取葡萄糖的相关蛋白以提高该系统的葡萄糖摄取能力,如来自运动发酵单胞菌(Zymomonas mobilis)的葡萄糖转运促进蛋白Glf(由glf 编码)可更高效地转运葡萄糖[33]。另一方面,由于大规模商业化发酵对低成本的要求[34],氨基酸的生产倾向于选择更廉价的碳源,如CO2、乙酸和甲醇等[35−39],尽管目前这些碳源高效利用的研究还处于起步阶段,利用率较低,且与葡萄糖共利用时由于阻遏导致共利用困难,但是为利用廉价碳源生产氨基酸及其衍生物奠定了理论基础。
1.2 限速步骤的调节
在利用基因工程方法改造底盘菌株代谢途径时,往往有一些限速步骤抑制通路的活性,找到并解除限速步骤是提高产量的关键[40]。Li 等[41]在从头合成能够诱导免疫系统并增强植物对疾病的抵抗能力的高丝氨酸时发现,即使敲除竞争途径以及高丝氨酸的分解代谢途径后,高丝氨酸的产率仍然很低。经过不同基因型的比对,发现将天冬氨酸半醛还原为高丝氨酸的反应是高丝氨酸高效生产中的限速步骤,过表达thrA(编码高丝氨酸脱氢酶Ⅰ)或者metL(编码高丝氨酸脱氢酶Ⅱ)能有效提高高丝氨酸的产量。在44 h 分批补料培养后分别检测到1.20 g/L(过表达thrA)和1.04 g/L(过表达metL)的高丝氨酸,分别是未过表达高丝氨酸脱氢酶菌株产量的3 倍和2.6 倍[图2(a)]。在合成抗癫痫药物左乙拉西坦和溴西拉坦的直接前体L−高丙氨酸的研究中,由于谷氨酸脱氢酶(GDH)对谷氨酸生物合成的催化活性比对谷氨酸降解的催化活性高20倍以上,为了提高2−酮丁酸生成L−高丙氨酸的转化率[42],利用谷氨酸脱氢酶替代大肠杆菌(E.coli)内源的转氨酶,并以谷氨酸脱氢酶为模板进行定向蛋白质工程改造,具有K92V 和T195S 突变的GDH2 突变体显示出最高的生产率,对比未定向进化的GDH 使2−酮丁酸向L−高丙氨酸的转化率提高了300%以上,通过蛋白质工程改造的方法克服了这一代谢瓶颈,发酵生产得到了5.4 g/L的L−高丙氨酸。

图2 限速步骤调节策略的应用(a)高丝氨酸在大肠杆菌中的生产代谢途径;(b)L−精氨酸在谷氨酸棒状杆菌中的生产代谢途径;(c)5−羟基色氨酸在大肠杆菌中的生产代谢途径aspC—天冬氨酸转氨酶基因;asd—天门冬氨酸半醛脱氢酶基因;lysA—二氨基庚二酸酯脱羧酶基因;thrA—高丝氨酸脱氢酶I基因;metL—高丝氨酸脱氢酶II基因;thrBC—高丝氨酸激酶基因;metA—高丝氨酸琥珀酰转移酶基因;gdh—谷氨酸脱氢酶基因;argB—N−乙酰谷氨酸激酶基因;argC—N−乙酰−γ−谷氨酰磷酸还原酶基因;argD—乙酰鸟氨酸氨基转移酶基因;argJ—双功能鸟氨酸乙酰转移酶基因;argF—鸟氨酸氨基甲酰基转移酶基因;argG—精氨酸琥珀酸合酶基因;argH—精氨酸琥珀酸合酶基因;pntAB—膜结合转氢酶基因;ppnK—NAD+激酶基因;DNMR—二氢莫那还原酶;P4H—苯丙氨酸4−羟化酶;PCD—蝶呤4a−甲醇胺脱水酶Fig.2 Application of speed−limiting step adjustment strategy(a)the metabolic pathway of homoserine production in E.coli;(b)the metabolic pathway of L−arginine in C.glutamicum;(c)the metabolic pathway of 5−hydroxytryptophan in E.coli
胞内的氧化还原反应在氨基酸及其衍生物的生产中发挥了重要作用,当胞内还原力过低无法参与中间产物或终产物的生成反应时,会成为氨基酸合成的限速步骤,因此,增加细胞还原力以提高目标产物的生产也是常用的调控策略。L−精氨酸具有舒张因子的作用,在临床上常被用于扩张血管[43−44]。以葡萄糖为底物每生成1 mol L−精氨酸的过程中需要3 mol 辅因子NADPH,而正常的有氧呼吸产生的NADPH 不足以大量生产L−精氨酸[45],如何扩大工程菌的NADPH 池成为亟需解决的问题。Zhan 等[45]在谷氨酸棒状杆菌(C.glutamicum)中过表达了来自大肠杆菌(E.coli)的膜结合转氢酶基因pntAB,使NADP+在NADH 的还原下转化为NADPH,同时过表达了谷氨酸棒状杆菌(C.glutamicum)自身的NAD+激酶基因ppnK,使用ATP 和多聚磷酸盐作为磷酰基供体从NAD+产生NADP+,使细胞内NADPH 的含量较原始菌株提高了51%,也使L−精氨酸的生产率提高了31%,产量达到61.13 g/L[图2(b)]。类似地,1 mol L−赖氨酸的生成需要4 mol 的NADPH。在过去的研究中,主要以增加流向戊糖磷酸途径(PPP)的通量来产生更多的NADPH,而这一方法的缺陷是导致不可避免的碳损失。Bommareddy 等[46]通过蛋白质工程重新设计了来自谷氨酸棒杆菌(C. glutamicum)的3−磷酸甘油醛脱氢酶(GAPDH,由gapA 编码),通过D35G/ L36T/T37K/ P192S 的四重突变使高度NAD+特异性的脱氢酶能够以很高的亲和力与NADP+结合,该酶可通过将3−磷酸甘油醛氧化为1,3−二磷酸甘油酸酯的反应生成NADPH,极大地缓解了NADPH 缺乏的问题,使谷氨酸棒状杆菌(C.glutamicum)生产L−赖氨酸的产量与对照菌株比较提高了60%,达到8.76 g/L。
除了涉及呼吸链上的氧化还原平衡外,代谢途径中某些特殊辅酶的供应也可能成为代谢步骤的重要限速因素。Lin 等[47]在研究大肠杆菌(E.coli)体内从头合成5−羟基色氨酸(5−HTP)时发现,细菌中的几种芳香族氨基酸羟化酶不能催化L−色氨酸5位碳原子的羟基化,因此通过建立系统发育树,比对原核生物P4Hs(编码苯丙氨酸4−羟化酶)和动物芳香族氨基酸羟化酶的方法,发现来自野油菜的P4H(XcP4H)对色氨酸表现出最高的活性。在此基础上,利用蛋白质工程对XcP4H 的几个关键氨基酸残基进行了合理的改造(L98Y、Y231C、W179F),最终XcP4H 的W179F 突变体显示出更好的色氨酸选择性,但该酶需要四氢生物蝶呤BH4 作为辅酶起催化作用,由于大多数细菌中都不自然产生BH4,而BH4 再生系统需要外源表达五种酶,会加重菌体负担并带来碳损失。而四氢单胞菌素MH4 是大肠杆菌中蝶呤存在的主要形式,有研究表明MH4可代替BH4 作为XcP4H 的辅酶[48]。因此,将定向进化的XcP4H 与辅酶MH4 再生系统[phhB,来自铜绿假单胞菌(Pseudomonas aeruginosa),编码蝶呤4a−甲醇胺脱水酶PCD,负责二氢单蝶呤的再生;folM,来自大肠杆菌(E.coli),编码二氢莫那还原酶DHMR]共表达,最终实现了5−HTP 在大肠杆菌中的生物合成,5−HTP摇瓶产量达到1.11 g/L[图2(c)]。
限速步骤通常需要大量的实验数据为基础进行定位分析[49]。常用的方法包括:(1)基因组规模的代谢模型,该方法能够将代谢基因与代谢途径关联起来,为进一步研究提供更精准的预测[50];(2)同位素示踪法也是较常使用的定位限速步骤的方法,该方法在代谢组学中的应用有助于更直观地分析目标化合物的代谢通量[51];(3)DNA 微阵列研究和RNA 测序能够得到全面的转录组学数据,直观地获取相关基因表达水平的数据[52];(4)蛋白质组学分析更能代表实际的代谢活动,使人们能够理解翻译后修饰及其对代谢网络的影响[53]。目前定位限速步骤常常受限于缺乏对底盘菌株复杂调控系统的了解,或非模式生物无成熟的数据库进行组学分析,因此,对代谢网络更全面、多方位的精细研究是未来的研究热点[54−55]。另一方面,目前最常利用过表达限速酶的方法解除限速步骤或寻找催化该步骤的同工酶,但是效果有限[2,56]。因此,加强对代谢通路中的关键酶进行基础研究,利用蛋白质工程等策略从基础上提高酶的催化活性更有利于解除限速步骤[57−58]。
1.3 碳通量的调节
细胞内诸多复杂的代谢途径与目标产物代谢途径抢夺碳源导致碳流量分散,如何将碳通量尽可能多地引向目标产物,对提高产率至关重要。敲除目标产物降解途径及提高前体物质的转化率是改善目标化合物生产的有效方式[59]。Zhang 等[60]在谷氨酸棒状杆菌(C. glutamicum)生产L−鸟氨酸的研究中,为了阻止L−鸟氨酸的降解,敲除了将L−鸟氨酸转化成瓜氨酸的基因(argF),该菌株在72 h 生产了7.97 g/L L−鸟氨酸,比未敲除菌株提高了16 倍。为了增加L−鸟氨酸前体物质谷氨酸的供应,通过下调丙酮酸脱氢酶的表达,降低α−酮戊二酸向琥珀酰辅酶A 的转化,使更多的碳通量流向谷氨酸以生成目标产物,L−鸟氨酸的产量达到16 g/L[图3(a)]。Arense等[61]在大肠杆菌(E.coli)高效生产左旋肉碱的研究中,为防止主要前体物质巴豆甜菜碱经肉碱呼吸途径转化为副产物γ−丁甜菜碱,敲除了编码巴豆甜菜碱−CoA 还原酶的基因caiA,发酵培养结果显示左旋肉碱的产量提高42%,产量达到61.3 g/L,且上清液中没有检测到γ−丁甜菜碱积累,证明该策略有效地阻止了碳通量流向副产物。β−丙氨酸是自然界中发现的唯一一种β−氨基酸,是生物体中生产泛酸的主要前体。Zou 等[27]构建了从头合成β−丙氨酸的生物合成途径,通过敲除竞争性分支途径来抑制丙酮酸、乙酰辅酶A、α−酮戊二酸向其下游副产物的转化,使碳通量最大限度地集中于糖酵解和TCA 循环,以增强β−丙氨酸的前体天冬氨酸的合成,最佳生产菌株在补料分批发酵实验中可合成43.12 g/L的β−丙氨酸[图3(b)]。Rohles 等[62]在谷氨酸棒状杆菌(C.glutamicum)中异源表达了来自恶臭假单胞菌(Corynebacterium glutamicum)的基因davB(编码赖氨酸单加氧酶)和davA(编码5−氨基戊酰胺酶),实现了5−氨基戊酸酯(5−AVA)的生产,但发酵结果显示5−AVA 的产量只有12.7 g/L,并观察到少量前体物质L−赖氨酸和下游产品L−谷氨酸的大量积累。为了进一步提高产量,研究者们敲除L−赖氨酸的转运蛋白基因抑制其外排,同时还敲除了该菌内源的催化5−AVA 转化为谷氨酸半醛的5−氨基戊酸转氨酶基因(NCgl0462),该策略成功地将5−AVA 的产量提高到了28 g/L。Feng 等[63]通过在谷氨酸棒状杆菌(C. glutamicum)中引入来自球形红细菌(Rhodobacter sphaeroides)的5−氨基乙酰丙酸合酶HemA 实现了5−氨基乙酰丙酸(5−ALA)的生产,并通过敲除基因ldhA(编码L−乳酸脱氢酶)、pta(编码磷酸转乙酰酶)、pqo(编码丙酮酸盐:甲萘醌氧化还原酶)以及cat(乙酰−CoA 转移酶)消除了副产物乳酸和乙酸的产生,使5−ALA 的产量达到了1.92 g/L。在此基础上,为了进一步增加前体草酰乙酸的供应,通过过表达基因ppc(编码磷酸烯醇丙酮酸羧化酶)并敲除基因pck(编码磷酸烯醇丙酮酸羧化激酶)将5−ALA 的产量提高到了2.06 g/L。
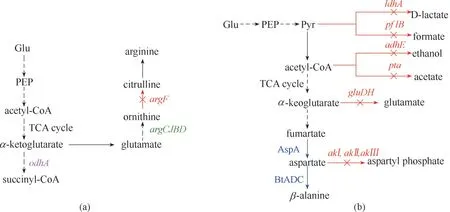
(a)L−鸟氨酸在谷氨酸棒状杆菌中的生产代谢途径;(b)β−鸟氨酸在大肠杆菌中的生产代谢途径odhA—酮戊二酸脱氢酶基因;argCJBD—精氨酸合成的操纵子基因;argF—鸟氨酸氨基甲酰基转移酶基因;标记紫色为下调基因,绿色为过表达基因,红色为被敲除基因;ldhA—D−乳酸脱氢酶基因;pflB—丙酮酸甲酸酯裂解酶基因;adhE—酒精/醛脱氢酶基因;pta—磷酸乙酰基转移酶基因;gluDH—谷氨酸脱氢酶;akI,akII和akIII—天冬氨酸激酶基因;BtADC—L−天冬氨酸α−脱羧酶;AspA—天冬氨酸酶;标记蓝色箭头表示基因图3 碳通量调节策略的应用过表达,红色箭头表示基因敲除Fig.3 Application of carbon flux regulation strategy(a)the metabolic pathway of L−ornithine in C.glutamicum;(b)production and metabolism pathway of β−ornithine in E.coli
在碳源充足的基础上,调节碳通量使更多的碳代谢流引入目标代谢途径可有效增加目标产物的得率。通过增加前体物质的供应及阻断产物的分解代谢途径等方法调节微生物细胞内的碳通量是常用的重新分配碳代谢流的方法[30,64]。但在人为引导碳通量的过程中,某些中间产物的大量积累会降低目标产物的合成效率,甚至会抑制细胞的正常生长[65−67]。因此,利用模块优化平衡碳代谢流或利用动态调控的方法实时对胞内碳流量进行动态分配成为解决该问题的常用手段。这些研究为氨基酸及其衍生物的生物合成提供了技术支持和理论支撑[68−70]。
1.4 转录调节与反馈抑制调节
在氨基酸的天然合成过程中,反馈抑制调节是细胞内重要的调节方式,可以防止细胞内碳源的不必要损失和氨基酸的过量积累。而在微生物合成氨基酸的过程中,为了实现某种氨基酸的高产则需要解除反馈抑制。因此,在改良菌株生产性能的过程中,解除代谢通路上一些关键酶的反馈抑制作用是非常有效的策略。生产芳香族氨基酸的第一步即由磷酸烯醇式丙酮酸(PEP)与4−磷酸赤藓糖(E−4P)在3−脱氧−α −阿拉伯庚酮糖−7−磷酸合酶(DAHP 合酶)的催化下生成DAHP 的反应非常关键,在酿酒酵母(Saccharomyces cerevisiae)中存在Aro4(由ARO4 编码)行使DAHP 合酶催化活性,而Aro4受到酪氨酸的反馈抑制[71],另外,中间步骤分支酸分解为邻氨基苯甲酸酯和苯甲酸酯的反应由分支酸突变酶Aro7(由ARO7 编码)催化,其中Aro7 也受到酪氨酸的抑制[72]。Luttik 等[73]利用酿酒酵母(S.cerevisiae)生产酪氨酸的研究中,通过表达经蛋白质工程改造后的两种反馈抑制酶的等位基因ARO4K229L 和ARO7G141S,解除了产物酪氨酸对起关键作用的DAHP 合酶和分支酸突变酶的反馈抑制,将酪氨酸的产量提高了3倍,达到36.2 mg/L。在大肠杆菌(E.coli)合成非天然氨基酸2−氨基丁酸的研究中[74],L−苏氨酸先经苏氨酸脱水酶(ilvA)催化生成2−酮丁酸(2−KB),再在脱氢酶的作用下生成2−氨基丁酸,而2−KB 代谢生成的副产物L−异亮氨酸对ilvA 有较强的抑制作用,苏氨酸脱水酶的5 突变体(IlvAG1054TC1055TT1084CT1085GC1086T)基因ilvA *受到的反馈抑制作用显著减弱,2−KB 的产量提高了1 倍,达到8.05 g/L,进一步表达2−酮丁酸脱氢酶后得到5.39 g/L的2−氨基丁酸[图4(a)]。Park等[75]在利用谷氨酸棒状杆菌(C. glutamicum)生产L−精氨酸的研究中发现,当细胞内L−精氨酸的浓度超过阈值后,精氨酸阻遏物ArgR(由argR 编码)会与arg 操纵子结合抑制L−精氨酸的生物合成[76],而脂肪酰基响应调节子FarR 则会抑制精氨酸合成基因簇argBCGH 以及谷氨酸脱氢酶基因gdh 的表达,从而对L−精氨酸的生物合成产生负调控作用。因此,在同时敲除调控基因argR 和farR,解除负调控作用的菌株的分批补料发酵中,L−精氨酸产量达到61.9 g/L,与对照菌株相比,产量提高了120%。在L−亮氨酸生产过程中,第一步反应是2−酮异戊酸和乙酰辅酶A 在苹果酸2−异丙基苹果酸合酶IPMS 催化(由leuA 编码)下转化为2−异丙基苹果酸和CoA,其中,基因leuA 的表达受到L−亮氨酸的反馈抑制。为了实现L−亮氨酸的高效生产,Vogt 等[22]通过基因工程定点突变了IPMS中的两个氨基酸(G1586A,G1595A),突变菌株B018中的leuA 基因表达的蛋白酶催化能力未受影响,但不再受到L−亮氨酸的反馈抑制。另外转录调节子LtbR 在L−亮氨酸浓度较高的情况下会抑制基因leuCD(编码3−异丙基苹果酸脱水酶)和基因leuB(编码L−亮氨酸合成酶)的表达。通过解除leuA 受到的反馈抑制作用和敲除转录调节子基因ltbR,工程菌中L−亮氨酸产量达到5.7 g/L,较野生型菌株产量增加了10%[图4(b)]。Ding 等[77]研究了全局调控因子(ArcA、Cra、IclR)和L−苏氨酸内转蛋白TdcC(由tdcC 编码)在大肠杆菌高效合成L−苏氨酸中的作用,全局调节剂ArcA 在葡萄糖充足的条件下对有氧TCA 循环中基因的表达具有抑制作用,cra 的过表达可明显增加葡萄糖的消耗,而cra 的缺失并不能提高葡萄糖的消耗速率,iclR 的缺失可以激活乙醛酸分流,促使更多的草酰乙酸可以转化为L−苏氨酸,在分批补料培养中突变体TWF018(ΔarcAΔiclRΔtdcC)得到了最高的苏氨酸产量达到26.0 g/L,相对于原始菌株增加了109.7%。
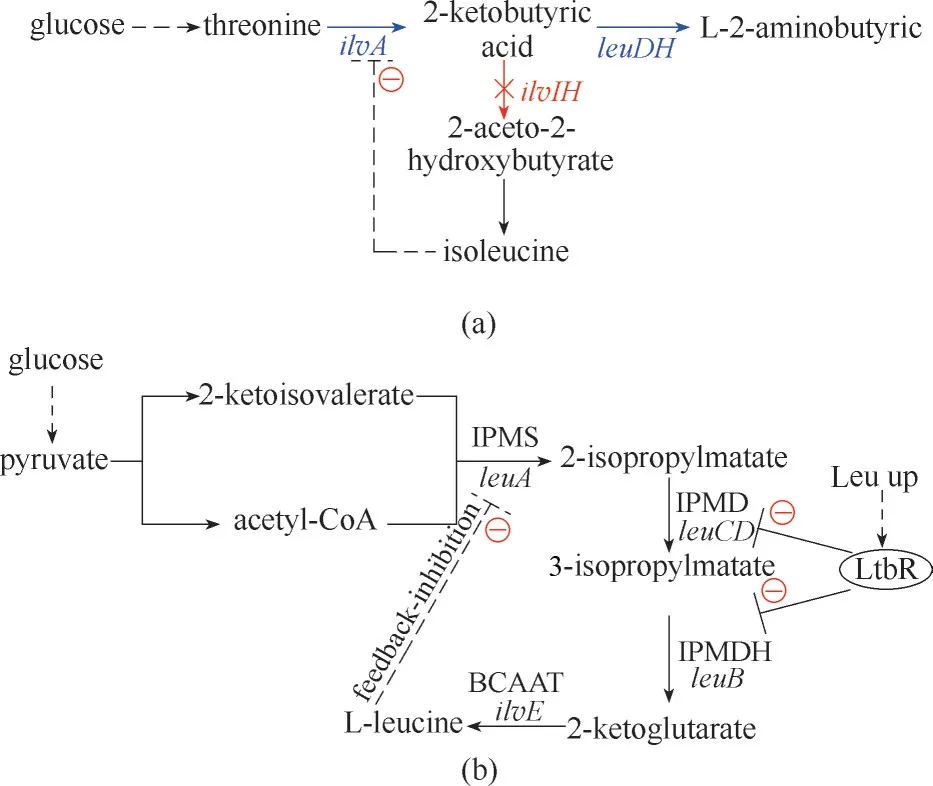
(a)2−氨基丁酸在大肠杆菌中的生产代谢途径;(b)L−亮氨酸在谷氨酸棒状杆菌中的生产代谢途径ilvA—苏氨酸脱水酶基因;ilvIH—乙酰羟酸合酶Ⅲ基因;leuDH—2−酮丁酸脱氢酶基因;减号表示受到抑制,虚线表示反馈抑制,标记蓝色箭头表示过表达;leuA—2−异丙基苹果酸合酶(IPMS)基因;leuCD—3−异丙基苹果酸脱水酶(IPMD)基因;leuB—3−异丙基苹果酸脱氢酶(IPMDH)基因;ilvE—支链氨基酸转氨酶(BCAAT)基因Fig.4 Application of transcription regulation and feedback inhibition regulation strategies(a)the metabolic pathway of 2−aminobutyric acid in E.coli;(b)L−leucine production and metabolic pathways in C.glutamicum图4 转录调节与反馈抑制调节策略的应用
综上所述,代谢网络中的调控因子对产物的高效生产起到重要的作用,但调控因子的作用机制较为复杂,有些调控因子可同时对同一个代谢途径的多个基因的表达产生干预,如酪氨酸对DAHP 合酶及分支酸变位酶均有抑制作用,L−蛋氨酸合成途径上的转录阻遏物MetJ 对上游中间代谢途径的抑制[73,78];有些调控因子同时控制多个代谢途径的表达和调控,如抗生素抗性调节剂、乳糖阻遏蛋白和λ阻遏物等对多个代谢途径的调节[79−81];而有些基因的表达则受多个调控因子的共同干预[82−83]。因此,需要对代谢网络进行全面的了解和分析。随着转录组学、代谢组学和蛋白质组学等研究的不断进展,数据库的不断完善,将为转录和反馈抑制调节提供更准确的数据,从而更精确地对代谢网络进行干预和调控。
1.5 转运系统的调节
理想的发酵产品是能够在胞内源源不断地生产目标物质并及时排出到培养基中,以方便进行后续的分离纯化工作。但存在一些产物被生产并排出细胞后,能被工程菌重吸收到胞内或产物转运外排能力较弱导致的胞内积累问题。解决胞内积累问题不仅可以缓解反馈抑制,还可以降低产物产生细胞毒性,减少后续分离纯化步骤。因此,对于细胞转运产物的研究极为重要。Yin 等[84]发现外排蛋白对L−异亮氨酸的高效生产有着十分重要的作用,外排蛋白BrnFE 的过表达能够有效提升L−异亮氨酸的产量,来源于谷氨酸棒状杆菌(C. glutamicum)的全局调节因子Lrp 能够激活谷氨酸棒状杆菌(C.glutamicum)中BrnFE 的表达,共表达lrp 和brnFE 的菌株在经过72 h 发酵后,L−异亮氨酸的产量达到了26.8 g/L,与初始菌株相比产量提高了63%,但是由于BrnFE 不具特异性,对L−缬氨酸、L−亮氨酸和L−蛋氨酸三种支链氨基酸(BCAA)均有外排作用,因此也增加副产物的量。Li等[41]发现高浓度的胞内高丝氨酸积累会给细胞生长带来负担,通过过表达高丝氨酸外排蛋白的编码基因rhtA以及敲除基因tdcC(编码一种转运蛋白能够摄取胞外高丝氨酸)可使胞内高丝氨酸浓度保持在较低水平,大大降低了高丝氨酸对细胞生长的抑制,从而显著提高了目标产物的产量,最终在分批补料发酵中生产了39.54 g/L的高丝氨酸。L−半胱氨酸是一种含硫氨基酸,在制药、化妆品、动物饲料添加剂等领域有着广泛地应用,也在提高动物的免疫调节及促进动物生长发育方面起着重要作用[85]。但较高浓度的L−半胱氨酸可引发细胞内DNA 的氧化损伤,从而抑制细胞的正常生长[86],为了将产生的L−半胱氨酸及时排出胞外以减少对细胞的毒性,Wei 等[87]在谷氨酸棒状杆菌(C. glutamicum)中分别表达了来自大肠杆菌(E.coli)及菠萝假单胞菌(Pantoea ananatis)的L−半胱氨酸外转蛋白Bcr和CefA,发酵结果显示过表达Bcr的菌株L−半胱氨酸的产量最高,达到634.4 mg/L,比未表达转运蛋白的菌株产量提高了88.9%。在从头合成L−蛋氨酸的研究中,通过过表达L−蛋氨酸转运蛋白基因yjeH 以增强细胞对L−蛋氨酸的外排作用,将L−蛋氨酸的产量从202.64 mg/L 提高到413.16 mg/L。在此基础上,通过敲除L−蛋氨酸的内转蛋白MetD 基因阻止了L−蛋氨酸的重新摄入,进一步使L−蛋氨酸的产量增加到593.5 mg/L[78]。Lubitz等[88]发现外排蛋白LysE对L−瓜氨酸的积累有重要影响,与原始菌株相比,过表达lysE 基因使L−瓜氨酸的产量提高了45%,达到21 g/L,而lysE 的缺失菌株中L−瓜氨酸的产量减少了1 半,因此过表达lysE 是提高L−瓜氨酸产量的有效策略。Simic 等[89]发现过表达L−苏氨酸外排蛋白基因thrE 的发酵液中积累了8.1g/L 的L−苏氨酸,相对于未过表达thrE菌株产量提高了40%。
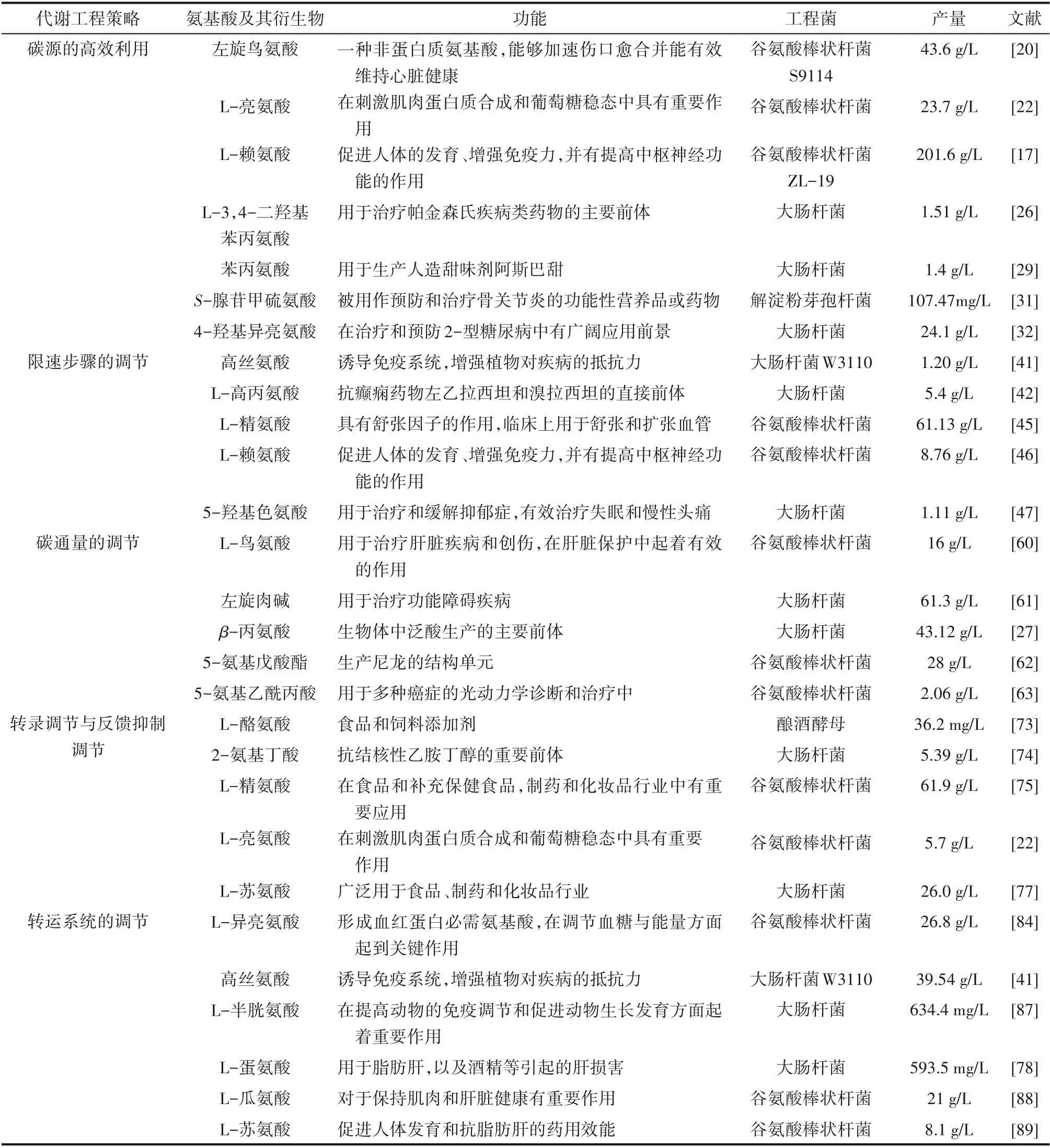
表1 本文涉及到的氨基酸及其衍生物摘要Table 1 Summary of amino acids and their derivatives involved in this article
在菌株的优化策略中,中间体及目标产物转运的调控方法已经越来越广泛地被用于改善目标产物的生产,主要包括增加底物的摄入、减少中间体的外排流失、减少对产物的再摄取以及增加产物的外排几方面[90]。但由于一些转运蛋白的底物特异性不强,在外排目标产物的同时也导致其他副产物的外排,不仅分散了碳流,也为后续分离纯化增加难度。如果通过合理的蛋白质工程改造或挖掘更多的特异性转运蛋白,有望能够克服这些问题,将为目标氨基酸及其衍生物产量的提高作出更大贡献。
本文涉及到的氨基酸及其衍生物汇总于表1。
2 展 望
随着市场对氨基酸及其衍生物需求的不断增长,氨基酸生产市场的竞争将日趋激烈,如何降低成本且提高产能是科研工作者不断努力的方向。将微生物细胞作为平台来生产氨基酸及其衍生物,顺应了可持续发展的大趋势,也是一种有望代替化学法利用石油等不可再生资源的有前途的生产方式。大量科学研究已经证实通过构建微生物细胞工厂可实现多种氨基酸及其衍生物的生物合成。然而,目前大部分氨基酸及其衍生物如L−茶氨酸、γ−氨基丁酸等产品的微生物合成尚未实现工业化大规模生产。产量、产率和转化率是决定微生物细胞工厂能否实现工业化应用的关键。在细胞生长最小化,产物合成最大化的原则上,设计最优的生物合成途径,避免副产物的积累,平衡合成过程中碳源、能量和还原力的供给,可显著提高微生物细胞工厂的合成效率。随着组学分析数据库的不断扩大,代谢网络集成式、模块化的高效运行策略的发展[91−92],以及近年来新开发的核糖开关[93]、生物传感器、CRISPR 基因编辑和RNA 干扰等技术为利用不同的代谢调控策略对底盘菌株进行改造提供了更精准、更先进的方法[94]。相信在不断丰富和发展的系统合成生物学领域,人工构建的特定化工程生产菌株将克服更多的自然壁垒,将传统的氨基酸生产扩展到更多具有潜在价值的氨基酸衍生物方向上来,实现更广泛的应用并创造更大的价值[95]。
