低温水等离子体活化和表面接枝DMAE聚氯乙烯中空纤维膜研究
2020-09-29王明兴赵欣王涛路姣姣赵之平
王明兴,赵欣,王涛,路姣姣,赵之平
(北京理工大学化学与化工学院,北京102488)
引 言
超滤膜分离技术因其优异的分离效率、节能、经济等优势,已成功应用于饮用水净化领域[1]。然而,由于超滤膜滋生细菌,易导致饮水安全问题,引起人们的关注。目前,聚氯乙烯(PVC)以其优异的热稳定性、物化稳定性能已成为超滤膜制备领域中具有较好发展潜力的聚合物原材料[2],通常借助非溶剂致相分离法利用PVC 材料制备中空纤维超滤膜,但PVC 材料疏水且表面能较低,易受到生物污染和细菌侵蚀,在膜生物反应器中尤为明显[3]。经过长期运行,细菌与微生物会在膜表面及孔道内吸附沉积,降低了膜的分离效率和使用寿命,同时引起了水质安全问题[4]。因此迫切需要寻求PVC 膜材料的抗菌改性技术。
近年来,研究主要集中在通过优化膜的物理化学性质来提高膜的抗菌性能,方法主要包括浸覆法、共混法、共聚反应及接枝聚合等。Wang等[5]采用浸涂工艺,在聚(乙烯对苯二甲酸乙二醇酯)上涂覆壳聚糖/聚乙烯吡咯烷酮,获得了具有优异抗革兰氏阴性大肠杆菌和金黄色葡萄球菌的膜材料。Waheed等[6]通过将壳聚糖与醋酸纤维素和聚乙二醇共混的方式,成功获得了具有优异抗菌活性的共混膜材料。Zhu 等[7]借助异氟尔酮二异氰酸酯与聚乙二醇的预聚反应以及与咪唑啉基离子二醇的聚合链延长反应制得抗菌膜,该膜材料对于革兰氏菌的抗菌率提高至60%。Kaner 等[8]利用AgCl/TiO2干凝胶对聚醚砜膜外皮层进行改性,结果发现复合纳米材料的引入有效抑制了膜表面细菌的生长。Luo等[9]通过多巴胺自聚合将低聚壳聚糖沉积在聚氨酯膜表面,显著提高了膜的抗革兰氏菌及金黄色葡萄球菌能力。此外,为了进一步阻止生物膜的形成,也会采用银纳米粒子(AgNPs)构建抗菌层来提升材料的抗菌能力[10−12]。尽管上述方法提升了膜的抗菌性能,但也存在一些不足:①工艺复杂,耗时;②与功能过滤材料或聚合物膜材料的相容性较差;③使用大量溶剂。这些都严重限制了抗菌方法的应用推广。
近来,采用辐照方法改性膜表面或膜孔内物理结构及化学组成的新方法引起了研究者们的关注。Mural等[13]将聚烯烃多孔材料浸涂壳聚糖醋酸溶液,然后采用紫外臭氧辐照改性,材料对革兰氏菌和金黄色葡萄球菌的抗菌率分别达到90%和94%,同时膜的纯水通量也得到明显提升。Mauter 等[14]借助氧等离子体辐照技术,将聚砜膜与包覆银纳米粒子的聚乙烯亚胺反应,通过共价键和静电作用力获得了永久改性膜。辐照改性技术为本体材料与功能聚合物或单体之间提供了干燥无毒的反应环境,能够有效实现共价键或离子键的成功嫁接[15−16]。然而这些改性研究由于反应条件限制,目前还停留在实验室阶段,因此,迫切需要将这些改性技术扩大至工业化规模应用。
在辐照改性技术中,本研究团队在前期研究工作[17−19]中提出了一种长距离动态低温等离子体接枝改性技术(LDDLT)。通过等离子体流激活,膜的表面或孔道内会产生自由基及氧自由基,在有效提升膜的亲水性能基础上,能够为聚合物单体提供接枝位点,通过这种化学键结合的改性方式,能够有效保证改性膜的稳定性及耐用性能。Li 等[19]通过LDDLT 技术,在聚乙烯膜表面构建了一层高密度均一抗菌层,提升了膜的水通量,同时将抗菌效率提高至92.4%,膜的表面也没有发生明显的刻蚀损伤。Zhao 等[18]通过氩等离子体制备了聚丙烯酸膜,膜的通量从732提高至1763 kg∙m−2∙h−1,同时对牛血清蛋白(BSA)吸附率下降67%。基于以上方法的可操作性,通过合理的设计,以低温等离子体技术将聚合物功能单体接枝到膜上,可以实现以组件的形式进行膜结构和性质的改性。
另外,抗菌介质对于膜材料抗菌性能的提高也至关重要。适宜的抗菌介质能够有效防止细菌在膜表面的吸附生长,抑制生物膜的形成。Yao 等[20]通过氩等离子体预处理PVDF 中空纤维膜,并借助紫外诱发接枝聚合技术,成功将聚(4−乙烯基−N−吡啶溴化盐)接枝到聚合物膜上,所制备的改性膜表现出优异的抗金黄色葡萄球菌和和大肠杆菌能力。Mei等[21]将聚丙烯腈膜预处理之后,与聚六亚甲基盐酸胍反应提高了聚丙烯腈膜的抗菌活性。Gao 等[22]通过紫外辅助接枝聚合反应,将N-(3−叔丁基−2−羟基−5−甲苄基)丙烯酰胺成功接枝到聚砜超滤膜表面,获得了抗BSA 生物污染的膜材料。然而,上述抗菌介质存在一些不足:①成本较高;②制备过程复杂。相较于以上介质,季铵盐类(QAS)物质凭借其自身抗菌能力、环境友好及对聚合物膜无腐蚀的优势,已在膜材料抗菌改性中得到应用[23]。Asri等[24]将季铵盐接枝到超支化聚脲上形成抗菌涂层,所获得的膜材料抗菌率达到99.99%。Poverenov 等[25]将季铵盐共价接枝到聚乙烯醇、纤维素及玻璃表面,产品对于多种细菌都表现出了优异的抗菌性能。
综上,本研究选取三通道PVC 中空纤维膜组件为改性载体,甲基丙烯氧基苄基二甲基氯化铵(DMAE)为抗菌单体,通过低温水等离子体技术对膜进行活化,将DMAE 接枝共聚于膜表面,获得具有抑菌抗污染的PVC 中空纤维膜,系统考察等离子体活化膜及接枝膜的渗透性能、力学性能、亲水性能,并研究等离子体活化膜组件对BSA 的耐污性能。同时采用动态和静态的抗菌实验,考察接枝聚合物膜组件杀灭及抑制大肠杆菌的能力。该膜表面修饰工程技术具有简便、易操作、成本低的优势,对于饮用水处理领域膜技术及组件的发展具有重要的现实意义。
1 实验材料和方法
1.1 材料
甲基丙烯氧基苄基二甲基氯化铵(DMAE)的合成参照Lu 等[26]的研究工作。三通道PVC 中空纤维膜从中水源膜科技有限公司购买;氢氧化钠、氯化钠、乙醇、过硫酸钾购自北京化学试剂公司;高纯N2(>99.99%)购自北京永腾气体公司;蛋白胨、酵母提取物及琼脂购自孟益美生物科技公司;革兰氏菌Escherichia coli(E.coli, DH5α)和牛血清蛋白(BSA)由北京理工大学生物工程实验室提供;去离子水由艾科浦纯水仪提供。

图1 等离子体装置示意图Fig.1 Scheme of plasma setup
1.2 膜改性
将PVC 膜裁剪为25 cm 长并装填制作为膜组件,之后将组件浸泡在去离子水中直至膜被充分浸润。之后取出膜组件用等离子体激活处理,具体步骤参照之前研究[19,27]。如图1 所示,中空纤维膜组件用放电线圈均匀缠绕,在室温条件下,通过真空泵确保组件内的压力保持在30~40 Pa。在低压环境下,膜内的水蒸气从中空纤维膜内蒸发,同时膜组件用等离子体照射2~3 min,其中放电功率设定为40~80 W。
接枝聚合步骤参照之前的研究工作[19]。首先,配制浓度为4.0%(质量)的DMAE 单体和0.2%(质量)K2S2O8的混合水溶液,并用N2净化30 min 以除去其中的溶解氧,之后在60℃温度下,用蠕动泵将以上混合溶液泵入膜组件内循环2 h 后,用50%乙醇溶液替换接枝溶液循环清洗4 h,以确保洗净组件内残留未反应单体及产生的低聚物。最后,用去离子水冲洗组件,并放入真空干燥箱中充分干燥6 h,室温保存备用。通过水等离子体处理的膜及接枝聚合物膜分别命名为PVC−ir−H2O和PVC-g-DMAE。
1.3 膜表征
膜的微观结构形貌采用扫描电子显微镜(scanning electron microscopy,SEM)观测(JEOL JSM 6301 F 型,日本JEOL Ltd 公司)。样品断面经液氮淬断,烘干后黏贴至专用电镜样品台,喷金后观测形貌。
等离子体辐照对膜材料的影响用膜的亲水性表征,通过接触角测量仪,OCA−15E 型,德国DataPhysics Instruments GmbH 公司,测试膜表面的静态接触角数值来评测膜的亲疏水性。室温下,将1 μl 的去离子水滴至膜表面,计时10 s 后采集图形并用接触角测量软件(SCA20−U)计算接触角,每个样品测定3个位置取平均值。
膜的化学组成表征用傅里叶红外光谱仪(ATR−FTIR),Nicolet 380 型,美国Madisnn 公司。光谱扫描范围为400~4000 cm−1,样品测试分辨率为4 cm−1,扫描16次。
膜的机械强度测试通过材料拉伸仪,CMT−6203型,中国深圳Sanshi material detection 公司。膜样品先干燥并裁剪为100 mm 长,拉伸速率设定为10 mm·min−1。
膜的孔径表征基于泡点法测试原理,通过孔径分析仪测试,3H−2000PB 型,中国Beishide 公司,膜样品先用浸润液(表面张力=16 dyn·cm−1)充分浸润,并用N2(>99.99%)为吹扫气体,设定气体流速为0.001 L·min−1。
1.4 膜的通量测试
膜的渗透通量采用自制的死端过滤装置进行测试[27]。首先,将膜组件在温度为(20±2)℃,压力为0.12 MPa 下预压30 min 后再进行测试,以确保通量稳定。然后,于0.1 MPa 下测定膜的渗透通量,每隔5 min 取样一次。膜的渗透通量(J,kg∙m−2∙h−1)计算公式如下:

每个样品渗透通量测量三次取平均值,标准偏差为±5%。
1.5 膜的抗污染性能测试
1.5.1 BSA 吸附实验 等离子体处理的PVC 膜对BSA的抗污染性能通过静态吸附实验测定。膜裁剪为1.0 cm 长,浸入无水乙醇30 min,之后将膜样品分别放入不同浓度的BSA 溶液中(0.4、0.8、1.0、1.6、2.0 g∙L−1),37℃下振荡24 h 以达到吸附平衡。BSA 溶液吸光度用UV 分光光度计(UNIC−4802, UV/VIS,Double beam,上海尤尼柯)波长280 nm 测量,BSA 在膜表面的吸附量为吸附前后吸光度的差值。
1.5.2 BSA 过滤实验 BSA 过滤实验通过错流过滤装置测定。其中BSA 浓度为1 g∙L−1,测试压力为0.1 MPa,温度为(20±2)℃。PVC−ir−H2O 膜的截留率通过BSA 的吸光度进行计算,截留率(R,%)计算公式如下:

每次实验后,膜组件依次用NaOH(0.05 mol∙L−1)和去离子水清洗15 min。
1.6 膜的抗菌性能测试
1.6.1 静态接触抗菌实验 PVC-g-DMAE 膜对革兰氏阴性大肠杆菌(E. coli)的抗菌性能利用表面涂布法测试[21,28]。膜被裁剪为6 cm 长并放入装有5 ml E.coli悬浊液(105 CFU∙ml−1)的锥形瓶中,置于37℃、170 r∙min−1的恒温培养箱中。固定时间间隔,用移液器取100 μl 细菌悬浊液经无菌水稀释。然后取100 μl 稀释液铺展在Luria−Bertani(LB)培养板(含10 g∙L−1蛋白胨,10 g∙L−1NaCl,5 g∙L−1酵母提取物,20 g∙L−1琼脂,在pH=7.2,121℃杀菌处理20 min)。之后将培养板放入恒温培养箱中,经37℃培养24 h。最后,培养板上的活菌数量以菌落形成单位(CFU∙ml−1)表示。将无膜条件下,完全相同培养方法的对照菌悬浊液作为对比。为考察抗菌性能稳定性,开展三次抗菌测试重复实验,误差不超过5%。每次试验后,膜样品依次用NaOH 溶液和无菌水冲洗3 次,每次20 min。
膜的抗菌活性定量测试用杀菌率(B,%)表示,如式(3):

1.6.2 动态过滤抗菌实验 原膜和PVC-g-DMAE膜抗菌实验采用自制错流动态过滤装置如图2所示。
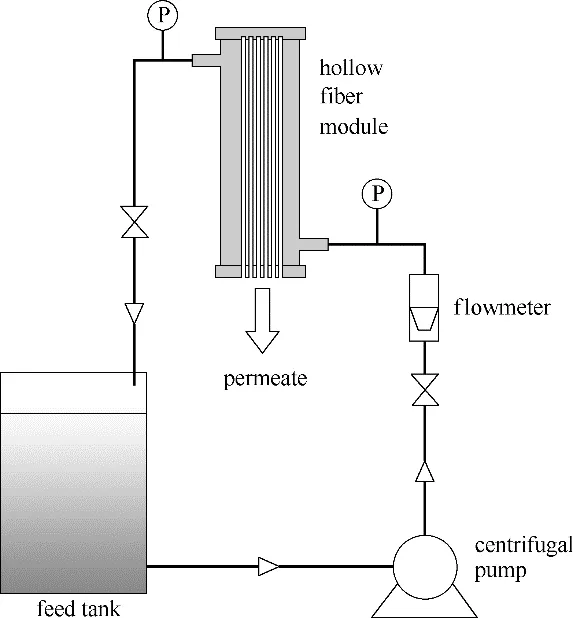
图2 膜动态过滤抗菌实验装置示意图Fig.2 The membrane filtration setup of dynamic filtration antibacterial experiment
整个过滤装置用75%乙醇和去离子水消毒三次。然后将膜组件固定在过滤系统中,接下来含E.coli 的悬浊液(103 CFU∙ml−1)泵入膜组件中,在0.1 MPa、(25±3)℃下,运行1 h。收集渗透溶液计算通量并将渗透液倒回料液罐。在实验中,料液罐用保鲜膜密封,以避免空气中的细菌进入。料液槽内的活菌利用表面涂布方法表征。每次试验后,膜组件都用无菌水清洗三次以备下次使用。每次实验使用的大肠杆菌E.coli 悬浊液均为新配置,膜动态过滤抗菌实验杀菌率计算公式与静态接触抗菌实验相同,均采用式(3)计算杀菌率,组件的动态抗菌实验重复6次。
2 实验结果与讨论
2.1 等离子体活化对膜表面亲水性的影响
PVC 中空纤维膜组件用水等离子体辐照活化,会在膜外表面产生极性官能团,活化条件对膜的理化性质及下一步的接枝聚合至关重要[17]。因此水等离子体的功率及辐照时间对膜亲水性的影响需要系统研究。
2.1.1 等离子体功率对膜亲水性的影响 PVC 中空纤维膜组件通过不同功率的水等离子体活化2 min。如图3 所示,随着辐照功率由0 增加至40 W,膜外表面的接触角由90°降低至55.8°。这可能是由于随辐照能量的增加,膜中的水被蒸发并电离,从而使其表面产生更多的自由基和氧自由基,提升膜的亲水性[29]。当辐照功率从40 W 增加至80 W 时,其接触角会有回升趋势,可能是由于辐照能量过高,超过内部化学键能,使聚氯乙烯膜发生交联和刻蚀的副作用[30]。因此最佳等离子体功率为40 W。
2.1.2 辐照时间对膜亲水性的影响 辐照时间对膜接触角的影响如图4 所示。当辐照时间为2 min时,膜的接触角为55.8°,比原膜降低34.2°,这种亲水性的改善得益于辐照时间的延长提升了等离子体的能量和密度,从而增加了极性基团。然而,随辐照时间的延长,接触角会升高。这可能是由于合成和终止反应会消耗极性基团,导致亲水性降低[31]。因此,最佳的辐照时间为2 min。
2.2 膜的物化性质表征结果分析

图3 等离子体功率对PVC中空纤维膜接触角的影响Fig.3 The effect of H2O plasma power on water contact angle of PVC hollow fiber membrane
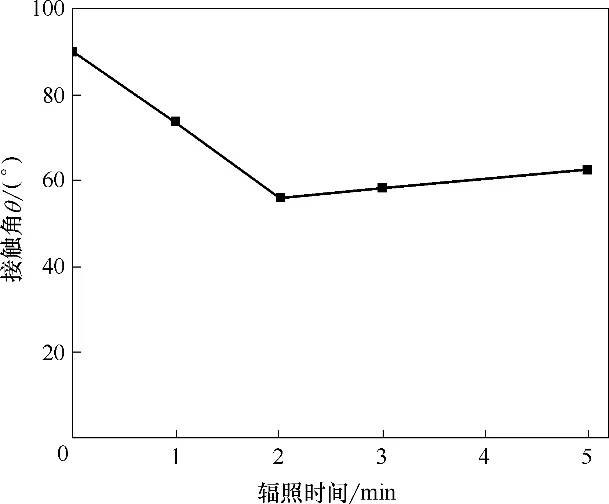
图4 水等离子辐照时间对中空纤维膜接触角的影响Fig.4 The effects of H2O plasma irradiation time on water contact angle of PVC hollow fiber membrane
2.2.1 膜的微观结构分析 图5给出了PVC三通道中空纤维膜的扫描电镜图,从图中可以看出,PVC中空纤维膜的外径尺寸在3 mm左右,其内部孔道直径在0.7 mm 左右,三通道的尺寸均一,且断面呈现指状孔结构,该结构特征是相转化过程中,溶剂与非溶剂发生液−液瞬时相分离形成的。断面丰富的指状孔结构可以为膜过滤提供快速传质通道,有利于等离子体活化过程中水蒸气从膜内挥发,同时利于膜在应用过程中渗透性能的保证。
2.2.2 亲水性分析 图6 给出了PVC、PVC−ir−H2O和PVC-g-DMAE三种膜在不同位置接触角的变化。可以看出PVC 原膜的接触角在88°至81°之间,经水等离子体活化后的膜接触角在52°至58°之间,由此可知辐照后的膜表面比较均一。这种亲水性的改善主要由于等离子体处理后,膜表面产生大量极性自由基,经空气暴露后,自由基转变为氧自由基,如—ROOH 和—ROOR。PVC-g-DMAE 接触角为45°,比原膜减小40°,这主要是由于DMAE 中含有极性官能团—O—C O 和N+[19]。由此证明三通道PVC膜表面亲水性显著提高。

图5 三通道PVC中空纤维膜的扫描电镜图Fig.5 SEM images of PVC hollow fiber membrane

图6 不同组件内膜的接触角随距组件入口距离的变化Fig.6 Dependence of the contact angle of outer surface of membrane on the distance from module inlet for different membrane modules

图7 膜的红外谱图Fig.7 ATR−FTIR spectra of membranes
2.2.3 ATR−FTIR 分析 PVC 膜、PVC−ir−H2O 膜和PVC-g-DMAE 膜的红外分析如图7 所示。图7 中PVC 膜 的680 cm−1为—C—Cl 伸 缩 振 动 峰,1432、1362 和1315 cm−1为—CH2—CH3的 振 动 峰[2]。相 较于PVC 原膜,PVC−ir−H2O 膜在3500 cm−1的—OH 峰更强,这主要是由于水等离子体的活化引起的。接枝DMAE 后,在1610~1650 cm−1出现了—C—N 伸缩振动峰,表明PVC-g-DMAE 膜中出现了胺基官能团[32]。另外在1500~1450 cm−1和809~865 cm−1处出现了苯环中的—C C 和—C—H 特征峰[33],以上数据表明通过水等离子体活化,在膜表面接枝含C C单体经自由基引发接枝聚合反应,使得DMAE 抗菌单体成功接枝到PVC中空纤维膜上。
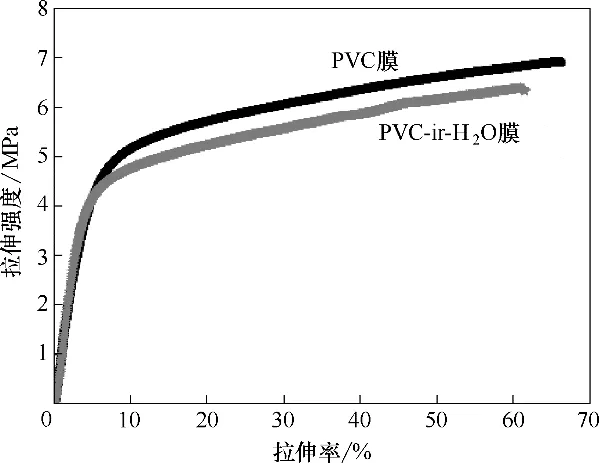
图8 PVC膜和PVC−ir−H2O膜的应力变化曲线Fig.8 Stress−strain curves of original PVC membrane and PVC−ir−H2O
2.2.4 力学性能分析 实际应用中,膜的寿命与膜的机械强度密切相关。图8 给出了PVC 膜和PVC−ir−H2O 膜的应力变化曲线。PVC−ir−H2O 膜的最大拉伸率和强度均低于PVC 膜,主要由于水等离子体活化会对膜造成轻微的蚀刻和降解作用,但活化膜的最大拉伸率和最高强度,相较于PVC 原膜,降低幅度分别在7.1%和5.6%,在可接受范围内。此外,需要说明的是,膜的强度主要是由膜主体材料本身所决定的,如果等离子体处理不当,会对膜表面产生损伤,本研究证实,通过控制等离子体辐照工艺参数,使其辐照强度在适当范围内,不会对PVC 膜产生较大的损伤或蚀刻。而在进一步接枝DMAE单体过程中,由于接枝反应的环境是低浓度单体水溶液,对膜机械强度的不利影响甚微,因此PVC-g-DMAE 膜 的 拉 伸 率 和 强 度 与PVC−ir−H2O 的 趋 势一致。
2.2.5 孔结构分析 为了研究等离子体处理对膜结构的影响,采用泡压法分析了三种膜的孔径,如图9所示。从图中可以看出,因改性的蚀刻影响,导致改性后膜的孔径均有一定程度的增加,但增加幅度较小,同时由于接枝DMAE 单体会造成膜的孔径有所减小,但由于单体的分子量较小,对膜孔径并没有造成大的影响。而对于孔径偏移较大方向的孔结构变化有可能是由于所采用的PVC 膜具有三通道的结构特征,因此膜在制备过程中其孔径结构的稳定性与均一性难以完全保持一致,从而使得原膜孔径分布较宽,当接枝后,由于新结构的引入和膜自身的一些差异性,相应的孔径尺寸变化范围也会较宽,因此可以认为是由于膜自身差异以及实验误差共同导致的。由此可知,经过水等离子体活化及聚合接枝反应,膜的孔道结构特征并没有发生大的损伤或修补变化,对孔径的变化影响较小。
2.3 膜的渗透性能分析

图9 PVC膜、PVC−ir−H2O膜和PVC-g-DMAE膜的孔径分布图Fig.9 Pore size distributions of the original PVC membrane,PVC−ir−H2O and PVC-g-DMAE
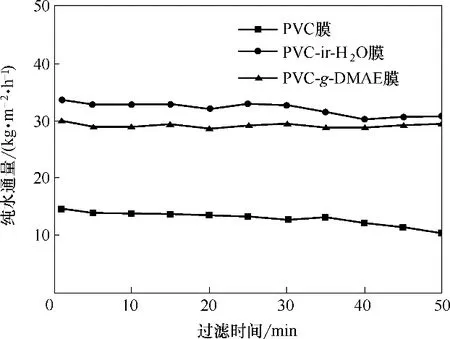
图10 PVC膜、PVC−ir−H2O膜和PVC-g-DMAE膜的纯水通量Fig.10 Pure water fluxes of PVC membrane,PVC−ir−H2O membrane and PVC-g-DMAE membrane
如图10 所示,原膜组件的纯水通量在10~15 kg∙m−2∙h−1,PVC−ir−H2O 和PVC-g-DMAE 膜的纯水通量得到显著提高,主要是由于膜的亲水性和孔径增大有关。其中,在最初的30 min内PVC−ir−H2O膜的通量为34 kg∙m−2∙h−1,之后通量有所下降,其原因可能是过氧化反应消耗了极性自由基。PVC-g-DMAE 膜的通量为30 kg∙m−2∙h−1,是原膜的2 倍以上。由于PVC 膜和PVC-g-DMAE 膜孔径相差不大(图9),因此改性膜的亲水性提高是膜通量增加的主要原因。
理论上讲,基于杨氏−Laplace 方程(R=4γcosθ/ΔP)[34],接触角(θ)降低会导致渗透压降低,从而提高膜的水通量。总之,等离子体活化和接枝聚合方法能够有效提高PVC膜的渗透通量。
2.4 膜的抗污染性能分析

图11 BSA溶液浓度变化对PVC膜和PVC−ir−H2O膜蛋白吸附量的影响Fig.11 Anti−adhesion efficacy of PVC and PVC−ir−H2O in contact with different concentration of BSA solution
2.4.1 BSA吸附性能分析 蛋白质吸附是膜污染的重要现象。图11 给出了PVC 膜和PVC−ir−H2O 膜的吸附数值,如图可知,随BSA 溶液浓度由0.5 g∙L−1提高至1.0 g∙L−1,PVC 膜对BSA 的吸附量由35 mg∙g−1上升至120 mg∙g−1,继续提高BSA 浓度至2.0 g∙L−1,吸附量增至150 mg∙g−1。当BSA 溶液浓度由0.4 g∙L−1提高至2.0 g∙L−1时,PVC−ir−H2O 膜对BSA 的吸附量由28 mg∙g−1增至57 mg∙g−1,其吸附量较原膜降低了70%。膜的抗蛋白吸附能力的提高主要是由于膜表面亲水性得到了较大改善[35],从接触角数据中可以判定出,经过等离子体活化以及接枝后,膜的亲水性均得到了较大改善,并且接枝后的亲水性更好,因此,膜的抗污染性通过对比活化前后的膜可以有效证明水等离子体活化能够有效防止蛋白吸附,从而提高PVC膜的抗污染性能。
2.4.2 BSA 溶液过滤及分离性能分析 PVC 膜和PVC−ir−H2O 膜对牛血清蛋白的截留率如图12 所示。PVC 原膜对BSA 的截留率随过滤时间的增加由85%提高至95%,主要是由于BSA 蛋白吸附在膜表面形成滤饼层所致。对于PVC−ir−H2O膜,随过滤时间的延长,其截留率变化与PVC 基本一致。由此可知,等离子体活化不会对膜的BSA 截留性能产生较大影响。
同时,对比了PVC 膜和PVC−ir−H2O 膜三次过滤BSA 溶液的通量差别,如图13,结果表明PVC−ir−H2O 膜对BSA 溶液过滤3 次的渗透通量均高于PVC原膜通量。这归因于PVC−ir−H2O膜亲水性的提高,延缓了BSA 溶液的吸附,降低了传质阻力,有利于膜通量提高[36]。然而随着过滤实验次数的增加,PVC−ir−H2O 膜通量有所降低。其原因主要是膜遭受了不可逆转的污染,膜表面及膜孔内浸入大量BSA 分子,另外一方面也是由于等离子体活化产生的小分子氧化物附着于膜表面,易于被冲刷下来[37]。
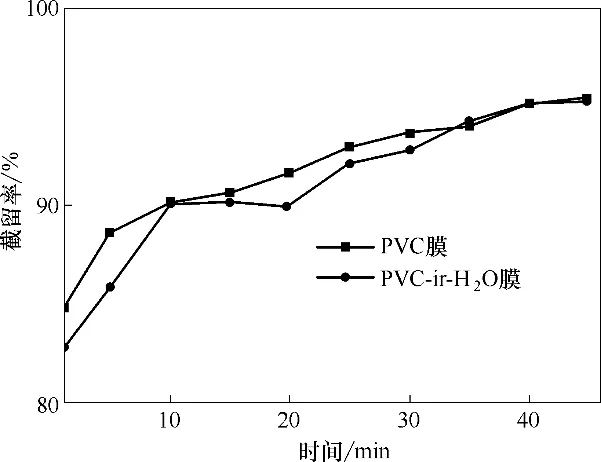
图12 PVC和PVC−ir−H2O膜组件对BSA溶液的截留率随时间的变化Fig.12 The rejections of original PVC membrane and PVC−ir−H2O modules for BSA solution
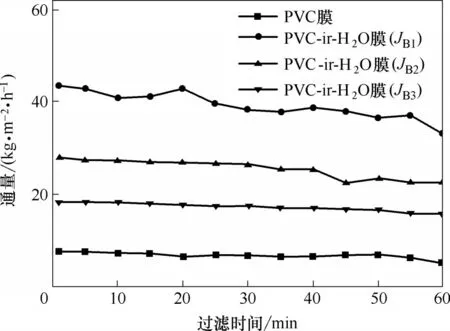
图13 PVC膜和PVC−ir−H2O膜的BSA通量随时间的变化Fig.13 BSA solution fluxes of original PVC membrane and PVC−ir−H2O modules
2.5 膜的抗菌性能分析
2.5.1 静态抗菌性能分析 如图14 所示,对于PVC原膜,开始15 min 由于膜对大肠杆菌E.coli 的吸附作用导致其可见菌落数有所下降[38],之后菌落数有所增加,主要是因为吸附的菌群不断繁殖所致[39]。对于PVC-g-DMAE膜在30 min内,细菌数量即可由105 CFU ∙ml−1降 低 至104 CFU ∙ml−1,杀 菌 率 达 到90%,45 min 之后细菌被全部杀死,60 min 时依然保持灭菌效果。
抗菌实验后细菌培养照片见图15,由此可知经水等离子体活化和接枝聚合的PVC-g-DMAE 膜不但具有优异的杀菌性能,而且具有持久的抑菌能力,可有效抑制细菌繁殖。

图14 PVC-g-DMAE膜的抗菌性和稳定性Fig.14 Antibacterial activities and stability of PVC-g-DMAE
2.5.2 动态抗菌性能分析 采用自制错流过滤装置考察PVC 膜和PVC-g-DMAE 膜动态过滤抗菌性能,结果如图16 所示。经过6 次过滤,PVC 原膜杀菌率由84%降低为49%,起初较高的杀菌率是由于PVC 膜对大肠杆菌E.coli 的吸附作用,当吸附达到饱和后,膜的杀菌率保持在49%。而PVC-g-DMAE膜的杀菌率在6次实验中一直保持在83%到93%之间。主要是由于接枝抗菌单体DMAE 可杀死E.coli,阻止生物膜形成,保持较高的杀菌率。另外,杀菌率略有降低主要是由于带正电荷的膜表面(C—N+)与大肠杆菌之间的静电吸附,导致抗菌官能团表面被残留的死细菌碎片覆盖。由此可知,接枝PVC-g-DMAE 膜组件在动态实验中显示出良好的抗菌活性。
此外需要说明的是,抗菌性的体现主要是由于接枝单体DMAE 后的改善,活化未接枝抗菌单体的膜只是亲水性得到了提高,而且这种提高不是永久的,须进一步接枝提高其稳定性,而膜的抗菌性能的提高也主要是由于接枝单体发挥的作用,因此通过对比PVC 膜和PVC-g-DMAE 膜的抗菌性能,可以表明接枝抗菌单体后,膜的抗菌性能显著提升。

图15 PVC膜和PVC-g-DMAE膜对大肠杆菌E.coli的抗菌抑菌照片Fig.15 Antibacterial inhibition of original PVC membrane and PVC-g-DMAE against E.coli
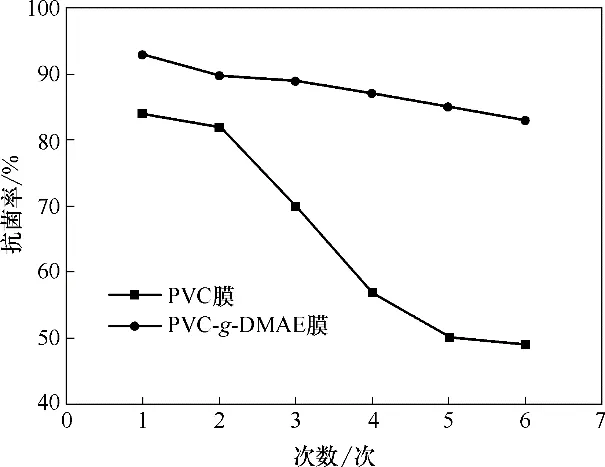
图16 PVC膜和PVC-g-DMAE膜的动态过滤抗菌活性实验结果Fig.16 Dynamic filtration antibacterial activities of PVC−g−DMAE
图17 为动态实验中PVC 膜组件与PVC-g-DMAE膜组件的渗透通量随时间的变化。实验过程中PVC-g-DMAE 膜组件渗透通量显著高于PVC 原膜,随过滤次数增加两种膜的通量均有所降低。其原因主要是由于膜表面形成细菌生物膜或死亡细菌吸附层,阻碍膜孔传输通道,造成通量下降。
3 结 论
通过低温水等离子体活化和DMAE 单体接枝聚合,对三通道PVC−HFMs 膜进行了有效的表面改性,以增强其抗菌和亲水性。这种新型环境友好方法可以简便、可控地在膜外表面通过共价接枝的方式构建DMAE层。
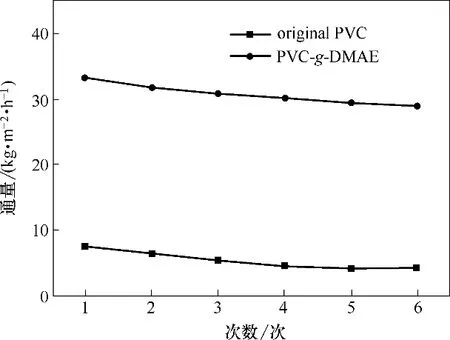
图17 PVC膜和PVC-g-DMAE膜的动态过滤通量随实验次数变化Fig.17 Dynamic filtration permeation properties of the PVC−g−DMAE
在等离子活化改性过程中,放电线圈被直接卷绕在膜壳上,代替了以往的LDLTP 流需要在真空石英腔内产生Ar 等离子流引入膜组件内的间接操作过程。能够使得膜表面在改性过程中实现沿纤维轴向的均匀活化改性,同时,改性过程中利用水蒸气在低压下直接从润湿的中空纤维膜中挥发出来作为溶剂,工艺更加绿色环保。
研究结果表明,等离子体活化和接枝改性可有效提高PVC 膜的亲水性能、渗透通量及抗污染性能。通过膜对BSA 溶液的吸附性能及过滤性能研究可知,水等离子体活化改性膜(PVC−ir−H2O)能够有效防止蛋白吸附,从而提高膜的抗污染性能,并且不会对截留性能造成较大影响。
通过膜的抗菌性研究,在静态抗菌实验中,PVC-g-DMAE 膜对大肠杆菌的杀灭率为100%,稳定性良好。在动态抗菌实验中,膜组件经过6 次过滤后对大肠杆菌抑制作用明显,动态过滤稳定性好。
综上所述,采用水等离子体活化耦合抗菌单体接枝聚合方法,为膜材料的抑菌抗污染改性提供了一种有效途径,在饮用水处理领域,特别是小型家用净水器膜组件改性方面,具有良好的应用前景。
符 号 说 明
A——有效膜面积,m2
A1,A2——分别代表原液和渗透液中BSA的吸光度
B——杀菌率,%
J——渗透通量,kg∙m−2∙h−1
JB1,JB2,JB3——分别代表三次BSA 溶液渗透通量,kg∙m−2∙h−1
Nc,Ns——分别代表对照组大肠杆菌E.coli 在悬浊液和膜样品上的菌落数。
Q——渗透液质量,kg
t——时间,h
