初探分化型甲状腺癌外周血中PD-1、TIGIT、Tim-3表达水平与临床特征的关系
2020-09-29冯亚宁王新华
常 诚,冯亚宁,王新华
(新疆医科大学附属肿瘤医院1核医学科, 2新疆肿瘤学重点实验室,乌鲁木齐 830011; 3中国医学科学院肿瘤免疫与放疗研究重点实验室,4新疆医科大学第三附属医院省部共建中亚高发病成因与防治国家重点实验室, 乌鲁木齐 830011)
甲状腺癌是最常见的恶性肿瘤之一,其发病率呈逐渐增加的趋势。其病理类型主要由乳头状癌、滤泡癌、髓样癌及未分化癌组成。临床上甲状腺乳头状癌的患者往往通过手术切除甲状腺后根据患者术后复发危险分层这一系统进一步指导患者是否行放射性I131治疗,但仍然有部分难治性甲状腺癌患者经手术及I131治疗后其预后依然不佳[1]。免疫检查点(checkpoint)是指在免疫细胞上表达、能调节免疫应答激活程度的一系列分子,在抗肿瘤免疫中起着重要的作用。关于免疫检查点中程序性死亡受体1(programmed death-1,PD-1)、含T细胞免疫球蛋白域和免疫受体酪氨酸抑制基序的蛋白(T cell immunoglobulin and ITIM domain,TIGIT)及T 淋巴细胞免疫球蛋白黏蛋白3(T lymphocyte immune globulinmucin-3,Tim-3)与肿瘤发生发展的关系逐渐成为近年来研究的热点[2-4]。如果能针对免疫检查点分子进行调节,比如以PD-1、PD-L1靶向药物为代表的免疫抑制剂就可以发挥增强机体免疫功能的作用,从而发挥抑制肿瘤细胞的功效[5]。免疫治疗在临床应用中虽然表现出显著而持久的疗效,却只有少数患者受益,客观有效率仅有10%~40%[6-7],多项回顾性及前瞻性研究中发现放射治疗联合免疫治疗可以显著的提高肿瘤的局部控制率及有效的延长患者的疾病无进展生存时间[8-9]。结合以上研究发现,是否可通过免疫抑制剂治疗联合131碘同位素治疗难治性甲状腺癌术后的患者,以提高这部分患者的局部控制率及远期生存率。因此,本研究以术后需接受131碘治疗的分化型甲状腺癌患者为研究对象,探索外周血T细胞PD-1、TIGIT及Tim-3受体表达水平与临床病理特征之间的相关性。为后续进一步开展免疫治疗联合131碘同位素治疗的研究提供理论依据。
1 资料与方法
1.1 一般资料选取2019年11月-2020年1月于新疆医科大学附属肿瘤医院收治的,根据《2018年甲状腺癌诊疗规范》[10]术后需接受131碘同位素治疗的32例患者作为患者组。平均年龄(43±9)岁,男性13例,女性19例。同时按年龄、性别进行匹配收集27例在本院进行健康体检的受检者作为对照组。纳入标准:患者病历资料齐全;病理结果均提示为甲状腺乳头状癌;术后需接受131碘同位素治疗的患者。排除标准:排除病历资料不完整的患者;合并其他原发恶性肿瘤的患者;既往接受过免疫治疗的患者;有免疫系统疾病及合并严重的基础疾病患者。两组对象年龄、性别等一般资料差异无统计学意义。所有受试者在实验开始前均被告知临床研究的目的、方法,预期效益和可能的潜在风险,并自愿签署知情同意书。
1.2 研究方法抽取晨起空腹外周EDTA抗凝静脉血,离心处理后,采取密度梯度离心法分离外周血单核细胞(peripheral blood mononuclear cells, PBMCs)。向分离提取的PBMCs加入Live/Dead染料(themo fisher scientific),置于4℃冰箱中染色20~30 min,随即FACS washing buffer洗涤2次,加入针对表面抗原的荧光标记抗体:CD3-BUV396、CD4-PE、CD8-PerCP-Cy5.5、PD-1-Bv650、TIGIT-APC-R700、Tim-3-BB515。再次4℃冰箱染色后,使用BD LSR Fortessa流式细胞分析仪(BD Biosciences)进行检测。检测获得的资料采用FlowJo软件进行数据化处理。
2 结果
2.1 甲状腺癌患者与健康人群外周血T细胞亚群上免疫检查点表达水平的比较对照组外周血中CD4+T细胞及CD8+T细胞上PD-1及Tim-3的表达水平均低于患者组,组差异有统计学意义(P<0.05);对照组外周血中CD4+T细胞及CD8+T细胞上TIGIT表达均高于患者组,差异有统计学意义(P<0.05)。见表1、2,图1、2。
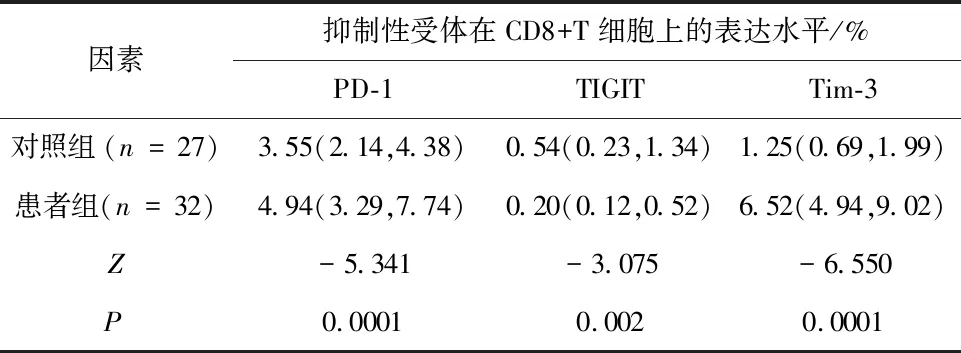
表1 健康人群与甲状腺乳头状癌患者外周血CD4+T细胞上抑制性受体的表达水平比较
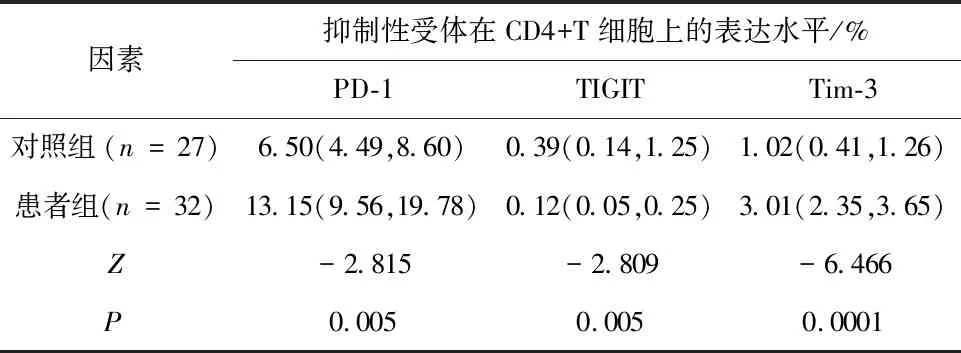
表2 健康人群与甲状腺乳头状癌患者外周血CD4+T细胞上抑制性受体的表达水平比较
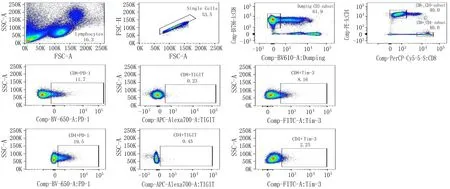
图1 甲状腺癌患者外周血中T细胞亚群上免疫检查点的表达
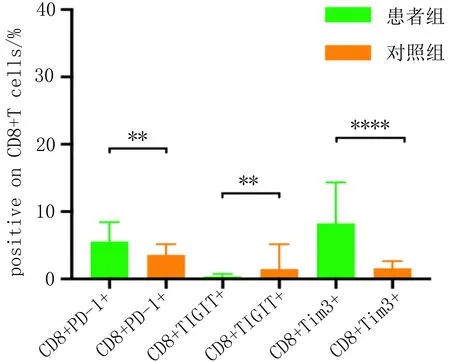
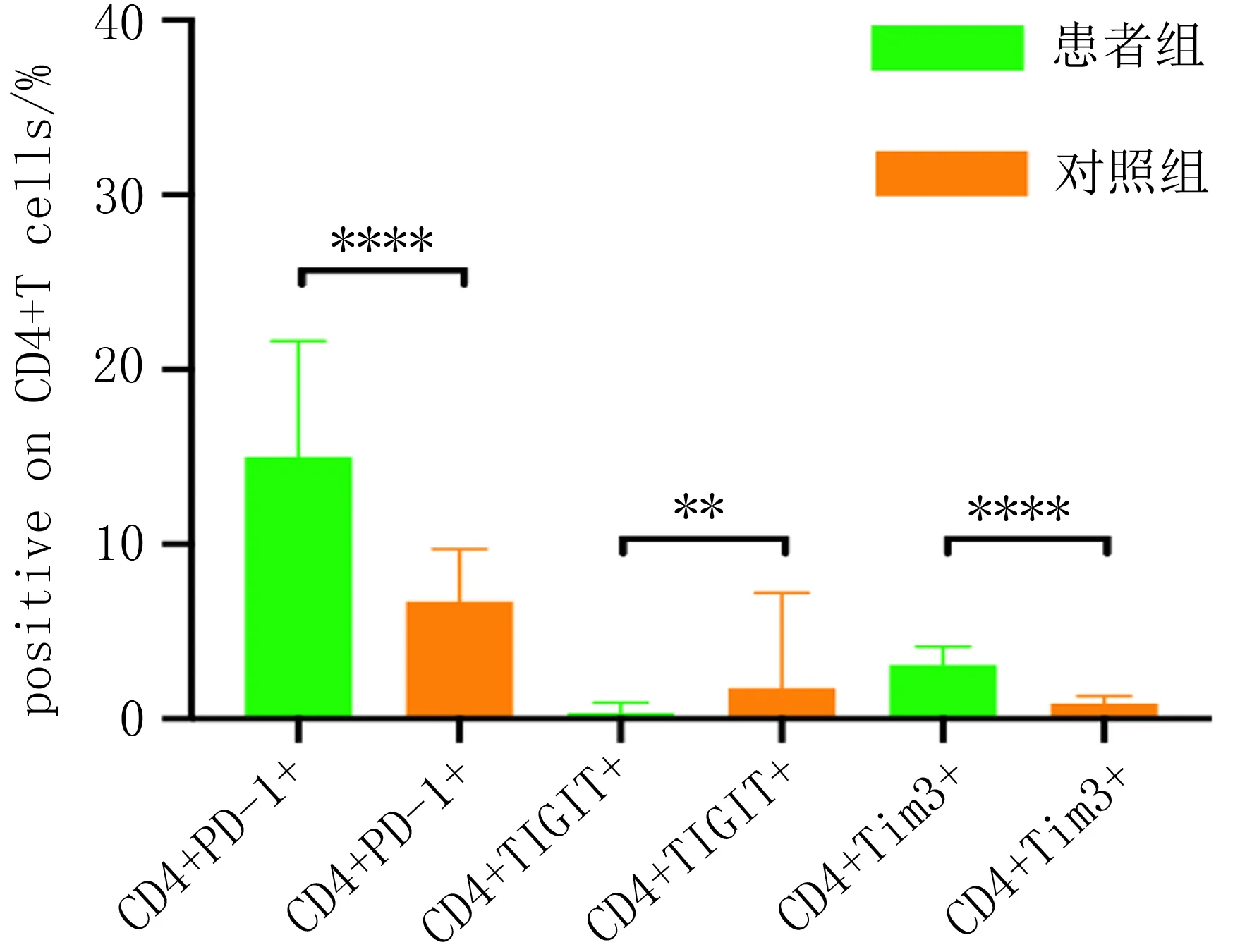
图2 对照组外周血T细胞亚群上免疫检查点表达水平的比较
2.3 甲状腺癌患者外周血中T细胞亚群上免疫检查点的表达与临床病理特征之间的关系外周血CD4+T细胞上PD-1的表达与BMI有关,差异有统计学意义(P<0.05),与年龄、肿瘤大小、局部侵犯、淋巴结转移个数、有无合并甲状腺良性疾病等因素无关,差异无统计学意义(P>0.05),同样按上述这些因素分组研究时,尚未发现外周血中CD4+T细胞上TIGIT及Tim-3的表达与这些因素有关。见表3。
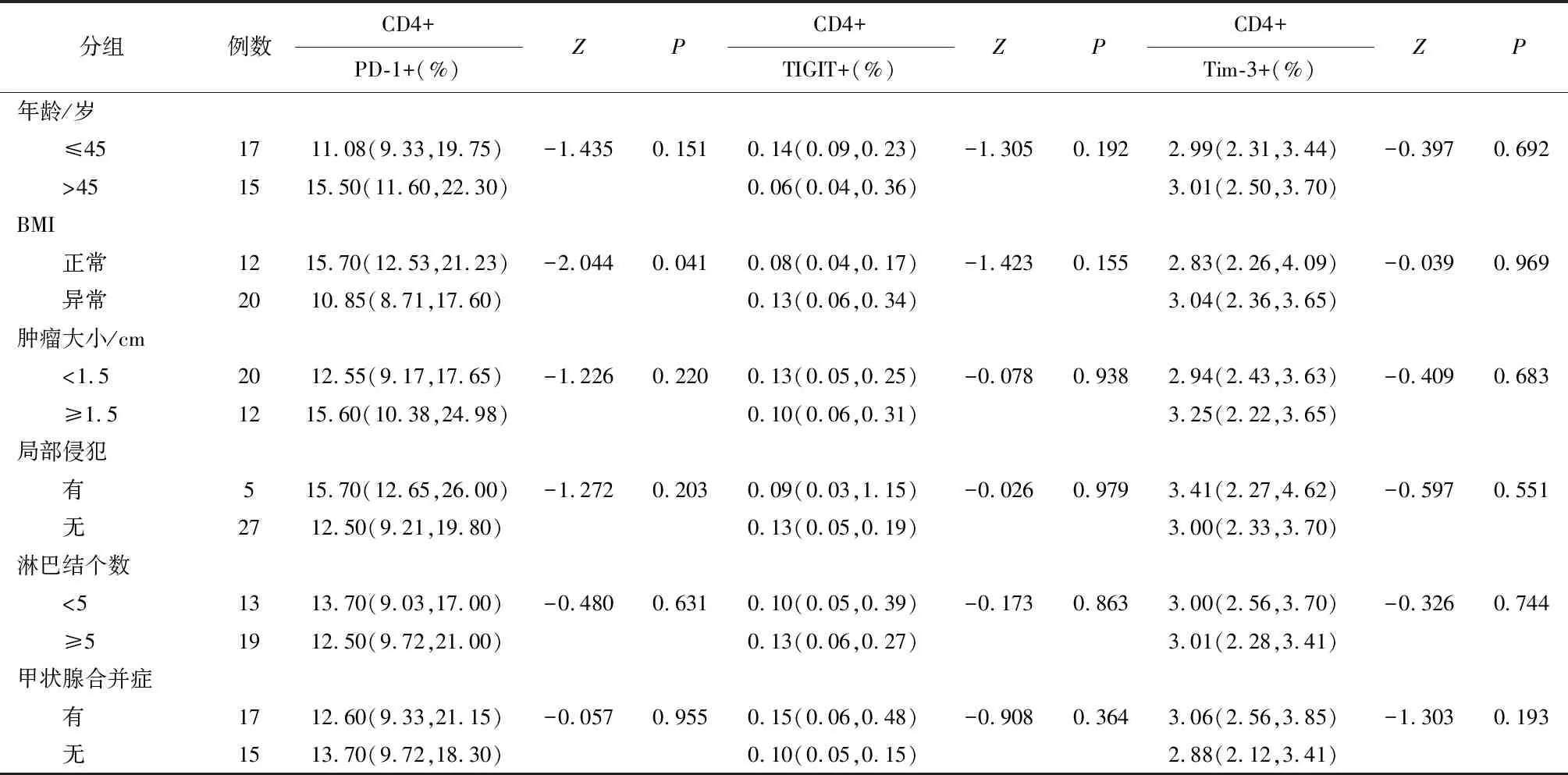
表3 免疫检查点在甲状腺乳头状癌患者外周血CD4+T细胞上的表达与临床特征之间的关系
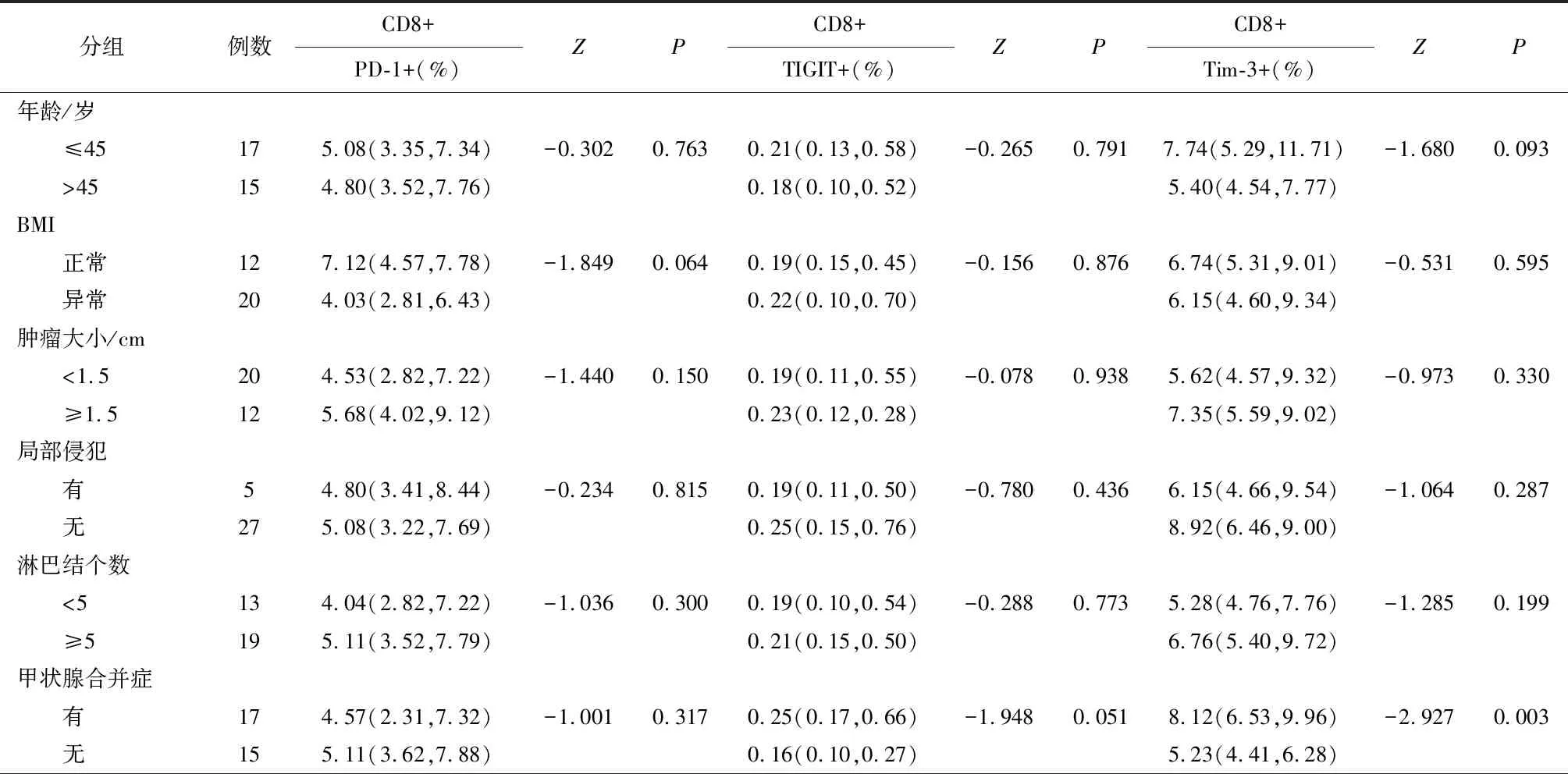
表4 免疫检查点在甲状腺乳头状癌患者外周血CD8+T细胞上的表达与临床特征之间的关系
2.4 BRAF基因突变的甲状腺癌患者外周血T细胞上免疫检查点表达水平与临床特征之间的关系自甲状腺癌患者组中遴选出BRAF基因突变的患者17例。提示BRAF基因突变的甲状腺癌患者外周血中CD4+T细胞上免疫检查点的表达与年龄、BMI、肿瘤大小、淋巴结转移个数及有无甲状腺合并症等因素无关;而PD-1在BMI异常患者外周血CD8+T细胞上的表达较低,差异有统计学意义(P<0.05),TIGIT和Tim-3在BRAF基因突变合并甲状腺良性疾病的患者外周血CD8+T细胞上的表达较BRAF基因突变未合并甲状腺良性疾病的患者高,差异有统计学意义(P<0.05),同时Tim-3的表达水平在年龄较小者组中表达较高,差异有统计学意义(表5)。
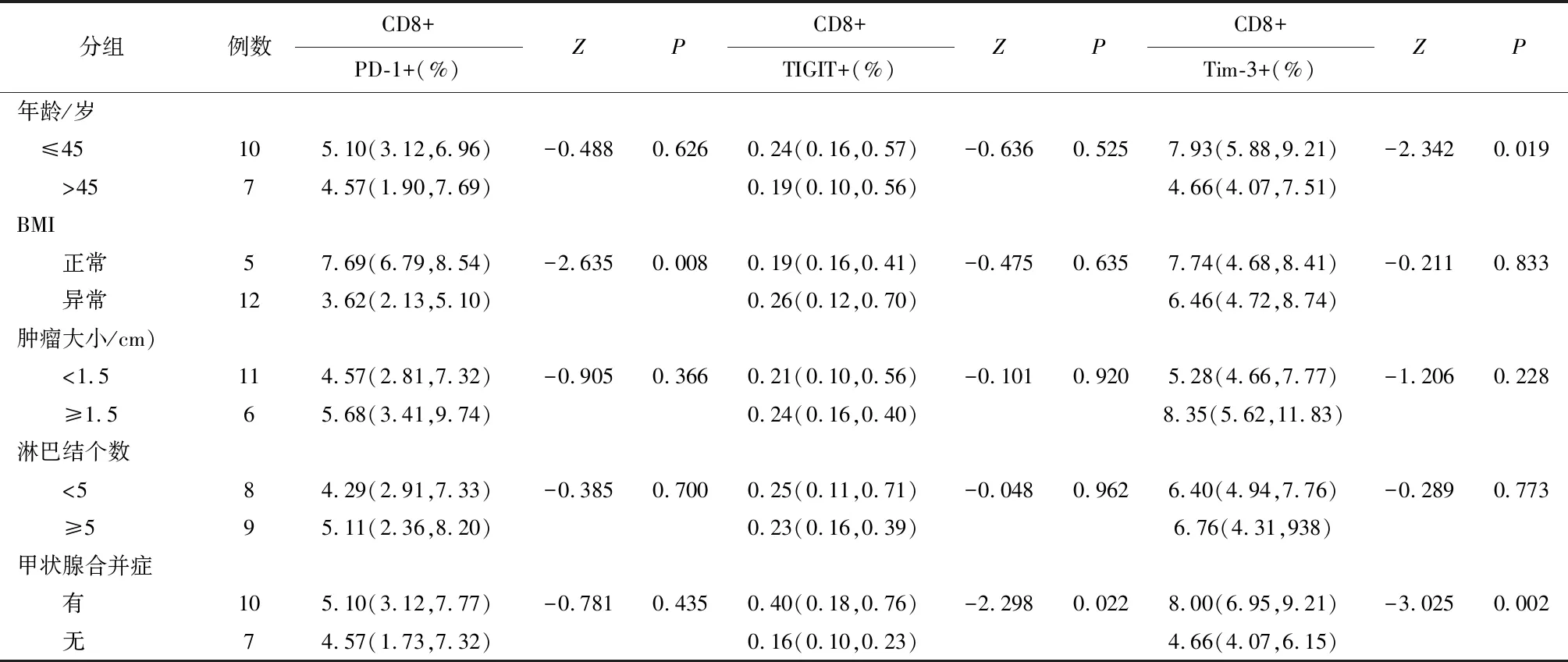
表5 BRAF基因突变患者外周血免疫检查点的表达与临床特征之间的关系
3 讨论
由于肿瘤的免疫治疗涉及复杂的免疫机制,也是近年来众多肿瘤相关研究的热点,PD-1参与人体免疫调节,与肿瘤的发生发展密切相关,本研究的结果显示术后甲状腺乳头状癌患者CD8+PD-1+T细胞和CD4+PD-1+T细胞比例均高于对照组,这与Chowdhury S等的研究相仿[11]。T细胞在肿瘤的免疫应答中具有至关重要的作用,主要由CD4+和CD8+T细胞组成,CD8+T细胞活化后能够特异的杀伤靶细胞,在免疫清除中发挥重要的作用。当PD-1与配体结合后,CD8+PD-1+T细胞受体胞浆区C端的免疫受体酪氨酸转化序列招募并激活蛋白酪氨酸磷酸酶-1及蛋白酪氨酸磷酸酶-2,使其发生磷酸化,并导致 PTEN 磷酸酶的活性升高,磷脂酰肌醇3激酶(phosphatidyl inositol 3-kinase,PI3K)的激活受到抑制,进一步抑制了磷脂酰肌醇3激酶-蛋白激酶 B(phosphatidylinositol 3-kinase-protein kinase B,PI3K-AKT)信号通路的传递[12],最终导致CD8+PD-1+T活性降低,CD8+T细胞的免疫清除作用减弱,导致肿瘤的侵袭性增强,进而解释了本研究中术后甲状腺乳头状癌患者CD8+PD-1+T细胞比例显著高于健康对照组的原因。CD4+T细胞主要由调节性CD4+T细胞及辅助性CD4+T细胞组成。调节性CD4+T细胞主要通过抗原依赖的方式抑制辅助性CD4+T细胞的活化,通过降低免疫反应的方式维持自身的耐受,研究发现CD4+T淋巴细胞表面的受体PD-1与配体结合时,可以促进CD4+ PD-1 T向调节性CD4+T细胞转化,最终导致循环中调节性CD4+T细胞数量增加,从而降低外周免疫系统反应,导致人体免疫系统不能通过有效的免疫应答消除肿瘤细胞,这也与本研究中甲状腺癌患者CD4+ PD-1 T显著高于健康对照组的结果相吻合。
TIGIT是近年来免疫抑制机制研究的热点受体之一。TIGIT定位于T细胞和NK 细胞细胞膜上,包含一个 ITT-like结构域和一个经典的 ITIM 结构域,配体与受体结合后,发挥负性调节T细胞、NK细胞的功能[13],研究显示,肺鳞状细胞癌、结肠癌、乳腺癌等浸润性CD8+ T 细胞表面 TIGIT 表达上调[14-15]。但本研究发现术后甲状腺乳头状癌的患者外周血CD8+TIGIT+T细胞和CD4+TIGIT+T细胞的百分比例均低于正常对照组。 Kong等[16]曾报道在急性髓性白血病病人中TIGIT 高表达,与难治疗和复发等临床不良结果相关联。提示在预后较差的恶性肿瘤患者群体中,TIGIT呈高表达状态。因此,对于预后相对较好的甲状腺癌,推测TIGIT的低表达可能与甲状腺癌预后较好有关。另外,本研究收集的标本为术后外周血,也可能与术后患者免疫状态逐渐恢复有关。因此,有必要进一步扩大样本,深入研究甲状腺乳头状癌术前与术后外周血内、以及甲状腺癌组织、癌旁组织T淋巴细胞TIGIT的表达差异。
Tim-3由免疫球蛋白V区(IgV区)、粘蛋白样结构域、跨膜区和胞内段组成。研究发现Tim-3 与配体 Gal-9 相结合后,引起Tim-3的酪氨酸残基(Y256 和 Y263)发生磷酸化,导致原本与Tim-3紧密结合的Bat-3因子从细胞内段释放出来,随之含有Scr 激酶活性的SH-2结构域与Tim-3相结合,发挥负向调控T细胞受体信号功能,最终导致T细胞的凋亡和衰竭[17]。本研究在甲状腺乳头状癌患者外周血中检测到CD4+和CD8+T细胞均高表达Tim-3受体,而在白血病、黑色素瘤、神经胶质瘤的研究中也同样证实Tim-3+ T细胞的高表达于肿瘤的进展有关[18-20]。最新研究发现,在基因突变的肺癌模型中,进行抗PD-1治疗产生耐药性的小鼠T淋巴细胞高表达Tim-3受体,当联合抗PD-1和抗Tim-3抗体后,可显著降低小鼠抗PD-1耐药的比例,提示Tim-3在肿瘤的免疫治疗中可能是具有潜在意义的新的靶点。
Leitzmann等[21]认为BMI与甲状腺癌之间存在正相关,肥胖人群甲状腺癌的患病风险与正常体质量人群相比增加40%,尤其是甲状腺乳头状癌。而本研究结合临床特征分析时发现CD4+PD-1在体质指数异常的甲状腺癌患者外周血中的表达低于甲状腺癌体质指数正常的患者,同时CD8+PD-1在BRAF基因突变的甲状腺乳头状癌患者外周血中的表达也存在同样的现象,这一结果尚需进一步扩大样本量研究证实。在BRAF基因突变合并甲状腺良性疾病(结节性甲状腺肿或慢性淋巴细胞性甲状腺炎)的甲状腺乳头状癌患者外周血中,CD8+T细胞上TIGIT及Tim-3的表达明显较未合并甲状腺良性疾病的患者高,因此我们推测甲状腺良性疾病可能是TIGIT及Tim-3表达上调的一个诱因,在甲状腺癌发生发展中起着一定的作用,其机制尚需更多的研究确认。既往研究证实高龄是甲状腺癌复发的危险因素[22],Tim-3在肿瘤发生过程中优先累积于CD8+T细胞导致其凋亡[23],进一步影响免疫系统的有效应答。但本研究发现甲状腺乳头状癌患者CD8+Tim-3的表达与年龄呈负相关,因此,我们推测对于年轻的甲状腺癌术后患者外周血中Tim-3高表达可能是预后不良的危险因素,这有待于进一步随访患者预后进行相关性研究。
综上所述,甲状腺乳头状癌患者术后外周血T细胞PD-1和Tim-3、TIGIT表达与健康对照组存在差异,提示检测外周血中上述指标的变化有助于评估甲状腺癌患者术后免疫检查点的状态,开展深入研究可能为复发、转移甲状腺癌免疫治疗,或联合131碘同位素治疗的开展,提供科学依据。
