单剂量促性腺激素释放激素激动剂不同时间用于辅助生殖技术黄体支持的效果比较
2020-09-28郑华叶大强张帼卿许伟标蔡桂丰
郑华,叶大强,张帼卿,许伟标,蔡桂丰
珠海市妇幼保健院,广东珠海519000
随着辅助生殖技术(ART)的广泛应用,由促排卵及取卵导致的黄体功能不全普遍存在于体外受精-胚胎移植(IVF-ET)周期中已成为共识[1,2]。因此,黄体支持在IVF-ET中必不可少。目前临床上存在多种黄体支持方案,疗效肯定的有黄体酮类制剂单独使用或联合人绒毛膜促性腺激素(hCG),雌激素制剂也常作为辅助用药用于黄体支持[3]。但也有研究认为,雌激素并无改善胚胎种植率及妊娠率的作用[4]。而hCG因其易增加卵巢过度刺激综合征(OHSS)发生的风险,常被限制使用[5]。GnRH-a是GnRH的类似物,其短效制剂单次使用,通过与促性腺激素释放激素受体(GnRHR)特异性结合,会出现短期的激发效应,刺激垂体释放卵泡刺激素(FSH)和黄体生成素(LH),但持续给药会使GnRHR下调,抑制内源性FSH、LH分泌,起到垂体降调节的作用。研究显示,在黄体期使用GnRH-a并不会影响ART助孕结局,还可以提高胚胎种植率[6]。据此,生殖专家提出GnRH-a可能用作黄体支持用药,改善妊娠结局。本研究将单剂量GnRH-a于不同时间用于长效降调节方案促排卵后的黄体期,观察GnRH-a是否具有黄体支持作用以及用药时间不同是否影响药物效果,以便指导ART的临床用药。
1 资料与方法
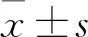
1.1 临床资料 将2017年9月~2019年3月在本中心行IVF/卵胞质内单精子注射(ICSI)助孕并行新鲜周期移植的患者868例。纳入标准:①符合接受IVF/ICSI助孕治疗的条件;②采用黄体中期长效降调节方案进行控制性超促排卵并于新鲜周期移植胚胎;③年龄<40岁;④取卵日子宫内膜厚度≥8 mm。排除标准:对本研究涉及的药物过敏;严重肝肾功能不全;子宫内膜异位症Ⅲ期及以上;夫妻任一方存在染色体异常;复发性流产;子宫畸形;免疫异常。将患者随机分成三组,A组210例,年龄(31.91±3.15)岁,BMI(21.62±1.52)kg/m2,不孕年限(4.17±2.27)年,基础FSH(7.76±1.25)U/L,基础LH(5.96±2.74)U/L;B组315例,年龄(32.37±3.06)岁,BMI(22.17±2.74)kg/m2,不孕年限(3.72±2.41)年,基础FSH(7.80±1.34)U/L,基础LH(5.31±2.62)U/L;C组343例,年龄(32.32±2.98)岁,BMI(22.41±2.39)kg/m2,不孕年限(4.23±2.82)年,基础FSH(7.79±1.27)U/L,基础LH(5.85±2.42)U/L。三组年龄、BMI、不孕年限、基础FSH、基础LH比较,差异均无统计学意义,具有可比性。
1.2 超促排卵方案和取卵移植 三组均于前一月经周期的黄体中期给予长效GnRH-a(达菲林,博福-益普生)1.0~1.5 mg,具体药量根据患者年龄、BMI、卵巢储备而定。用药16~18 d后,采集患者清晨空腹血,测定血清FSH、LH、E2水平。当血清FSH≤5.0 IU/L、LH≤5.0 IU/L、E2≤50 pg/mL,提示达到降调节标准,开始给予促性腺激素(Gn),每2~4 d行B超检查及测定血清E2、LH水平,根据B超和血清激素结果调整Gn用量。当有1个卵泡直径≥18 mm或3个以上卵泡直径≥17 mm时,皮下注射重组人绒毛膜促性腺激素(艾泽,瑞士雪兰诺)250 μg,36~37 h后在B超引导下取卵。采用梯度离心法洗涤精液后,行IVF/ICSI,于取卵后第3天移植优质胚胎1~2个。
1.3 移植后黄体支持用药 自取卵日开始,三组每天肌内注射黄体酮注射液60 mg,连续17 d。B组于取卵后第4天(即移植后第1天),单次给予GnRH-a(达必佳,辉凌制药)0.1 mg皮下注射,C组于取卵后第6天(即移植后第3天),单次给予GnRH-a 0.1 mg皮下注射。
1.4 观察指标 记录三组Gn用量、促排天数、获卵数、hCG日子宫内膜厚度和移植胚胎数,计算胚胎种植率;以移植后14 d血hCG>3 U/L为生化妊娠,移植后4周阴道超声检查发现孕囊者为临床妊娠,记录妊娠情况;观察OHSS的发生情况;随访妊娠结局,包括异位妊娠、多胎、早期流产以及活产情况。
2 结果
2.1 三组促排卵情况和移植胚胎数、胚胎种植率比较 三组Gn用量、促排天数、获卵数、hCG日子宫内膜厚度和移植胚胎数比较,差异均无统计学意义(P均>0.05)。见表1。三组胚胎种植率分别为40.16%、48.95%、44.44%,B组高于A组(P<0.05),C组与A组比较差异无统计学意义(P>0.05)。

表1 三组促排卵情况和移植胚胎数比较
2.2 三组妊娠率及OHSS发生率比较 三组生化妊娠率、OHSS发生率比较差异均无统计学意义(P均>0.05)。与A组比较,B组临床妊娠率升高(P<0.05),C组无明显变化(P均>0.05)。见表2。

表2 三组妊娠率及OHSS发生率比较(%)
2.3 三组妊娠结局比较 与A组比较,B组异位妊娠率、早期流产率均无统计学差异(P均>0.05),活产率升高(P<0.05);C组活产率有升高趋势,异位妊娠率、早期流产率有下降趋势,但差异均无统计学意义(P均>0.05)。B组以上指标与C组比较差异均无统计学意义(P均>0.05)。三组多胎率比较差异无统计学意义(P均>0.05)。见表3。

表3 三组妊娠结局比较(%)
3 讨论
近年来,GnRH-a成为黄体支持药物的一种选择,但其有效性也存在争议。在ART助孕周期黄体期的使用时间、频率、使用剂量有多种报道。2016年的一项关于GnRH-a用于辅助生殖技术黄体支持的Meta分析显示,纳入的11项研究中有8项研究的GnRH-a用法用量不一致,仅3项研究共同采用了在取卵后第6天单次皮下注射曲普瑞林0.1 mg的方案[7]。本研究尝试将单剂量GnRH-a添加时间提前至取卵后第4天,结果显示,在黄体期常规应用肌注黄体酮的同时,B组于取卵后第4天加用单剂量GnRH-a可显著提高胚胎种植率、临床妊娠率和活产率。
关于GnRH-a于黄体期的作用机制,很多生殖专家在不同层面展开多项研究。GnRH-a/GnRHR广泛表达于垂体、卵巢、子宫内膜、胎盘以及胚胎,对胚胎着床和早期发育有重要作用。Tesarik等[8]认为,黄体期给予单剂量短效GnRH-a能激发垂体释放内源性LH并作用于卵巢,能够在一定程度上逆转降调所引起的内源性LH浓度及活性的下降,促进黄体分泌为胚胎早期发育和妊娠维持提供有利环境。但也有研究尝试在拮抗剂方案黄体期中每天应用GnRH-a,并没有起到有效的黄体支持作用,整个黄体期血清孕酮均低于20 ng/mL[9]。所以,GnRH-a通过垂体作用于卵巢黄体不足以解释单剂量短效GnRH-a在黄体期发挥的积极作用。与本研究C组观察到的结果相似,Ata等[10]于取卵后第6天皮下注射单剂量短效GnRH-a,观察到临床妊娠率有所提高,但没有统计学差异。该研究解释为,取卵后第6天距离降调节末次注射GnRH-a的时间过短,GnRHR受抑制的作用还没有减弱,此时给予单剂量短效GnRH-a,对GnRHR的作用效果有限,所以产生的黄体支持作用不显著。但本研究观察到B组于取卵后第4天加用单剂量短效GnRH-a可以显著提高临床妊娠率和胚胎种植率。我们推测,黄体期单剂量GnRH-a可能是通过作用于子宫内膜或胚胎上的GnRH-a/GnRHR起作用的。
研究显示,GnRH-a对体外培养的人早期胚胎有促进分裂的作用,且这种作用在8细胞期就能显现出来[11]。不同于体外实验,在体内环境中GnRH-a需要通过母体才能对胚胎发挥作用,然而合体滋养层细胞侵入子宫内膜并形成腔隙最早是在受精后第8天,但也不能排除子宫内膜早期可能通过旁分泌的方式作用于胚胎。Siler-Khodr等[12]报道,孕早期应用GnRH抗体会导致流产率增加,孕妇血清hCG水平降低,推测在早孕的生理机制中可能存在以胚胎滋养层细胞为基础的GnRH-hCG轴。本研究结果也印证了这一点,C组给药时间晚于B组,早期流产率和异位妊娠率均有下降,虽然差异无统计学意义,但此差异没有出现在A组与B组之间。因此,GnRH-a于黄体期用药可能通过胚胎滋养层细胞起作用,有利于维持持续妊娠。
Tesarik等[13]报道,取卵日子宫内膜厚度<7 mm的患者于黄体期使用GnRH-a后,种植率和临床妊娠率显著提高,由此推测GnRH-a可能直接作用于子宫内膜。目前研究发现,人类子宫内膜与间质上皮细胞均有GnRHR mRNA和蛋白表达,且在分泌早期和中期的表达高于增生期和分泌晚期[14],在分子水平证实了GnRH-a在分泌早、中期可以对子宫内膜有直接作用,但在临床应用中尚无有力证据。
综上所述,于取卵后第6天加用单剂量GnRH-a对改善妊娠结局不显著,但有降低异位妊娠和早期流产率的趋势;将GnRH-a添加时间提前至取卵后第4天,使其作用于分泌早期的子宫内膜GnRHR,可增加子宫内膜容受性,提高临床妊娠率,但还需进一步大样本研究及长期追踪进行验证。
