苦参碱对血管平滑肌细胞增殖和凋亡的影响及机制
2020-09-28李小丹高婉琴王京
李小丹,高婉琴,王京
1西安大兴医院,西安710016;2延安大学附属医院
动脉粥样硬化性血管病变的外科治疗包括经皮介入治疗和药物治疗无效的外科手术治疗。然而,这两种方法均与再狭窄的频繁发生有关,再狭窄的发生主要是由于内膜增生和动脉粥样硬化的复发。血管平滑肌细胞在再狭窄形成中起着关键作用。再狭窄的病理机制包括内膜损伤和平滑肌细胞的增殖、迁移[1,2]。正常情况下,血管内皮作为屏障可以防止平滑肌细胞受血液刺激,当血管内膜被球囊或支架损伤时,平滑肌细胞与循环中的生长因子发生接触,导致细胞异常增殖并在血管损伤处堆积,形成新生内膜,造成局部血管腔再次狭窄。蛋白激酶B(AKT)/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路参与细胞代谢、生长、增殖、分化、凋亡、自噬等多种生理过程[3]。苦参碱是由豆科植物苦参的干燥根、植株、果实经乙醇等有机溶剂提取而成,研究表明,苦参碱可诱导多种实体肿瘤如结直肠癌、肝癌、宫颈癌以及血液恶性肿瘤如单核细胞白血病淋巴瘤细胞凋亡[4~7]。2018年1月~2019年10月,我们观察了苦参碱对血管平滑肌细胞增殖和凋亡的影响,并探讨AKT/mTOR信号通路在其中的作用。
1 材料与方法
1.1 材料 苦参碱购自百灵威科技有限公司,用PBS溶解。血管平滑肌细胞株MOVAS细胞购自美国ATCC公司。胎牛血清(FBS)、高糖DMEM培养基购自美国Gibco公司。青链霉素混合液购自Hyclone公司。CCK-8试剂盒购自日本同仁公司。AKT/mTOR信号通路相关蛋白AKT、mTOR及其下游底物核糖体蛋白S6激酶(p70S6K)、真核起始因子4E结合蛋白1(4EBP1)抗体均购自美国Abcam公司。p-AKT、p-mTOR、p-p70S6K、p-4EBP1购自美国CST公司。RAPI裂解液和BCA法蛋白浓度检测试剂盒均购自上海碧云天生物技术有限公司,蛋白酶抑制剂和磷酸酶抑制剂均购自美国罗氏公司。PVDF膜和ECL发光液均购自Millipore公司。细胞周期检测试剂盒购自北京达科为生物技术有限公司。ELISA凋亡试剂盒购自罗氏公司,Caspase-3活性检测试剂盒购自北京诺博莱德科技有限公司。
1.2 细胞培养 取MOVAS细胞,加入含10%FBS和青链霉素混合液的DMEM高糖培养液,置于37 ℃、5% CO2培养箱中。细胞长满后加入0.25%胰酶消化,用含血清的培养液中和胰酶,1 500 r/min离心5 min。用新鲜培养液将细胞沉淀、重悬,吹打成单细胞悬液,按1∶3的比例进行细胞传代。
1.3 苦参碱最佳作用浓度的筛选 采用CCK-8法。将对数生长期细胞,加入0.25%胰酶消化,按1×104/孔接种至96孔板,培养至细胞贴壁。加入0.5、1、5、10、100 μmol/L苦参碱溶液,分别作用24、48、72 h后,每孔加入10 μL CCK-8溶液,继续培养2 h。用酶标仪测定在450 nm处的吸光度。用GraphPad Prism7.04软件绘制增殖曲线,结果显示苦参碱对MOVAS细胞增殖的抑制作用具有浓度依赖性,随苦参碱浓度的增加,其对细胞增殖的抑制作用增强。曲线回归计算苦参碱对MOVAS细胞增殖抑制的EC50是7.6 μmol/L,因此本研究选择5、10 μmol/L进行后续实验。
1.4 细胞周期检测 取对数生长期细胞,按1×106/孔接种于6孔板。待细胞贴壁后,将其分为5 μmol/L苦参碱组、10 μmol/L苦参碱组及对照组,分别加入5、10 μmol/L苦参碱和无菌PBS溶液作用24 h。加入胰酶消化细胞,1 500 r/min离心5 min。用新鲜的培养液将细胞沉淀重悬并吹打成单个细胞悬液,用预冷的PBS将细胞沉淀洗两次。用75%乙醇固定,4 ℃过夜。第2天1 500 r/min离心5 min,弃上清。用PBS洗涤两次,加入溴化乙锭(PI)染液,室温避光染色30 min。用400目筛过滤后上机,计数2×104个细胞,分析各细胞周期细胞比例。
1.5 细胞凋亡检测 采用ELISA法。取对数生长期细胞,加入0.25%胰酶消化,以1×104/孔接种至96孔板,培养至90%融合。将细胞分为5 μmol/L苦参碱组、10 μmol/L苦参碱组及对照组,分别加入5、10 μmol/L苦参碱和无菌PBS溶液作用24 h。收集细胞,1 000 r/min离心10 min,取20 μL上清液加入链霉亲和素包被的培养板孔中。加入80 μL免疫反应试剂,室温摇床孵育2 h。取上清,用温育缓冲液洗涤3次,加入100 μL底物缓冲液,室温摇床孵育10~20 min,上酶标仪测定405 nm波长处的光密度(OD)值,以底物缓冲液作为空白对照。
1.6 Caspase-3活性检测 采用ELISA法。取对数生长期细胞,待细胞贴壁后,将其分为5 μmol/L苦参碱组、10 μmol/L苦参碱组及对照组,分别加入5、10 μmol/L苦参碱和无菌PBS溶液作用24 h。加入胰酶消化,PBS洗涤。加入细胞裂解液震荡裂解,4 ℃ 12 000 r/min离心,取上清。将pNA用反应缓冲液稀释为200、100、50、25、12.5、6.25、3.125 μmol/L,另设不加pNA的0管。每一浓度取100 μL加入96孔板,测定405 nm处OD值。每一浓度标准管OD405值为x轴,对应的pNA浓度为y轴,用Excel软件制作pNA浓度对应OD405值的标准曲线。将60 μL待测样品加入96孔板,加入5 μL底物,37 ℃反应2 h,测定405 nm处的OD值。根据标准曲线计算Caspase-3活性。
1.7 AKT、mTOR、p70S6K、4EBP1蛋白活性检测 采用Western blotting法。将MOVAS细胞接种于6孔板中,待细胞贴壁后,将其分为5 μmol/L苦参碱组、10 μmol/L苦参碱组及对照组,分别加入5、10 μmol/L苦参碱和无菌PBS溶液作用24 h。PBS洗涤,加入含蛋白酶抑制剂和磷酸酶抑制剂的蛋白裂解液裂解细胞,离心后收集上清。用BCA法测各样本的总蛋白浓度,加适量的上样缓冲液在100 ℃金属浴中煮5 min使蛋白变性。取50 μg总蛋白进行SDS-PAGE凝胶电泳后,转至PVDF膜上,用4%脱脂奶粉封闭1.5 h后,加入一抗,4 ℃孵育过夜。加入相应的二抗,孵育2 h,用凝胶成像系统进行化学发光。用Image J软件测量灰度值,以β-actin为内参,分析目的蛋白的表达。以p-AKT、p-mTOR、p-p70S6K、p-4EBP1水平代表各蛋白活性。
2 结果
2.1 各组细胞周期比较 与对照组比较,5 μmol/L和10 μmol/L苦参碱组G1期细胞比例升高(P均<0.01),S期和G2期细胞比例降低(P均<0.05)。与5 μmol/L苦参碱组比较,10 μmol/L苦参碱组G1期细胞比例升高(P<0.01),S期和G2期细胞比例降低(P均<0.05)。见表1。

表1 各组细胞周期比较
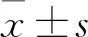
2.2 各组细胞凋亡率比较 对照组、5 μmol/L苦参碱组、10 μmol/L苦参碱组的细胞凋亡率分别为9.75%±1.23%、16.75%±2.02%、30.5%±1.73%。与对照组比较,5 μmol/L和10 μmol/L苦参碱组细胞凋亡率升高,且10 μmol/L组高于5 μmol/L组(P均<0.01)。
2.3 各组Caspase-3活性比较 对照组、5 μmol/L苦参碱组、10 μmol/L苦参碱组Caspase-3活性分别为743.33±103.46、1 043.33±97.57、1 816.67±143.19。与对照组比较,5 μmol/L和10 μmol/L苦参碱组Caspase-3活性升高,且10 μmol/L组高于5 μmol/L组(P均<0.05)。
2.4 各组AKT、mTOR、p70S6K、4EBP1蛋白活性比较 与对照组比较,5 μmol/L和10 μmol/L苦参碱组p-AKT、p-mTOR、p-p70S6K、p-4EBP1表达水平均降低,且10 μmol/L组低于5 μmol/L组(P均<0.05)。见表2。

表2 各组AKT、mTOR、p70S6K、4EBP1蛋白活性比较
3 讨论
动脉粥样硬化的进展涉及胆固醇代谢紊乱、泡沫细胞形成、慢性炎症、血管平滑肌细胞增殖和迁移、内皮功能障碍等病理过程。血管平滑肌细胞在动脉粥样硬化形成的不同时期发挥不同的作用,包括表型转换、细胞增殖、迁移、细胞凋亡和细胞衰老等。血管介入治疗和外科手术治疗后,血管平滑肌细胞受到刺激发生增殖,是新生内膜形成的主要病理机制[8]。近年来,药物洗脱支架常用来避免支架内再狭窄的发生,但效果并不理想,接受药物洗脱支架的患者和接受普通支架的患者6年病死率与自发性心肌梗死患者并无明显差异。因此,为药物洗脱支架寻找新的生物靶点是治疗再狭窄的关键。苦参碱是从苦参中提取的生物碱,用于治疗病毒性肝炎、心律失常和皮肤炎症等疾病具有显著效果。研究显示,苦参碱能抑制年龄诱导的主动脉平滑肌细胞的表型转换[9]。然而苦参碱对血管平滑肌细胞增殖和凋亡的影响目前少见报道。
程熠、耿娅等[10,11]报道,苦参碱对宫颈癌Hela细胞和正常肝细胞L-02细胞增殖具有抑制作用,其机制是通过阻断细胞周期、诱导细胞凋亡来实现的。本研究结果显示,与对照组比较,5 μmol/L和10 μmol/L苦参碱组G1期细胞比例增多,S期和G2期细胞比例减少。表明苦参碱能诱导MOVAS细胞周期发生停滞,从而抑制细胞增殖。
细胞凋亡包括线粒体介导的内源性途径和死亡受体诱导的外源性途径。线粒体在细胞凋亡中起着中心作用。线粒体功能障碍时,线粒体通透性转换孔(MPTP)打开,细胞色素C从线粒体释放至胞质。细胞色素C的释放对凋亡通路的执行起重要作用,它激活了Caspase-9,随后Caspase-3也被激活。Caspase-3是细胞凋亡过程中最主要的终末剪切酶,其活化导致目标细胞最终破坏[12]。本研究结果显示,5 μmol/L和10 μmol/L苦参碱组的细胞凋亡率、Caspase-3活性均高于对照组,且10 μmol/L苦参碱组高于5 μmol/L苦参碱组。表明苦参碱能够诱导MOVAS细胞凋亡,通过诱导MOVAS细胞周期阻滞和细胞凋亡来抑制新生内膜形成,从而减少再狭窄的发生。
PI3K/AKT/mTOR信号通路在血管平滑肌细胞增殖和迁移中起关键作用,阻断该信号通路可抑制平滑肌细胞增殖,促进其凋亡。研究证实,AKT失活可抑制多种类型细胞的增殖并诱导其凋亡[13]。本研究结果显示,苦参碱可抑制MOVAS细胞中AKT的磷酸化。mTOR是一种丝氨酸/苏氨酸蛋白激酶,由PI3K/AKT激活,参与细胞凋亡的调控。它调节蛋白质的合成和降解、寿命和细胞骨架的形成。mTOR激活其下游效应物4EBP1和p70S6K,进而翻译促凋亡蛋白。通过这一途径,mTOR也磷酸化并失活抗凋亡蛋白Bcl-2[14]。AKT/mTOR信号通路的阻断在调节细胞凋亡中起关键作用,靶向mTOR可以抑制白血病细胞增殖,从而治疗白血病[15]。本研究结果显示,经过苦参碱处理的MOVAS细胞中,AKT、mTOR及p70S6K、4EBP1的磷酸化失活。提示苦参碱诱导的MOVAS细胞凋亡可能是通过抑制AKT/mTOR信号通路发挥作用。
综上所述,苦参碱能够抑制血管平滑肌细胞增殖,阻滞细胞周期,并促进细胞凋亡;其机制可能与抑制AKT/mTOR信号通路有关。
