鲁中肉羊GLIS1基因多态性及其与产羔数的关联分析
2020-09-27张壮彪潘林香王金文贺小云储明星
张壮彪,潘林香,王金文,贺小云,储明星*
(1.中国农业科学院北京畜牧兽医研究所, 农业农村部动物遗传育种与繁殖重点实验室, 北京100193;2. 莱芜市嬴泰有机农业科技发展有限公司, 山东 莱芜271114;3. 山东省农业科学院畜牧兽医研究所, 山东 济南 250100)
绵羊(Ovisaries)的产羔数是一个极其复杂的繁殖性状,受到多种因素影响,其中遗传因素占大部分。研究表明多种基因参与绵羊的繁殖调控。1982年,FecB基因在Booroola羊中首先被发现[1],之后其被定位到绵羊6号染色体[2]。进一步研究发现该基因(突变)的产生是由于BMPRIB基因的746位碱基突变(A746G)[3-4],该突变导致谷氨酰胺突变为精氨酸,进而导致相应蛋白功能改变。对FecB基因进行排卵数和产羔数关联分析发现:携带一个拷贝的FecB突变可以增加排卵数1.5个,产羔数1个;两个拷贝数FecB突变可以显著增加排卵数3个,产羔数1.5个[5]。除此之外,GDF9[6]、BMP15等[7]候选基因也可以影响绵羊的繁殖力。其中BMP15可以调控GDF9基因的表达进而调控卵泡发育[8],也有研究发现BMPRIB可以编码BMP15基因的受体,进一步调控绵羊的繁殖过程[9]。虽然对绵羊的繁殖力研究已经持续数年,但绵羊产羔数或繁殖力的差异是如何产生的仍然有待探究。因此探究发现其他可以影响绵羊繁殖力的候选基因将有助于阐明绵羊高繁殖力的分子机理。
Gli-similar-1(GLIS1)是由Kim等[10]在2002年克隆出的Krüppel类似蛋白基因,该基因编码一种富含84.3-kDa脯氨酸的蛋白质,其主要分布在细胞核内,且锌指结构在其核定位中发挥重要作用[10]。研究发现,该基因在体细胞重编程以及胚胎发育和基因表达过程中发挥重要作用[11-12]。在小鼠受精卵和卵母细胞中该基因也呈高表达[13],且前期通过重测序技术发现GLIS1基因的突变位点与绵羊的繁殖性状相关[14],暗示该基因对繁殖过程具有重要调控作用,但关于该基因对绵羊繁殖的影响鲜有报道。鲁中肉羊作为近年来培育的优良肉羊新类群,具有高繁殖力、耐粗饲、抗病力强、适合圈养等特点[15]。探究GLIS1基因多态性对鲁中肉羊产羔数的影响,将有助于该类群的选育,进一步提高经济效益。
1 材料与方法
1.1 样品采集
384只鲁中肉羊血液样品(绵羊颈静脉采血)来自莱芜市嬴泰有机农业科技发展有限公司,采集后的样品用5%柠檬酸钠抗凝处理,-20 ℃保存。
1.2 绵羊血液DNA提取
使用血液基因组提取试剂盒(天根生物科技有限公司,北京)对384只鲁中肉羊进行血液DNA的提取,对提取后的血液样品进行浓度(Nano Drop 2000)和质量(1.5%琼脂糖凝胶电泳)的评估,合格的DNA样品用于后续分析。
1.3 基因分型
MassARRAY Assay Design v. 3.1软件用于设计检测g.27775611T>C位点的单碱基延伸引物(登录号:NC_019458.1)和聚合酶链式反应程序。使用MassARRAY[16]对384只鲁中肉羊进行基因分型,分型的具体过程见Zhang等[17]所示方法。
1.4 数据统计分析
用于计算多态信息含量、杂合度、有效等位基因数和卡方值(哈代温伯格参数)等群体遗传学参数的方法详见Zhang等[17]。
yi=μ+Gi+ei模型用于GLIS1基因g.27775611 T>C位点与鲁中肉羊产羔数的关联分析。式中:yi代表产羔数;μ代表群体均值; Gi代表i种基因型的影响(i=1,2,3);ei代表随机误差。数据统计分析由SAS (V. 8.1)完成,产羔数用平均值±标准误表示。
1.5 GLIS1蛋白的生物信息学分析
绵羊的蛋白序列来自NCBI。ProtParam tool(https://web.expasy.org/protparam/)用于预测GLIS1蛋白的理化性质;TMHMM Server v. 2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)用来预测GLIS1的跨膜结构域;SignalP-5.0 Server(http://www.cbs.dtu.dk/services/SignalP/)用于GLIS1蛋白信号肽的预测;Predictprotein(https://www.predictprotein.org/)用于预测GLIS1蛋白的二级结构;NCBI 保守域预测 (https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi?tdsourcetag=s_pctim_aiomsg) 用于预测GLIS1蛋白的结构功能域;SCRATCH protein predictor(http://scratch.proteomics.ics.uci.edu/index.html)用于预测GLIS1蛋白的二硫键;NetOGlyc 4.0 Server(http://www.cbs.dtu.dk/services/NetOGlyc/)用于预测GLIS1蛋白的糖基化;NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/ )用于预测GLIS1蛋白的磷酸化位点。
2 结果与分析
2.1 GLIS1基因多态性及其与鲁中肉羊产羔数的关联分析
384只鲁中肉羊的分型结果如图1所示,结果表明384只鲁中肉羊群体中存在3种基因型,分别是:CC型8只、TC型108只、TT型268只。对其进行群体遗传学分析发现(表1):该位点的多态信息含量为0.24,属于低度多态(P<0.25),该群体的卡方值为0.65,说明该群体处于哈代温伯格平衡状态(P>0.05)。为探究该突变位点对绵羊产羔数的影响,对384只鲁中肉羊进行了产羔数关联分析,结果发现(表2):在有产羔数记录的3胎中,突变纯合个体(CC)的产羔数显著低于突变杂合个体(TC)和野生型(TT)(P<0.05),突变杂合个体(TC)的产羔数低于野生型(TT)(P>0.05),说明突变可以显著降低鲁中肉羊的产羔数。
2.2 GLIS1蛋白的生物信息学分析
GLIS1蛋白的理化性质预测表明:该蛋白由728个氨基酸组成,其分子量为77195.46 D,等电点为8.82,属于碱性蛋白质。从蛋白组成来看,其主要由20种氨基酸组成,其中脯氨酸(pro)含量最高为14.3%,而色氨酸(Trp)含量最低为0.4%。该蛋白在动物体内的半衰期大约为5.5 h,不稳定指数为65.93,脂溶性指数为64.67,亲水平均值为-0.520,故该蛋白是一种不稳定脂溶性的疏水蛋白。
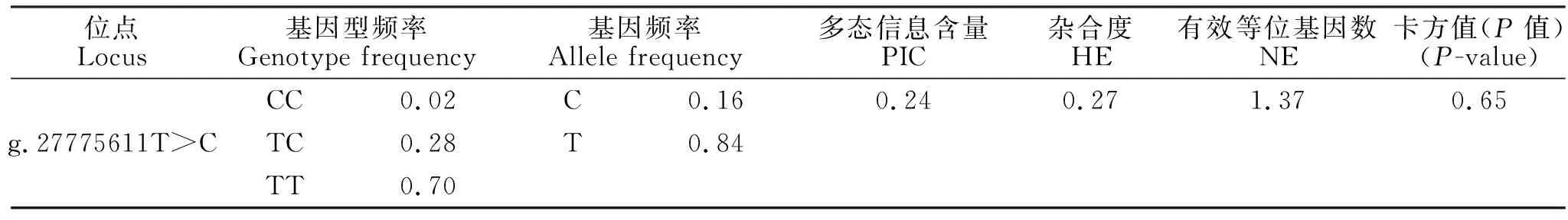
表1 g.27775611T>C位点在鲁中肉羊中的群体遗传学分析Table 1 The population genetic analysis of g.27775611T>C in Luzhong mutton sheep

表2 g.27775611T>C位点不同基因型鲁中肉羊不同胎次的产羔数Table 2 The litter size of different parity in Luzhong mutton sheep with different genotypes of g.27775611T>C
该蛋白属于膜内蛋白(图2A),并且无信号肽结构。从预测的二级结构来看,其暴露态(exposed)占47.76%,中间态(intermediate)为7.06%,埋藏态(buried)为45.18%,另外该蛋白还存在多个DNA、RNA和蛋白结合位点(图2B)。其功能域预测结果显示(图2C):该蛋白在354-344处存在COG5048超家族结构域即锌指功能域,该结构域可能对GLIS1蛋白的功能起重要作用。另外该蛋白存在26个半胱氨酸(cys),其形成了11个二硫键。
为探究GLIS1基因突变前后蛋白功能的变化,对其突变前后糖基化和磷酸化位点的变化进行了预测。结果发现:与突变前相比,突变后在其547位氨基酸增加了一个糖基化位点;与突变前相比(图3A),突变后的GLIS1蛋白其547位氨基酸磷酸化位点丢失(图3B),可能导致一些激酶无法在该位点结合(图3C),进而可能导致其功能的变化。
3 讨 论
GLIS1基因是一种Krüppel类似蛋白基因,由于其在小鼠卵母细胞内高表达,猜测其对其他哺乳动物如绵羊的繁殖活动具有重要调控作用。关于该基因研究主要集中在其与干细胞活性,细胞重编程[18-19]以及某些疾病[20-21]。有研究表明GLIS1基因的多态性(rs797906)与中国人群帕金森疾病的发病率有关[22]。但关于该基因多态性对绵羊繁殖的影响鲜有报道。本研究中GLIS1基因g.27775611C>T位点与鲁中肉羊产羔数显著相关,该突变可以显著降低鲁中肉羊的产羔数(P<0.05),说明其可以显著影响绵羊的繁殖性能。
蛋白是基因功能的执行者,研究分析其蛋白的功能可以更好地解释该基因对繁殖性能的影响。GLIS1蛋白理化性质预测结果表明,该蛋白是一种不稳定脂溶性的疏水蛋白,其在动物体内的半衰期大约为5.5 h,不稳定指数为65.93,脂溶性指数为64.67,亲水平均值为-0.520,其半衰期长,而其却属于不稳定蛋白,与半衰期长蛋白稳定的常理相驳[23],故推测其具有双重活性[24]。信号肽预测表明该蛋白是一种没有信号肽且不跨膜的蛋白,暗示该蛋白发挥功能可能在细胞核内,该结果与前人报道一致[10]。锌指功能域是该蛋白的唯一功能结构域,研究表明,该结构域对蛋白的定位起决定性作用[10];也有研究表明,Kruppel样锌指转录因子可以作为其它基因如血管紧张素Ⅱ的靶基因,发挥其重编程的作用[25],结合本研究结果,推测其可能是其它可以影响绵羊繁殖力基因的靶基因,具体基因和相关机制有待验证。
氨基酸的糖基化和磷酸化对蛋白本身的功能具有重要影响。研究表明在小鼠雌激素受体基因16位丝氨酸的糖基化和磷酸化可以显著影响该基因的转录,进而影响雌激素受体的功能[26]。在本研究中GLIS1基因突变前后其糖基化和磷酸化位点发生变化,该变化可能会导致该蛋白功能的改变,从而影响绵羊的繁殖活动。也有研究表明在有蹄动物孕期,某些因素如糖基化和磷酸化具有调节果糖降解的作用,进而促进怀孕动物外胚层细胞的增殖[27],从而提高怀孕成功率甚至产羔数。结合本研究中GLIS1基因突变对绵羊产羔数的影响,推测突变后磷酸化和糖基化位点的变化可能在一定程度上降低鲁中肉羊的繁殖力或者产羔数,具体机制有待进一步探究。
4 结 论
本研究表明,GLIS1基因g.27775611T>C位点突变可以显著降低鲁中肉羊的产羔数。生物信息学分析进一步发现该蛋白突变后其磷酸化和糖基化位点发生变化,该变化可能降低鲁中肉羊的产羔数;GLIS1基因g.27775611T>C位点突变属于有害突变,在以后绵羊育种工作中应减少或避免该突变的发生。
