酿酒酵母培养物和提取物对绵羊瘤胃上皮细胞β-防御素-1表达的影响
2020-09-25赵霏霏杨银凤
魏 方,赵霏霏,杨银凤*
(1.内蒙古农业大学 兽医学院,内蒙古 呼和浩特 010018;2.内蒙古自治区基础兽医学重点实验室,内蒙古 呼和浩特 010018)
防御素是一类富含半胱氨酸的两亲性带正电荷的内源性小分子多肽,是先天免疫系统的效应分子,具有有效的抗细菌、真菌和病毒等微生物活性[1],并广泛存在于植物、昆虫和脊椎动物等生物界中。脊椎动物身体内的防御素基于其结构和二硫键连接方式不同可以进一步分为α-防御素、β-防御素和θ-防御素3种类型[2]。其中,β-防御素已被广泛研究,其由上皮细胞和免疫细胞群产生,具有广谱的抗菌功效,可作用于革兰阳性菌和革兰阴性菌以及真菌和包膜病毒,进一步调节微生物和宿主之间的串扰和维持黏膜系统健康及动态平衡[1-3]。因此,利用防御素生物学特性代替抗生素治疗微生物感染将成为一种新的治疗方法。
酵母相关产物存在于我们日常生活的方方面面且种类繁多。其除了作为食品添加剂和护肤成分被应用于食品和化妆品方面,还作为饲料添加剂被应用于养殖动物饲料中,对动物健康和生产起积极作用。2013年农业部将酿酒酵母培养物、酿酒酵母提取物和酿酒酵母细胞壁3种酿酒酵母相关产物从《饲料添加剂品种目录》转入《饲料原料目录》,可见其在动物养殖业中占有重要位置。酿酒酵母培养物是以酿酒酵母为菌种,经固体发酵、浓缩、干燥等处理后获得的天然发酵产品,其主要有效成分为酿酒酵母细胞胞外代谢产物,含有甘露聚糖、维生素、蛋白质、氨基酸、核苷酸和肽等多种物质,具有免疫调节功能。酿酒酵母提取物是以酿酒酵母为菌种,经液体发酵后获得菌体,再经自溶或机械破碎等处理方法使菌体破碎后,分离获得可溶性组分并浓缩干燥所得产品,其主要成分为酿酒酵母细胞胞内物质。关于酿酒酵母培养物和提取物的研究主要是其被试验动物摄入后对试验动物生产、健康和胃肠道菌群及形态等方面的影响,而有关其与防御素表达的关系研究报道却是很少见到。近年来,相关研究表明,饲喂酵母培养物对哺乳期犊牛和断奶仔猪的生长性能、肠道健康和机体免疫均有促进作用[4-5]。刘明等[6]在研究酵母提取物对断奶仔猪生产性能、腹泻发生率和肠道形态影响中发现,与对照组相比,添加酵母提取物组断奶仔猪在饲养后半阶段日增重显著增加,并在试验第1,2,4周腹泻发生率显著降低,且肠绒毛生长也得以促进。胡胜兰[7]在类似研究中发现,短期日粮添加富含核苷酸的酵母提取物虽然对断奶仔猪生长性能无显著性影响,但肾质量显著提高,且改善了肠道益生菌增殖并抑制致病菌生长;甚至能够在非洁净环境中上调炎性细胞因子进而提高断奶仔猪肠道免疫应答。本课题组研究团队之前进行了酿酒酵母菌、酿酒酵母菌细胞壁及其组分甘露聚糖和β-葡聚糖对SBD-1表达影响的研究,发现它们均可不同程度诱导SBD-1表达[8-11]。然而,关于酿酒酵母培养物和提取物对SBD-1表达影响的研究尚未见相关报道。
本试验采用qPCR技术检测酿酒酵母培养物和提取物在不同质量浓度、不同时间段刺激ORECs后,SBD-1 mRNA的表达变化。为从益生菌胞外代谢产物和胞内物质与上皮细胞防御素表达关系的角度研究防御素发挥免疫作用的途径和机制提供一定的理论依据。
1 材料与方法
1.1 试验材料绵羊瘤胃组织块取自内蒙古自治区呼和浩特市北亚屠宰场屠宰的健康绵羊。取几块瘤胃组织块用提前准备好的灭菌生理盐水洗去内容物后,放入灭菌生理盐水中带回实验室进行下一步操作。
1.2 绵羊瘤胃上皮细胞(ORECs)原代培养从瘤胃组织上剥离黏膜层,将黏膜层转至超净工作台用含青、链霉素的PBS缓冲液清洗数遍,直到溶液澄清为止。然后利用胰蛋白酶连续消化法,在37℃条件下,连续消化黏膜层6次,消化时间依次为30,20,15,10,8,5 min,每次消化完成后,倒置显微镜下观察消化液,使用200目筛子过滤收集含有较多圆而亮细胞的消化液并用含20%胎牛血清的DMEM/F12终止消化。最后一次消化液收集完成后,1 600 r/min离心8 min弃去上清液,用PBS缓冲液重悬细胞沉淀,离心弃去上清后,用完全培养基混匀细胞并装入细胞培养瓶,放在37℃、5%CO2细胞培养箱中静置培养4 d后更换培养基,之后每隔2 d更换1次培养基。当单层细胞汇合生长大约铺满瓶底80%以上时,即可将细胞消化传代扩大培养用于后续试验。
1.3 酿酒酵母培养物和提取物溶液配制
1.3.1酿酒酵母培养物溶液配制 酿酒酵母培养物溶液由达农威益康XP(达农威生物发酵工程技术(深圳)有限公司)提供,为浅橙色粗粉溶于PBS溶液制成。称取0.6 g达农威益康XP放入30 mL PBS溶液中,涡旋将其充分混合并在摇床上室温温育1 h,使大部分粉末溶解。然后,2 400 r/min离心10 min除去剩余的固体,收集上清液,在超净工作台中使用0.22 μm过滤器无菌过滤上清液,得到20 g/L 酿酒酵母培养物溶液备用。
1.3.2酿酒酵母提取物溶液配制 酿酒酵母提取物溶液由YEAST EXTRACT(OXOID公司产品,为浅橙色粉末)溶于PBS溶液制成。配制方法同1.3.1。
1.4 酿酒酵母培养物和提取物刺激ORECs的试验设计每孔加入200 mg/L酿酒酵母培养物的DMEM/F12培养基刺激ORECs 作为刺激组,同时用DMEM/F12培养基作为空白对照组,放置于37℃温箱刺激2 h后,弃去培养基,用PBS清洗3次,再重新加入DMEM/F12培养基,继续诱导培养6,12,18,24,30 h后分别提取各组ORECs总RNA。然后利用qPCR技术检测SBD-1 mRNA 的表达量,以筛选出酿酒酵母培养物诱导ORECs SBD-1 mRNA 表达的最佳时间;每孔加入不同质量浓度(0,100,200,300,400 mg/L)酿酒酵母培养物的DMEM/F12培养基刺激ORECs,置于37℃温箱刺激2 h后,弃去培养基,用PBS清洗3次,再重新加入DMEM/F12培养基,继续诱导培养最佳时间后提取各组ORECs总RNA。然后利用qPCR技术检测SBD-1 mRNA 的表达量,以筛选出酿酒酵母培养物诱导ORECs SBD-1 mRNA 表达的最佳质量浓度。酿酒酵母提取物对ORECs的刺激试验设计同酿酒酵母培养物。
1.5 MTT法检测酿酒酵母培养物和提取物对ORECs的毒性作用消化收集生长状态良好的ORECs,调整细胞悬液浓度以每孔2×104个接种于96孔板,以含不同质量浓度(0,100,200,300,400 mg/L)酿酒酵母培养物的DMEM/F12培养基刺激ORECs 2 h后继续诱导培养30 h;弃去培养基,用PBS清洗3次,每孔加入10 μL MTT溶液(5 g/L)和100 μL DMEM/F12培养基, 37℃、5% CO2培养4 h后,终止培养;使用DMSO溶解,使用多功能酶标仪(SynergyTMH4,Biotek)在490 nm处检测各孔的密度。酿酒酵母提取物对ORECs毒性作用的检测同酿酒酵母培养物。
1.6 细胞RNA提取和反转录根据RNA提取试剂盒(Axygen公司产品)说明书操作,提取ORECs总RNA,使用多功能酶标仪检测所提RNA在260,280 nm波长下的吸光度(D值),并分析其纯度和浓度。然后将所提RNA按照反转录试剂盒(TaKaRa,RR047A)进行反转录反应,将得到的cDNA保存于-20℃备用。
1.7 实时荧光定量PCR(qPCR)内参基因β-actin和目的基因SBD-1各自的基因特异性引物的设计与合成均由上海生工生物有限公司完成(表1)。以cDNA为模板,参照张曼等[10]qPCR试验方法检测目的基因SBD-1相对表达量。每个样品均进行3次重复反应。
1.8 统计分析分别使用SPSS软件和GraPhPad Prism 5软件对试验相关数据结果进行统计学分析和图片制作。试验结果均用“平均值±标准差”表示。其中P<0.01表示差异极显著,P<0.05表示差异显著。

表1 引物序列及扩增片段大小
2 结果
2.1 ORECs原代培养及传代培养ORECs生长状态如图1所示,原代细胞培养4 d后显微镜下观察,可见或大或小的贴壁细胞团均匀分布(图1 A);培养8 d后观察到上皮细胞生长状态良好,呈现鹅卵石铺路状单层汇合贴满细胞培养瓶底,此时可使用胰蛋白酶消化细胞进行传代培养(图1 B)。细胞传代培养2 d时显微镜下观察(图1 C),上皮细胞单层汇合生长连成片状,细胞间仍有空隙可供细胞继续生长,与原代上皮细胞生长相比,传代细胞生长速度加快;传代培养4 d后(图1 D),上皮细胞紧凑排列、密集生长,几乎铺满细胞培养瓶底。

图1 ORECs原代培养和传代培养(100×) A.原代培养4 d的ORECs;B.原代培养8 d的ORECs;C.传代培养2 d的ORECs;D.传代培养4 d的ORECs
2.2 酿酒酵母培养物和提取物对ORECs的毒性作用本试验设置5个质量浓度梯度(0,100,200,300,400 mg/L)的酿酒酵母培养物和提取物分别刺激ORECs 2 h,诱导培养30 h后,再利用MTT法检测各孔中上皮细胞存活率,以确定酿酒酵母培养物和提取物对ORECs毒性的影响,结果如图2所示。不同质量浓度酿酒酵母提取物和培养物刺激上皮细胞后,细胞存活率同对照相比无显著性差异(图2),表明100,200,300,400 mg/L质量浓度酿酒酵母提取物和培养物对上皮细胞无毒性。
2.3 β-actin和SBD-1基因qPCR扩增结果
2.3.1β-actin和SBD-1基因qPCR扩增产物特异性检测 以所提RNA反转录所得的cDNA为模板,使用上海生工生物工程有限公司设计合成的目的基因SBD-1和内参基因β-actin引物进行qPCR扩增反应。其扩增曲线如图3 A,B所示,可见扩增效果良好。溶解曲线如图3 C,D所示,观察发现目的基因SBD-1和内参基因β-actin溶解曲线分别在84℃和88.5℃处出现单一溶解峰,均未有杂峰出现,且单一溶解峰所处的Tm值同合成引物预期产物Tm值相同,表明qPCR扩增产物为单一且具有特异性的产物。
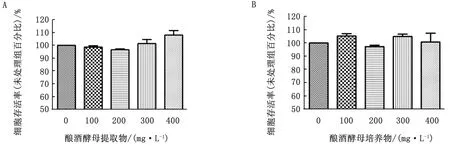
图2 酿酒酵母培养物和提取物对ORECs活性影响 A.不同质量浓度酿酒酵母提取物对ORECs活性影响;B.不同质量浓度酿酒酵母培养物对ORECs活性影响
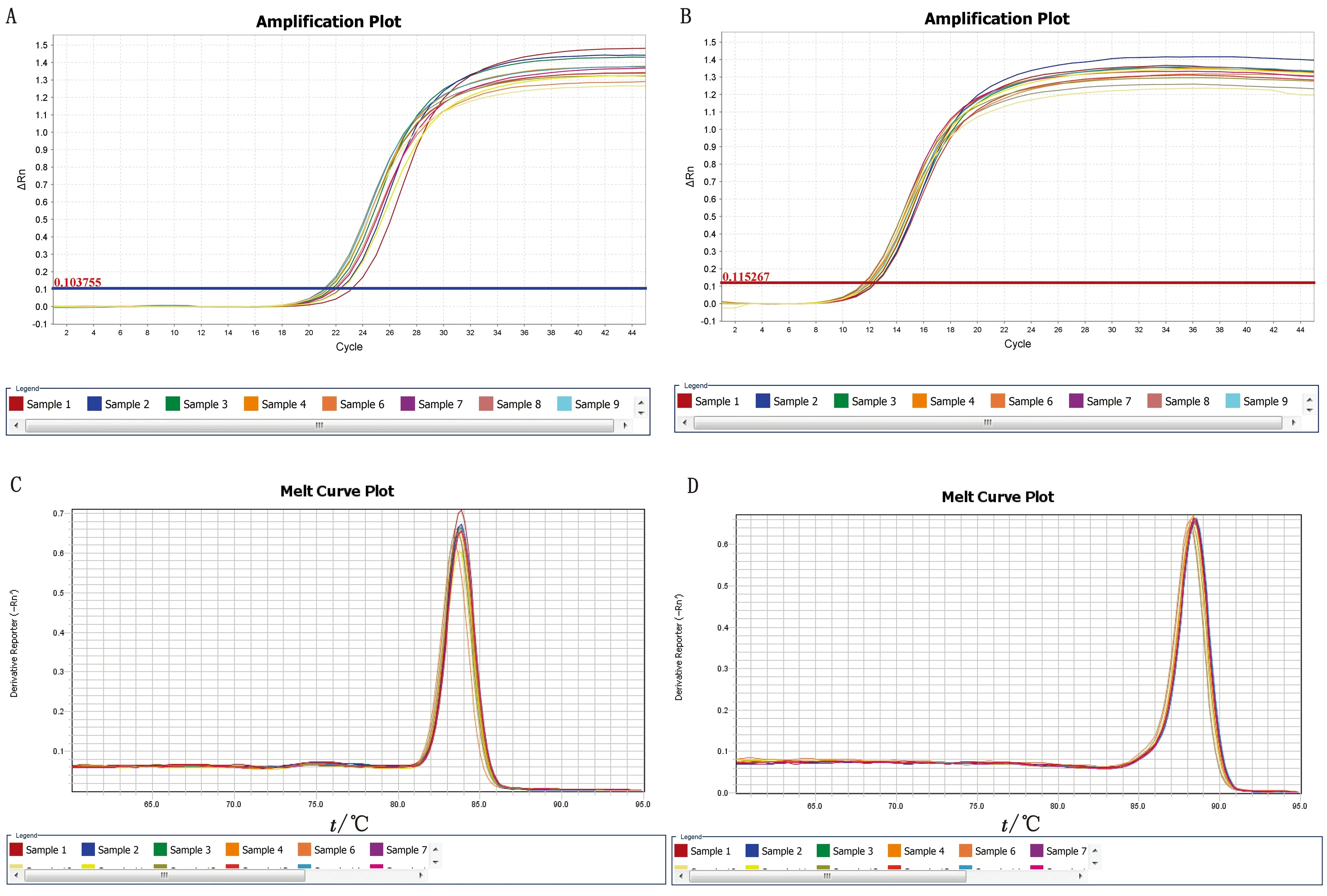
图3 β-actin和SBD-1基因qPCR扩增曲线及溶解曲线 A.SBD-1基因qPCR扩增曲线;B.β-actin基因qPCR扩增曲线;C.SBD-1基因qPCR溶解曲线;D.β-actin基因qPCR溶解曲线
2.3.2β-actin和SBD-1基因qPCR扩增产物琼脂糖凝胶电泳鉴定 利用1%琼脂糖凝胶电泳法分析鉴定β-actin和SBD-1基因qPCR扩增产物,试验结果如图4所示,分别在约208 bp和133 bp处可见特异性单一条带且无二聚体出现,特异性单一条带大小同设计引物的理论片段大小一致,证明qPCR扩增产物确实为β-actin和SBD-1基因的扩增产物。
2.4 酿酒酵母培养物和提取物刺激ORECs诱导SBD-1表达
2.4.1酿酒酵母培养物刺激ORECs 对SBD-1 mRNA表达的影响 为了确定酿酒酵母培养物对ORECs SBD-1 mRNA表达的影响,本试验首先用200 mg/L酿酒酵母培养物刺激ORECs 2 h后继续诱导培养ORECs 6,12,18,24,30 h,同时设置未刺激组为空白对照。观察到除了诱导培养12 h组SBD-1 mRNA表达与未刺激组无显著性差异以外(P>0.05),其他组SBD-1 mRNA表达均极显著高于未刺激组(P<0.01),且诱导培养ORECs 6 h时SBD-1 mRNA的表达量达到最大(图5 A)。然后用不同质量浓度(0,100,200,300,400 mg/L)的酿酒酵母培养物刺激ORECs 2 h,诱导培养 6 h,发现不同质量浓度酿酒酵母培养物刺激细胞均能诱导SBD-1 mRNA表达且显著高于对照组(P<0.01),其中400 mg/L质量浓度酿酒酵母培养物刺激组SBD-1 mRNA表达量最大,200 mg/L质量浓度酿酒酵母培养物刺激组SBD-1 mRNA表达量次之(图5 B)。由此可知,400 mg/L质量浓度酿酒酵母培养物刺激诱导ORECs 6 h后,SBD-1 mRNA表达量达到最大。
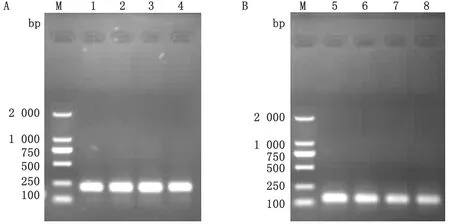
图4 β-actin(A)和SBD-1(B)基因qPCR扩增产物琼脂糖凝胶电泳 M.DL2000 DNA Marker;A1~A4.β-actin 基因qPCR扩增产物;B1~B4.SBD-1基因qPCR扩增产物
2.4.2酿酒酵母提取物刺激ORECs 对SBD-1 mRNA表达的影响 为了确定酿酒酵母提取物对ORECs SBD-1 mRNA表达的影响,本试验首先用200 mg/L酿酒酵母提取物刺激ORECs 2 h后继续诱导培养ORECs 6,12,18,24,30 h,同时设置未刺激组为空白对照。结果如图5C所示,与未刺激组相比,诱导培养6,24,30 h组SBD-1 mRNA表达量均极显著升高(P<0.01),且诱导培养ORECs 6 h时SBD-1 mRNA的表达量达到最高(图5 C)。接着用不同质量浓度(0,100,200,300,400 mg/L)的酿酒酵母提取物刺激ORECs 2 h,诱导培养 6 h,发现不同质量浓度酵母提取物刺激细胞均能诱导SBD-1 mRNA表达,但仅200 mg/L质量浓度酿酒酵母提取物刺激组SBD-1 mRNA表达量极显著高于对照组(P<0.01,图5 D)。由此可知,200 mg/L质量浓度酿酒酵母提取物刺激诱导ORECs 6 h后,SBD-1 mRNA表达量达到最高。
2.5 最佳诱导条件下酿酒酵母提取物和培养物诱导ORECs SBD-1表达的比较结合本试验研究结果综合考虑,酿酒酵母培养物和提取物两者均能够诱导ORECs SBD-1 mRNA表达,且有各自不同的最佳诱导时间和质量浓度。到底具体哪种物质诱导ORECs SBD-1 mRNA表达效果最好?这个问题引起作者的好奇心。所以本课题组针对这一问题做了相关试验研究,分别用2种物质在各自的最佳刺激质量浓度和时间条件下诱导培养ORECs,然后提取细胞总RNA,经qPCR扩增反应,结果见图6。与对照组相比,酿酒酵母培养物刺激组SBD-1 mRNA表达量显著升高(P<0.05),而酿酒酵母提取物刺激组SBD-1 mRNA表达量极显著升高(P<0.01),表明酿酒酵母提取物诱导效果优于酿酒酵母培养物。
3 讨论
近年来,随着动物集约化养殖和舍饲养殖规模的不断扩大,养殖动物机体抵抗力下降,群体感染疾病风险增加。抗生素虽然能够预防疾病和促进动物生长,但由于其在动物体内残留和耐药菌产生等缺点,迫切需要寻找抗生素替代品。防御素作为小型阳离子两性亲和肽,是机体自身分泌的一类抗微生物肽,也是机体先天免疫系统的功能效应物质,能够趋化免疫细胞,参与免疫调节反应[12],同时还具有抗细菌、抗真菌和抗病毒活性,是被公认的抗生素有效替代品之一。最近几年,关于诱导调控动物胃肠道黏膜上皮细胞内β-防御素表达的研究引起了研究人员的极大兴趣。相关研究表明,益生菌与体外培养的胃肠道上皮细胞共培养数小时后,能够有效诱导防御素表达,并且部分益生菌菌种与防御素表达水平之间存在浓度-时间依赖关系[13-16]。此外,中草药提取分子、维生素D、短链脂肪酸和胆汁酸等也被发现对动物机体产生防御素有积极作用,从而改善机体胃肠道免疫和预防疾病感染[1,17-19]。因此,益生菌和中草药提取物等物质可作为诱导剂有效诱导宿主体内防御素表达。利用诱导剂诱导防御素表达这一方法很有可能在不久将来成为一种新的治疗方法,以替代抗生素治疗感染和微生态失调引发的疾病。
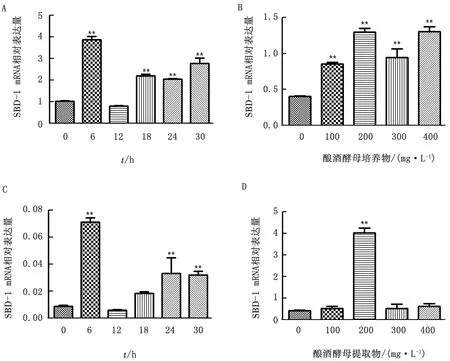
图5 酿酒酵母培养物和提取物对ORECs SBD-1 mRNA表达的影响(**.P<0.01) A.酿酒酵母培养物处理ORECs不同时间对SBD-1 mRNA表达影响;B.不同质量浓度酿酒酵母培养物处理ORECs对SBD-1 mRNA表达影响;C.酿酒酵母提取物处理ORECs不同时间对SBD-1 mRNA表达影响;D.不同质量浓度酿酒酵母提取物处理ORECs对SBD-1 mRNA表达影响
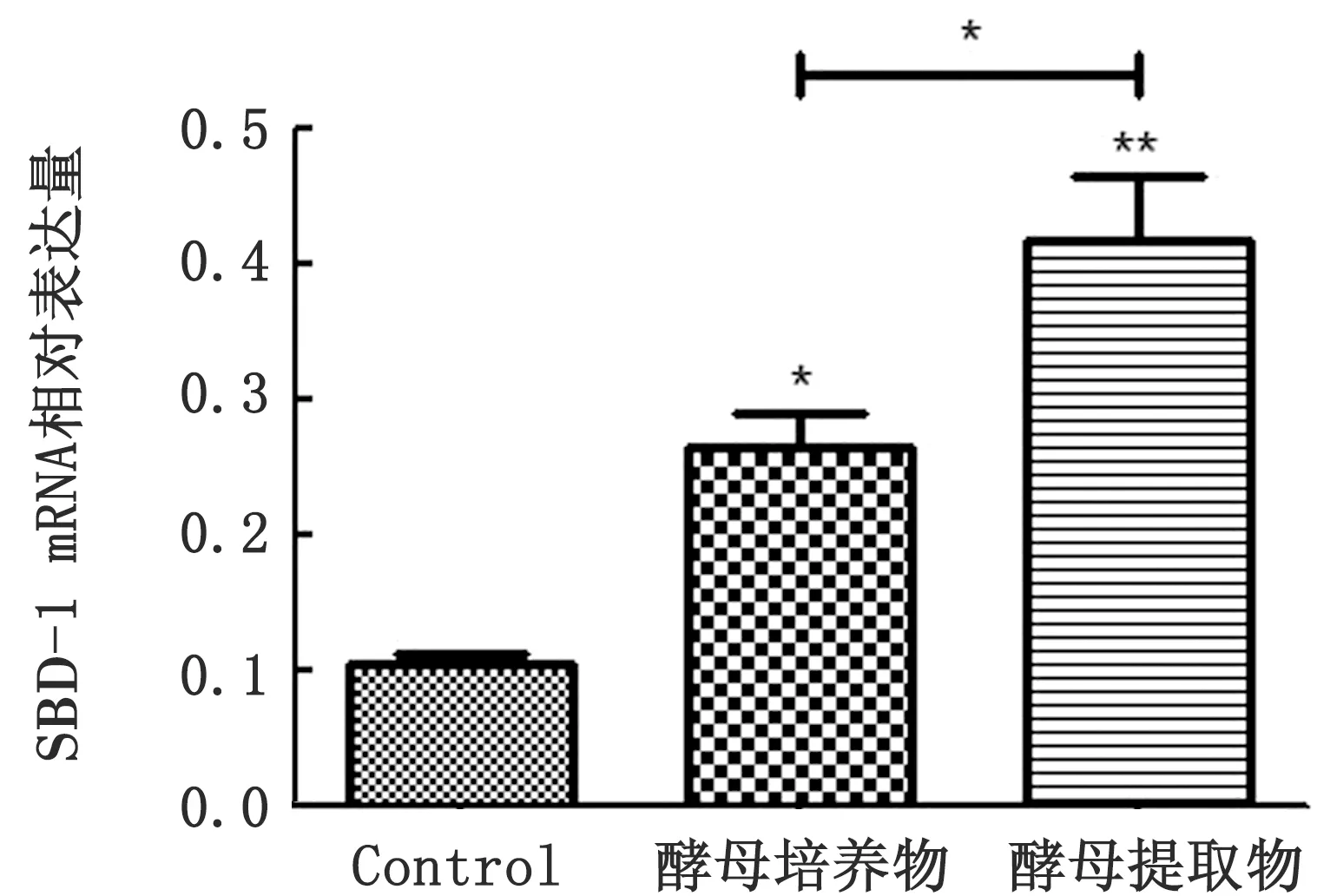
图6 酿酒酵母培养物和提取物诱导ORECs SBD-1 mRNA表达的比较 *.P<0.05;**.P<0.01
酿酒酵母培养物和提取物分别是酿酒酵母细胞胞外代谢产物和胞内提取物,有不少体内试验研究报道,酵母培养物和酵母提取物被哺乳动物、禽类和虾摄入后,能够改善摄入者生长性能,促进胃肠道对营养物质的消化吸收,并增强机体非特异性免疫和降低死亡率[20-23]。张洪勤等[24]使用地塞米松建立免疫损伤小鼠模型,并用酵母提取物治疗后发现,小鼠胸腺细胞凋亡被抑制。在体外细胞试验中,JENSEN等[25]的研究结果表明酵母培养物(益康XP)能够活化NK细胞和NKT细胞,并诱导B淋巴细胞上的CD80和CD86表达。然而,有关酵母培养物和酵母提取物与防御素表达的关系却少见报道。为了解酿酒酵母培养物和提取物质量浓度和诱导时间与防御素表达之间的关系。本试验以体外培养的ORECs为研究对象,即可有效避免活体胃肠道内复杂环境对试验的影响,又能够节约试验成本。并使用qPCR方法从基因层面对SBD-1 mRNA表达进行检测,结果显示,酿酒酵母培养物和提取物均能够诱导SBD-1 mRNA表达,表达量与刺激物及其质量浓度、诱导时间有关。当酿酒酵母培养物质量浓度为400 mg/L、酿酒酵母提取物质量浓度为200 mg/L 分别诱导细胞6 h时SBD-1 mRNA表达量达到最高。这一结果表明,酿酒酵母培养物和提取物能够作为诱导剂,诱导上皮细胞内防御素表达。但其具体作用机制和作用成分仍不确定,有待进一步研究分析。
本试验通过体外细胞试验证明酿酒酵母培养物提取物均能够诱导SBD-1 mRNA表达,且当酿酒酵母培养物质量浓度为400 mg/L、酿酒酵母提取物质量浓度为200 mg/L分别诱导细胞6 h时SBD-1 mRNA表达量达到最高。其中,酿酒酵母提取物诱导效果优于酿酒酵母培养物。
