砷暴露对蛋鸡肾脏的毒性损伤及硫辛酸的保护效应
2020-09-25陈大伟马丽娜刘茵茵王倩倩蒲俊华陆俊贤葛庆联唐修君高玉时
陈大伟,马丽娜,刘茵茵,王倩倩,蒲俊华,陆俊贤,葛庆联,唐修君,高玉时*
(1.江苏省家禽科学研究所 农业农村部禽类产品质量安全风险评估实验室,江苏 扬州 225125;2.扬州市畜牧兽医站,江苏 扬州 225009)
砷(arsenic,As)是一种类金属元素,以化合物的形式广泛存在于地表、土壤、水、大气、食物及生物体内。此类化合物被美国毒物与疾病登记署(ATSDR)列为毒性最危险的化合物。饮用水中含砷量过高、食物受到砷的污染、燃烧含砷量高的煤等均容易导致地方性砷中毒;砷矿开采和冶炼、含砷农药的使用、砷元素及化合物的生产,是职业性砷中毒的主要途径[1-3]。据报道,长江中游荆江航道工程水域范围内饮用水源地水中砷为主要风险因子,个别工程河段水域范围内饮用水源地水中砷超过国际辐射防护委员会(ICRP)推荐的可接受值(5.0×10- 5/年),表明砷污染极为广泛[4]。砷的毒性与其化学形态密切相关,无机砷在自然界和机体内部发生氧化、还原、甲基化、糖基化等一系列变化,形成不同形态的有机砷。有机砷无毒或毒性较小,无机砷毒性较强。砷的毒性研究主要针对无机砷。目前,砷化合物对生物体的致毒机制尚未完全阐明,作为一种外源性物质,砷进入生物体后随血液循环参与到生命活动中,通过对代谢酶、脂质过氧化、基因损伤、基因表达等方面的影响而发挥其毒性作用。砷进入机体后引起肾脏损伤,造成肾功能障碍。但相关研究主要集中在哺乳类动物,砷对家禽肾脏毒性研究报道较少。
α-硫辛酸(α-lipoic acid,ALA)是一种存在于线粒体的辅酶,属于B族维生素中的一类化合物,能消除导致加速老化与治病的众多活性氧自由基(reactive oxygen species,ROS),作为金属螯合剂减轻重金属离子对机体的氧化损伤;还能参与体内其他抗氧化剂的再生,因此有“万能抗氧化剂”的美誉。硫辛酸在体内经肠道吸收后进入细胞,兼具脂溶性与水溶性的特性,使其能够在细胞内外发挥抗氧化作用[5-6]。硫辛酸目前较多被应用在人类慢性疾病如糖尿病的辅助治疗方面[7],但硫辛酸对家禽重金属中毒的保护效果尚未见报道。因此,本试验通过饲料途径进行无机砷暴露,同时在饲料中添加硫辛酸探讨硫辛酸对砷暴露蛋鸡肾毒性损伤的保护效应,旨在为砷中毒特效解毒剂的研发提供一定的理论依据。
1 材料与方法
1.1 试验动物试验选用健康42周龄京粉2号商品代蛋鸡共360只,由扬州翔龙禽业有限公司提供,饲养地点为农业部家禽品质监督检验测试中心(扬州)家禽生产性能测定站。
1.2 主要试剂α-硫辛酸(α-LA)购自北京索来宝科技有限公司;三氧化二砷( As2O3) 购自国药集团试剂有限公司。
1.3 动物分组与处理将360只42周龄京粉2号商品代蛋鸡随机分为4组,每组3个重复,每个重复30只。对照组饲喂基础饲粮、α-硫辛酸组(α-LA组)饲料中添加α-LA 400 mg/kg、砷组(As组)添加As2O3200 mg/kg 、砷与α-硫辛酸共处理组(As+α-LA组)饲料中同时添加As2O3200 mg/kg和α-LA 400 mg/kg,基础日粮营养成分水平见表1。试验采用3层全阶梯笼养,每个重复单独给料,自由采食饮水,日常管理与免疫程序按常规进行,试验周期为8周。
1.4 样品采集与处理染毒结束后颈动脉放血处死蛋鸡,摘取肾脏,去除脂肪和筋膜后,准确称取0.2 g 肾组织,加入0.1 mol/L磷酸盐缓冲液,冰浴条件下用高速电动匀浆机制备10%组织匀浆,待测。另取部分肾脏组织用料理机绞碎,混匀,称取0.3 g样品,采用微波消解法消化(硝酸、过氧化氢均为优级纯),赶酸至近干后超纯水(18.2 MΩ)定容至25 mL,置4℃待测。
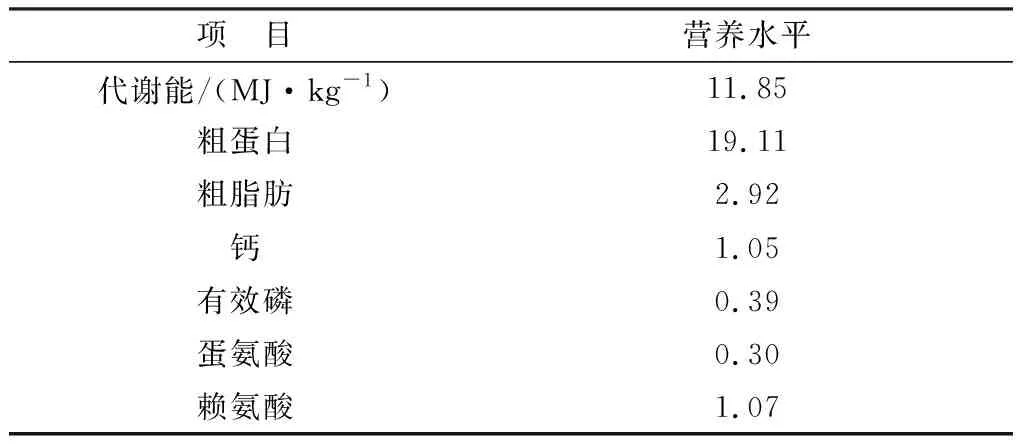
表1 基础日粮营养水平 %
1.5 检测指标与方法
1.5.1肾脏脂质过氧化指标测定 主要测定肾组织中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、还原型谷胱甘肽(GSH)、丙二醛(MDA)。测定方法分别为黄嘌呤氧化酶法、二硫代二硝基苯甲酸比色法、二硫代二硝基苯甲酸比色法、硫代巴比妥酸比色法,操作按照试剂盒(南京建成生物工程研究所)说明书进行。
1.5.2肾脏中微量元素含量测定 采用电感耦合等离子质谱仪(X seriesⅡ,美国Thermo scientific)测定消化液中砷、铜、铁、锌、硒含量,采用在线加入内标的方式测定,内标元素包括Y、Tb、In、B、Sc。钙含量测定采用火焰原子吸收光谱法(AA800,美国Perkin Elmer),具体步骤参照GB5009.92-2016 食品安全国家标准进行。
1.5.3肾脏病理切片观察 常规方法制作病理切片,样品经4%中性甲醛液固定,常规脱水、石蜡包埋及切片,HE染色,光学显微镜观察拍照。
1.5.4肾脏超微结构观察 处死蛋鸡后立即采集肾组织并用锋利的刀片切成约1 mm3小块,用新鲜配制的25 g/L戊二醛溶液固定后,按常规方法经四氧化锇固定、系列丙酮脱水、包埋等步骤处理后制备超薄切片,在JEM-100CXⅡ型透射电镜(Philips公司)下观察并拍照。
1.6 数据处理运用SPSS22.0统计软件对数据进行显著性t检验和单因素方差(ANOVE) 统计分析,P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果
2.1 肾脏组织抗氧化指标肾脏抗氧化指标检测结果见表2。与对照组比较,As组和As+α-LA组SOD、GSH-Px活性和GSH含量均显著或极显著降低(P<0.05或P<0.01),MDA含量显著或极显著升高(P<0.05或P<0.01)。与As组比较,As+α-LA组GSH-Px、SOD活性、GSH含量显著升高(P<0.05),MDA含量显著降低(P<0.05)。其中,As和As+α-LA组SOD活性分别低于对照组27.15% 和14.80%,GSH-Px活性分别低于对照组42.59% 和23.43%,GSH含量分别低于对照组38.22% 和23.46%,MDA含量分别高于对照组50.73% 和25.97%;表明砷暴露使蛋鸡肾脏发生脂质过氧化损伤,且硫辛酸能缓解砷暴露引起的氧化损伤。

表2 肾脏组织中抗氧化指标的变化
2.2 肾脏微量元素测定结果肾脏微量元素变化见表3。与对照组比较,As组钙、硒、锰含量极显著降低(P<0.01),铁、砷含量极显著升高(P<0.01),As+α-LA组钙含量显著下降(P<0.05),铁含量显著升高(P<0.05);α-LA组铁和锌含量极显著降低(P<0.01),硒含量显著升高(P<0.05),钙、铜、锰差异不显著。与As组比较,As+α-LA组钙、锌、硒、锰含量显著回升(P<0.05),砷残留量显著降低(P<0.05)。
2.3 肾脏病理组织切片观察结果病理切片观察结果见图1。对照组和α-LA组肾脏肾小球和肾小管结构正常,As组呈肾小球肾炎样病变,小血管扩张充血,肾小管腔内可见不同程度的管型。As+α-LA组病变较轻,肾小囊腔内可见蛋白性物质沉淀。
2.4 肾脏超微结构观察结果肾脏超微结构观察变化结果见图2。对照组肾小管上皮微绒毛排列整齐,结构致密;As+α-LA组与之类似;As组微绒毛排列较为稀疏、凌乱,部分微绒毛断裂(图中黑色方框所示),表明砷暴露引起了肾小管重吸收功能损伤。对照组线粒体膜结构清晰完整,呈长条形,胞浆中无溶酶体;As组线粒体结构基本完整,圆形线粒体比较较高,溶酶体较多(黑色细箭头所示),部分线粒体呈空泡化(黑色粗箭头所示),部分细胞呈染色质边集现象(红色箭头所示)。硫辛酸保护组(As+α-LA)微绒毛部分稀疏,线粒体结构完整,染色质分布均匀。
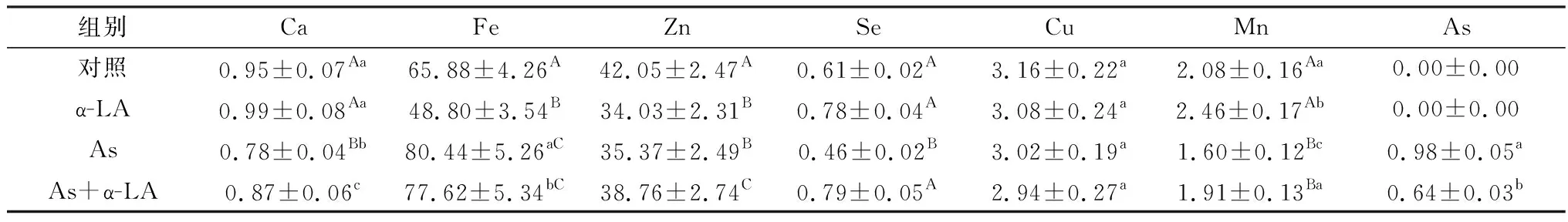
表3 肾脏中微量元素含量变化 mg/kg
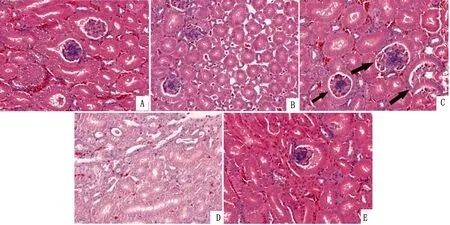
图1 肾脏病理切片观察 A.对照组;B.α-LA组;C,D.As组;E.As+α-LA组

图2 蛋鸡肾脏超微结构观察 A,D.对照组,B,E.α-LA组;C,F,G.As组;H,I.As+α-LA
3 讨论
砷是一种具有还原活性的金属,砷通过在细胞内诱导产生活性氧损伤组织器官,最终导致砷中毒甚至肿瘤的发生[8]。肾脏是砷毒性作用的重要靶器官[9],砷进入机体后引起肾脏损伤,造成肾功能障碍。人类砷暴露后的砷损伤主要表现为肾小球体积增大,毛细血管扩张充血,间质细胞浸润,近曲小管肿胀变形及脂肪变性[10]。啮齿类动物砷暴露后尿β2-微球蛋白(β2-MG) 、尿微量白蛋白( mALB) 、尿-N-乙酰-β-D-氨基葡萄糖苷酶( NAG) 水平随砷剂量的增加而上升,尿砷与上述肾功能指标间存在明显的剂量-效应关系[11]。砷对家禽毒性研究主要集中在免疫系统,砷暴露引起的氧化应激抑制了凋亡抑制基因的表达,同时提高了其他线粒体凋亡相关基因的表达,从而导致鸡免疫器官细胞凋亡[12]。
本试验结果表明,蛋鸡砷暴露后肾脏产生了肾小球肾炎样病变,表现为小血管扩张充血,肾小管腔内可见不同程度的管形,表明砷暴露引起了蛋鸡肾脏功能的损伤。氧化应激反应是砷毒性机制中被接受和研究最广泛的一种,表现为ROS的生成[13]。氧化应激反应有2个主要机制,抗氧化物质浓度的降低及抗氧化物质摄入的减少[13]。本试验结果表明,砷暴露引起蛋鸡肾脏抗氧化酶活性降低,脂质过氧化产物MDA含量显著增加,这也再次证明氧化应激是砷毒性的重要机制。
基础微量元素在动物体内广泛的生理过程中发挥着重要作用,近百种酶需要矿物元素作为活性中心[14]。矿物元素处于最佳含量水平对动物和人类健康有非常重要的作用。干扰实质器官微量元素平衡是高浓度砷暴露的毒性机制之一,如对鸡进行高浓度砷暴露后发现肾脏铝、钾、钙、铬、锰、镍、锑、钡含量显著下降,钼、砷镉含量显著升高。硒、锌含量有下降的趋势,铁含量有升高的趋势,但差异不显著[15]。本试验结果表明,砷暴露引起蛋鸡肾脏钙、锌、硒、锰含量均显著下降,铁、砷含量显著升高。与上述研究结果趋势基本类似,仅个别元素差异显著性上有不同,这可能是由于砷暴露浓度和时间不同造成的。锌、硒分别是SOD和GSH-Px抗氧化酶活性中心,肾脏中锌、硒含量的下降必然引起抗氧化酶活性的降低。铁元素具有独特的化学反应活性,并且在能量代谢、细胞增殖和DNA修复中起着重要所用[16-18]。但是,过多的自由铁却可以通过催化Fenton反应生成具有高度反应活性的羟自由基,导致氧化应激,从而损害机体的一些基本成分,如脂质、蛋白、DNA等,最终导致细胞损伤和凋亡[19-20]。铁代谢异常被证实与多种肾脏疾病有关[21]。本试验结果表明,砷组肾脏铁含量显著升高,一定程度上可能加重氧化应激损伤。超微结构观察结果进一步验证了上述结果发生的原因,砷组肾小管管形的产生与肾小管上皮微绒毛断裂关系密切;而线粒体空泡化以及染色质边集则表明氧化应激引起了蛋鸡肾脏细胞凋亡,这与体外研究结果一致[22]。
添加硫辛酸部分恢复了抗氧化酶的活性,同时减少必需微量元素的损失,降低了组织铁负荷,原因可能是因为α-硫辛酸含有双硫五元环结构,电子密度很高,具有显著的亲电子性和与自由基反应的能力,从而发挥了抗氧化性,但硫辛酸引起组织铁含量降低的具体机制有待进一步研究。此外,硫辛酸的巯基很容易进行氧化还原反应,故可保护巯基酶免受砷离子的毒害,保护肾脏微量元素的平衡。
综上所述,砷暴露引起的脂质过氧化损伤和微量元素稳态失衡是砷造成蛋鸡肾毒性损伤的主要机制,硫辛酸通过抗氧化特性保护肾脏氧化酶活性,减少砷在肾脏中的蓄积并减少微量元素钙、锌、硒、锰的流失,增加铁的排出来缓解砷的毒性损伤。硫辛酸对砷暴露引起的蛋鸡肾脏毒性损伤具有一定的保护效应。
