高铜对大鼠脾脏NFκB信号通路及相关炎性因子表达的影响
2020-09-25常晓月余文兰廖建昭裴若男杨艳阳邓纪昌黄坤玄唐兆新
常晓月,余文兰,廖建昭,杨 帆,2,裴若男,杨艳阳,邓纪昌,黄坤玄,唐兆新*
(1.华南农业大学 兽医学院,广东 广州 510642;2.江西农业大学 动物群发性疾病监测与防控研究所,江西 南昌 330045)
核因子-κB(nuclear factor-κB,NFκB)广泛存在于机体的各种细胞中,是调节细胞反应中“快速作用”的初级转录因子[1]。作为细胞内的重要转录因子,NFκB在免疫反应、炎症反应、细胞凋亡、肿瘤发生等多种生理病理进程起着关键性作用,影响着细胞的生存、分化、增殖和死亡[2-5]。NFκB的激活可以促进炎症相关因子的释放,目前已知的NFκB激活因子有很多,包括TNF-α、iNOS、趋化因子及白细胞介素(IL)等[6]。正常生理状态下,NFκB位于细胞浆内,而当受到外源刺激或者各种表面活性剂的活化后,细胞内NFκB可发生核转位,从而导致NFκB磷酸化为phos-NFκB并诱导靶基因发生转录以及信号的传导[7-8]。相关研究表明,IL-1β和TNF-α活化NFκB,并参与NFκB的正反馈调节,phos-NFκB亦可持续增强IL-1β和TNF-α基因的转录[9],并进一步促进炎性因子IL-6、IL-2及IL-1β的释放。
铜作为生命机体必需的微量元素之一,缺少或者过量都会引起机体发生代谢障碍。然而随着土壤和水体的重金属污染,饲料中铜的过量添加,导致铜在机体的过度蓄积并造成毒性损伤[10]。目前,关于高铜的研究大多集中在大脑、肝脏和肾脏。已有研究表明,铜对动物机体的免疫功能具有一定的调节作用。脾脏作为机体的免疫器官,目前尚未见高铜对大鼠脾脏免疫机能调节及机制的相关研究报道。本试验通过饲喂SD大鼠高铜日粮,探讨高铜对大鼠脾脏NFκB信号通路及相关炎性因子表达的影响,为研究高铜对机体脾脏免疫毒性机理奠定基础。
1 材料与方法
1.1 试验动物及处理24只8月龄SD大鼠,购于广东省医学实验动物中心。将试验鼠随机分为3组,每组8个重复。选用碱式氯化铜作为铜源添加到日粮中,根据实验动物饲料营养标准GB14924.3-2010,对照组日粮铜含量设为15 mg/kg,高铜组铜含量依次倍比添加:高铜Ⅰ组日粮铜含量为30 mg/kg,高铜Ⅱ组日粮铜含量为60 mg/kg。在相同条件下饲喂大鼠24周后,用0.4%戊巴比妥按30 mg/kg安乐死,采集脾脏组织,用磷酸盐缓冲液(phosphate buffer solution,PBS)清洗后,一部分置于预先去酶处理的离心管中,于-80℃冻存;另一部分切成5 mm×5 mm的块状用4%的多聚甲醛固定,室温保存用于后续的病理组织切片试验。
1.2 主要试验试剂和仪器BCA工作液、Trizol、Beyo ECL发光显色液购自Beyotime公司;PrimeScriptTMRT reagent kit with gDNA Eraser购自TaKaRa公司;2×ChamQ Universal SYBR qPCR Master Mix购自南京诺唯赞生物科技有限公司;甲醇(分析纯)购自广州化学试剂厂;碱式氯化铜购自天津市大茂化学试剂厂;Prontein Marker购自SMOBIO公司;SDS-PAGE Loading Buffer购自康为世纪;基因引物购自上海生工生物工程股份有限公司;96孔荧光定量板购自Anxgen公司;LightCycler480型荧光定量PCR仪购自美国Roche公司;ELx808型酶标仪购自美国Bio Teck公司。
1.3 大鼠脾脏组织铜含量检测采用ICP-MS检测大鼠脾脏组织中蓄积的铜含量,检测标准参考GB 5009.268-2016。经过样品消解、标准曲线的绘制,在ICP-MS工作参数最佳条件下,对样品进行测定,平行测定2次,取平均值。
1.4 脾组织形态学观察将固定好的脾脏组织块样经过冲水、脱水、包埋后,制作石蜡切片,苏木精-伊红(HE)染色,并于光学显微镜下观察其组织形态的变化。
1.5 实时荧光定量检测NFκB信号通路及其相关炎性因子mRNA的表达用Trizol试剂盒提取总RNA,并用核酸蛋白仪检测其浓度与纯度。将样品RNA稀释至统一质量浓度500 mg/L,反转录后将cDNA稀释8倍进行RT-qPCR反应。反转录与PCR反应条件严格按照Trizol试剂盒说明书进行。基因序列从GenBank中获取,并以管家基因GAPDH作为内参基因。RT-qPCR反应引物序列由Primer Express6.0软件设计,并由上海生工生物工程有限公司(广州合成部)合成,引物序列见表1。
采用实时荧光定量PCR(RT-qPCR)技术检测NFκB、TNF-α、IL-1β、IL-2、IL-6、IL-10 mRNA的表达情况。RT-qPCR反应体系为2×ChamQ Universal SYBR qPCR Master Mix 5 μL,Primer Forward 0.4 μL,Primer Reverse 0.4 μL,ddH2O 3.2 μL,cDNA 1 μL。反应条件:预变性95℃ 30 s;95℃ 5 s,60℃ 30 s,进行40个循环,60℃时收集荧光。试验结果用2-ΔΔCt法分析NFκB、TNF-α、IL-1β、IL-2、IL-6和IL-10的mRNA转录水平。

表1 引物序列
1.6 NFκB信号通路及其相关炎性因子蛋白相对表达量的测定采用免疫印迹法检测大鼠脾脏NFκB、phos-NFκB和IL-1β蛋白相对表达量。BCA试剂盒测定蛋白总量,将蛋白质量浓度统一为1 g/L后,进行凝胶电泳、转膜。将含有蛋白的PVDF膜经PBS清洗3遍后,5%脱脂奶粉封闭2 h,一抗4℃孵育过夜,二抗室温孵育2 h,封闭、孵育前后均用PBS清洗3遍。ECL发光显色液处理后,采集图像,Image J软件进行灰度值分析,并用Graphpad prism6软件作图。
2 结果
2.1 大鼠脾脏组织铜含量检测结果高铜处理组大鼠脾脏组织铜含量随日粮铜含量的增加呈上升趋势,高铜Ⅰ组和高铜Ⅱ组大鼠脾脏组织铜含量与对照组相比显著升高(P<0.05)(表2)。

表2 大鼠脾脏组织铜含量 mg/kg
2.2 高铜对大鼠脾脏组织学形态/结构的影响对照组脾脏组织结构清晰,未见明显病变。与对照组相比,高铜Ⅰ组与高铜Ⅱ组大鼠脾脏脾小体体积增大,生发中心形成,淋巴细胞增生(图1)。
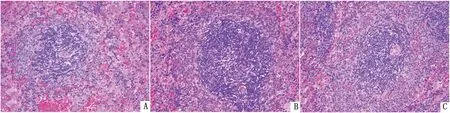
图1 高铜对大鼠脾脏组织学形态结构的影响 A.对照组;B.高铜Ⅰ组;C.高铜Ⅱ组
2.3 高铜对大鼠脾脏NFκB通路相关炎性因子mRNA表达量的影响与对照组相比,随着日粮中铜含量的升高,高铜组大鼠脾脏中的NFκB、TNF-α、IL-1β、IL-2和IL-6等相关炎症因子mRNA的表达量均呈升高趋势,而高铜组脾脏IL-10 mRNA的相对表达量与对照组相比呈下降趋势。其中,高铜Ⅰ组和高铜Ⅱ组大鼠脾脏NFκB、TNF-α、IL-1β、IL-2和IL-6 mRNA的相对表达量与对照组相比显著上升(P<0.05),高铜Ⅱ组脾脏IL-10 mRNA的相对表达量与对照组相比显著降低(P<0.05)(图2)。
2.4 高铜对大鼠脾脏NFκB信号通路及其相关炎性因子蛋白表达量的影响高铜Ⅰ组和高铜Ⅱ组大鼠脾脏中NFκB和phos-NFκB蛋白的相对表达量与对照组相比显著升高(P<0.05);与对照组相比,高铜组脾脏IL-1β的蛋白表达量显著上升(P<0.05)且随日粮铜含量的增加呈上升趋势(图3)。
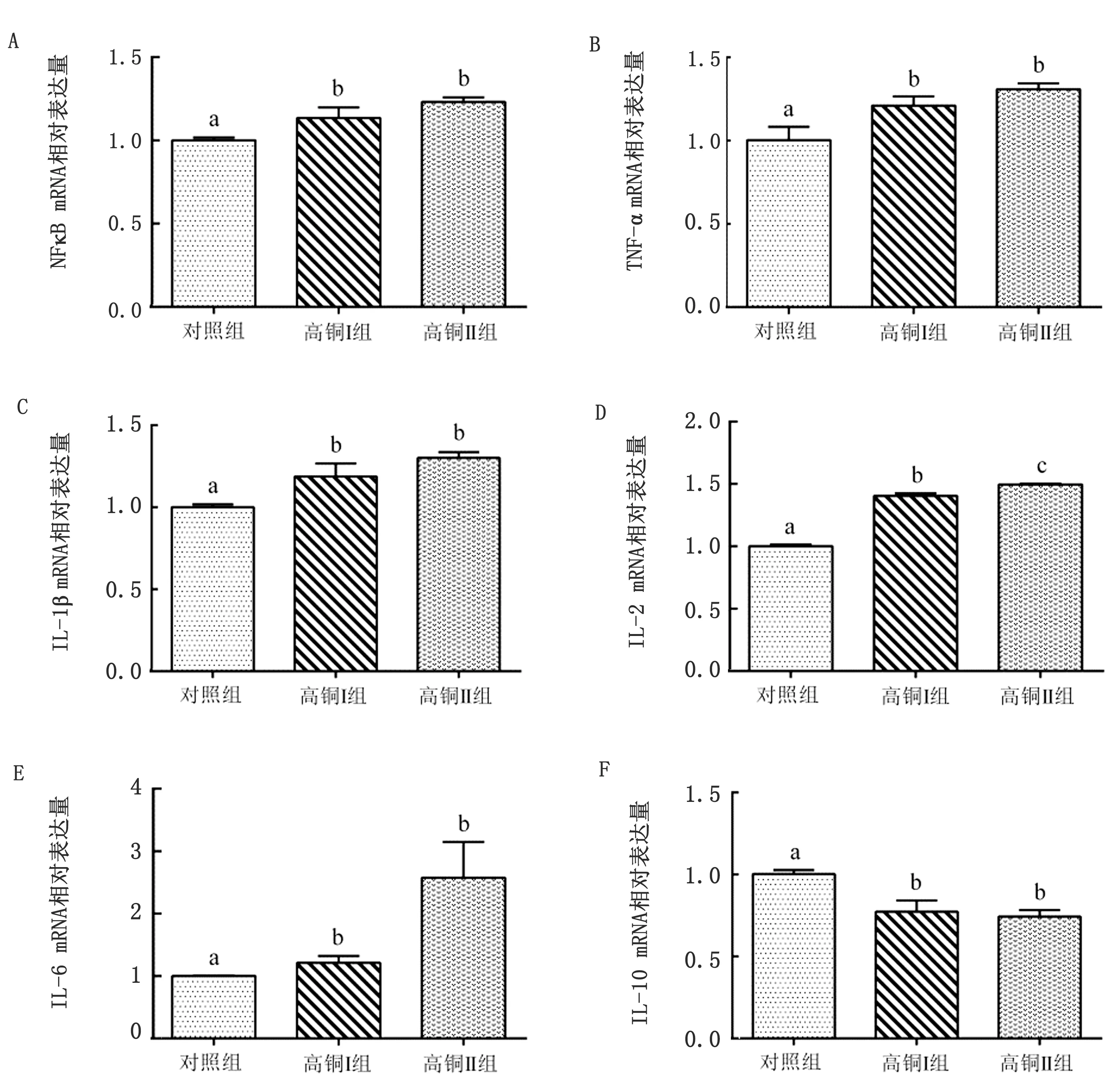
图2 高铜对大鼠脾脏NFκB信号通路相关炎性因子mRNA表达的影响 A.NFκB;B.TNF-α;C.IL-1β;D.IL-2;E.IL-6;F.IL-10
3 讨论
作为生物体必需的微量元素之一,铜以蛋白酶辅基的形式参与细胞呼吸、催化氧化、免疫调节以及神经调节等生理过程,影响着血管生成、骨再生和机体免疫力[11-12]。然而,过量的铜摄入会引起机体代谢絮乱,对机体多个组织脏器造成毒性损伤。有研究表明,高铜对雏鸭脾脏有毒性损伤作用[13]。在本试验中,与对照组相比,高铜Ⅰ组与高铜Ⅱ组大鼠脾脏脾小体体积增大,生发中心形成,淋巴细胞增生,说明高铜可诱导大鼠脾脏产生病理损伤。
NFκB是从B细胞核提取的一种核蛋白因子,通常以异二聚体与免疫球蛋白κ轻链基因的增强子κB序列特异结合为复合物IBs,从而掩盖NFκB的核定位序列。当细胞受到刺激时,导致复合物IBs磷酸化并通过泛蛋白体系降解,释放的NFκB可以自由移动进入细胞核,从而激活NFκB信号通路参与细胞免疫、炎症反应和细胞增殖等生理病理过程[14-15]。在本研究中,高铜Ⅰ组和高铜Ⅱ组NFκB mRNA相对表达量和NFκB蛋白、phos-NFκB蛋白相对表达量与对照组相比显著升高,说明高铜可诱导大鼠脾脏NFκB的转录与活化。
NFκB信号在调节炎症反应时,既有细胞刺激因子的正反馈调节也有NFκB信号通路中下游调控因子的负反馈调节。KITAZAWA等[16]对铜暴露扰乱大脑炎症反应的研究中发现,高铜可以促使损害淀粉样蛋白的清除,促进炎性因子IL-1β、IL-6、TNF-α、IL-10的释放。TNF在介导免疫反应、调节免疫机能方面起着重要的作用,TNF可反馈性地增加NFκB的表达而扩大炎症反应[17-19]。CHTOUROU等[20]研究表明,通过抑制NFκB和TNF-α,可减轻炎症反应、减少凋亡介质,增强组织的抗氧化能力。在炎症反应时,IL-2可促进免疫细胞增值,防止免疫过度对机体造成地损伤;IL-6作为多效性致炎因子,对机体免疫反应具有调节作用,是机体持续存在炎症的标志之一。IL-10可以通过抑制多种炎性因子的合成发挥抗炎作用,是炎症反应的有效调节剂。在本试验中,首先对大鼠进行了脾脏铜含量的检测,并对大鼠脾脏NFκB信号通路相关炎性因子进行检测,结果显示高铜Ⅰ组和高铜Ⅱ组中IL-1β、TNF-α、IL-2、IL-6 mRNA相对表达量和IL-1β蛋白相对表达量与对照组相比显著升高,并与NFκB mRNA和蛋白相对表达量呈正相关;高铜Ⅰ组和高铜Ⅱ组IL-10 mRNA相对表达量与对照组相比显著下降(P<0.05),与IL-1β、TNF-α、IL-2、IL-6等炎性因子呈负相关。综上所述,高铜可诱导大鼠脾脏NFκB信号通路相关炎性因子的表达。
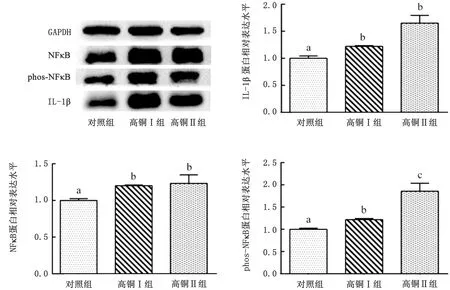
图3 高铜对大鼠脾脏组织NFκB信号通路相关蛋白表达的影响 A.印迹图;B,C,D.柱状图
