大鼠肝细胞系lncRNA NONRATT021477.2过表达及干扰表达条件优化
2020-09-25牛春阳薛琳琳詹雪龙邵子益郭景茹李士泽杨焕民
牛春阳,薛琳琳,詹雪龙,徐 晶,邵子益,郭景茹,甄 莉,计 红*,李士泽,杨焕民
(1.黑龙江八一农垦大学 动物科技学院,黑龙江 大庆 163319;2.黑龙江职业学院,黑龙江 双城 150111)
近年来的全基因组分析显示,由哺乳动物基因组转录而来,长度大于200个核苷酸的长链非编码RNA(lncRNA)在基本细胞过程中发挥作用,如Xist、MALAT1和NEAT1[1-3]。这类调节RNA可能对细胞的正常功能至关重要,也可能影响高等真核细胞基因组的复杂性。研究表明,lncRNA参与调控细胞分化和个体发育等多个方面的重要生命过程。例如,lncRNA参与X染色体沉默过程[4]、染色体修饰[5]、基因组修饰[6]、转录激活[7]、转录干扰[8]和核转运[9]等。lncRNA也与人类主要疾病密切相关。据报道,lncRNA的过表达与某些癌症相关,包括乳腺癌、前列腺癌和白血病等[10-12]。lncRNA在免疫系统中起到重要作用,证实lincRNA-EPS可以抑制转录并在抑制炎症中发挥作用。此外,lncRNA还可以调节干细胞的分化[13],如Pnky是一种新发现的lncRNA,存在于小鼠和人脑的神经干细胞中。多项研究表明,lncRNA与应激密切相关。应激相关的lncRNA在细胞调节网络中充当中枢,协调不同网络内和不同网络之间成员的活性,以维持细胞稳态用于存活或触发细胞死亡[14]。
虽然过去几年对lncRNA的探索取得了很大进展,但大多数lncRNA的生物学功能仍然没有研究,关于lncRNA NONRATT021477.2(简称lncRNA77.2)的研究更是鲜见。为了深入研究lncRNA77.2在大鼠肝细胞氧化应激中的作用,在前期试验中,我们通过cDNA末端快速扩增技术(rapid amplification of cDNA ends,RACE)扩增出lncRNA77.2全长cDNA序列,长度为746 bp;并且已经应用荧光原位杂交(fluorescenceinsituhybridization,FISH)技术检测出lncRNA77.2在BRL细胞中的亚细胞定位,发现其主要在细胞核内表达,极少量在细胞质表达。因此一般的siRNA或者shRNA方法可能对本研究的基因沉默试验不适用,而经过特殊修饰的反义核苷酸(ASO)可以成功进入核内,从而达到敲低目的。本试验旨在建立lncRNA77.2过表达慢病毒质粒及ASO干扰表达质粒转染BRL细胞的最佳条件,为后续有关lncRNA77.2的功能研究奠定基础。
1 材料与方法
1.1 载体和细胞过表达慢病毒载体pSllV-CMV-zsGreen-puro购自上海汉恒生物技术公司;重组慢病毒质粒pSllV-CMV-zsGreen-puro-lncRNA77.2由本实验室包装构建而成;ASO干扰质粒购自广州锐博生物技术公司,序列均经NCBI数据库检索证实与lncRNA77.2以外的已知大鼠基因无同源性;BRL细胞系购自中国科学院细胞资源库。
1.2 主要试剂与仪器DMEM高糖培养基(Gibco,美国),胎牛血清(QuaCell,南美),胰酶(Solarbio,北京),riboFectTMCP Transfection试剂盒(锐博生物,广州),极速RNA提取试剂盒(HaiGene公司,哈尔滨),一步法反转录试剂盒(TaKaRa,日本),lncRNA77.2引物、GAPDH引物(上海生工公司合成)。微量电动移液器(Gilson,法国),Nanodrop2000核酸蛋白定量仪(Thermo Fisher Scientific,美国),低温高速大型离心机(Hitachi,日本),荧光倒置显微镜(Nikon,日本),细胞培养箱(Binder,德国),CFX96型荧光定量PCR仪(Bio-Rad,美国)。
1.3 BRL细胞培养将细胞从液氮中取出后,置于37℃恒温水浴锅中摇动融化,转移至离心管中1 000 r/min离心4 min后去上清,用PBS悬浮细胞洗涤1次,再次离心去除上清,加入10% FBS细胞培养液混匀后转移到10 cm细胞培养皿。细胞37℃、5%CO2培养24 h后换液,待细胞贴壁生长铺满培养皿时传代。使用能稳定传3代且处于对数生长期的细胞进行后续试验。
1.4 细胞分组根据后期试验转染情况,过表达试验分为培养液组、空病毒NC组和慢病毒lncRNA77.2组。干扰试验设计有3条不同序列,分别为ASO-1、ASO-2和ASO-3,序列如表1所示。每条序列又设有4种不同浓度梯度,分别为100,200,250,300 nmol/L组,以及阴性对照ASO-NC组和培养液组。
1.5 慢病毒感染BRL细胞
1.5.1聚酰胺浓度筛选 聚酰胺(polybrene)是一种具有一定细胞毒性的多聚阳离子聚合物,广泛用于慢病毒介导的基因转染,以提高病毒感染效率。首先,在96孔板接种BRL细胞,细胞密度为5×104/孔,每孔100 μL。当细胞汇合率达到80%时,分别加入含质量浓度梯度为3,5,8 mg/L聚酰胺的FBS培养基进行筛选。每种质量浓度设3个重复孔,选择24 h 内对细胞无明显毒性的质量浓度为佳。

表1 寡反义核苷酸干扰序列及qPCR引物序列
1.5.2最佳感染复数(MOI)筛选 将生长状态良好的BRL细胞以5×104/孔接种于96孔板,当细胞汇合率达到30%~50%时,换加1/2体积(50 μL)含5 mg/L聚酰胺的培养基。按照MOI为0,1,2,4,8分别加入慢病毒和空病毒NC,根据公式MOI值 = 病毒滴度×病毒体积(mL)/细胞个数,慢病毒滴度为2.5×108,加入慢病毒的体积分别为0.2,0.4,0.8,1.6 μL;空病毒滴度为1×108TU/mL,加入空病毒的体积分别为0.5,1.0,2.0,4.0 μL,轻轻混匀,每个MOI数量级设3个重复孔。置于37℃、5% CO2细胞培养箱中培养,4 h后补齐培养基,24 h之后换液。感染48 h后,通过荧光显微镜观察GFP表达率,荧光率80%的孔对应的MOI即为最佳MOI。
1.5.3嘌呤霉素质量浓度筛选 将处于对数生长期的BRL细胞接种到24孔板,细胞密度为2×105/孔。待第2天细胞汇合率在70%时,换含不同质量浓度(2,4,6,8 mg/L)的嘌呤霉素培养基,取48~72 h 所有细胞死亡的最低质量浓度用于正式试验。
1.5.4慢病毒转染及稳定表达 将BRL细胞以2×106/孔接种至35 mm培养皿,待汇合率达到30%~50%时,换加含5 mg/L聚酰胺的培养基,加入筛选的最佳MOI病毒。置于37℃、5% CO2细胞培养箱中培养,4 h后补齐培养基,24 h之后换液。感染48 h 后,通过荧光显微镜观察GFP表达率。加入最佳质量浓度的嘌呤霉素筛选掉未感染病毒的细胞,空白皿中也加入最佳质量浓度的嘌呤霉素,待空白皿中所有细胞死完,用含嘌呤霉素的培养基继续培养1~2周,使细胞慢病毒感染稳定传代。将细胞扩大培养后冻存,获得过表达稳转株。
当慢病毒感染的时间达到48 h后,弃去慢病毒液,无菌PBS洗涤细胞2次;用胰蛋白酶消化贴壁细胞,1 000 r/min离心4 min收集细胞沉淀,加入20 μL PBS重悬沉淀,充分混匀。按照Haigene公司的极速RNA提取试剂盒提RNA,利用Nanodrop2000型核酸蛋白定量仪测定RNA浓度,应用1%琼脂糖凝胶电泳法,对所提取的RNA进行质量以及完整性检测。按照TaKaRa一步法反转录试剂盒说明书反转录cDNA,通过测定浓度判定DNA的品质后-20℃保存待用。
1.6 寡反义核苷酸感染BRL细胞
1.6.1接种细胞及质粒稀释 将生长状态良好的BRL细胞以合适比例(2×106/孔)接种到6孔培养板,使每孔细胞数均匀分布,使转染时的细胞密度能够达到30%~50%。冻干粉使用前需瞬时离心,配制成20 μmol/L储存液,即5 nmol ASO粉末中加入250 μL RNase-free H2O稀释,充分混匀后分装保存于-20℃。
1.6.2浓度梯度和时间曲线的优化 3条ASO质粒分别按照100,200,250,300 nmol/L的浓度转染BRL细胞,每个浓度设置3个复孔。具体配制严格按照锐博生物ASO说明书进行:用120 μL 1×riboFECTTMCP Buffer分别稀释10,20,25,30 μL的20 μmol/L RiboTMlncRNA77.2 ASO储存液,轻轻混匀;然后加入12 μL riboFECTTMCP Reagent,混合均匀后室温孵育15 min;最后将riboFECTTMCP混合液加到细胞培养基中,轻轻混匀。将培养板置于37℃的CO2培养箱中培养24~48 h,鉴定lncRNA77.2的表达效果,初步确定干扰效率最高的质粒及其最佳感染浓度。进一步优化最佳干扰序列的感染时间,分别设转染24,48 h后提取细胞RNA检测lncRNA77.2的表达量,筛选出干扰效率最高的干扰片段。
1.7 RT-PCR检测lncRNA77.2的表达效果根据lncRNA77.2序列设计RT-PCR的引物,引物由上海生工生物公司合成,其序列如表1。用特异性RT-PCR引物扩增靶基因,阴性对照为NC组,内参基因为GAPDH。按照2×Taq SYBR Green qPCR Mix试剂盒说明书操作,应用CFX96型荧光定量PCR仪检测lncRNA77.2的相对水平,每个样本平行做3个重复孔。过表达试验以空病毒NC和慢病毒lncRNA77.2感染靶细胞;干扰试验以ASO-1、ASO-2、ASO-3和对照ASO-NC分别感染靶细胞后获得的cDNA为模板,进行实时定量扩增。RT-PCR反应体系:cDNA模板1 μL,上、下游引物各0.5 μL,SYBR Premix Ex TaqⅡ10 μL,灭菌蒸馏水8 μL,共20 μL。反应条件:95℃预变性30 s;95℃ 5 s,56℃ 30 s,72℃ 20 s,共40个循环。利用前期构建的lncRNA77.2重组质粒、阴性对照重组质粒、阳性对照GAPDH进行双标准曲线法分析,得到各组细胞lncRNA77.2的相对表达量。
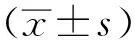
2 结果
2.1 慢病毒转染BRL细胞及稳定细胞系的筛选过表达慢病毒以MOI=4和MOI=8转染BRL细胞48 h后,转染重组质粒的细胞在倒置荧光显微镜下观察可见较强的绿色荧光表达,转染效率可达80%以上,而培养液组未见绿色荧光(图1)。考虑到病毒量过大对细胞的影响,选择MOI = 4组进一步筛选稳转株。经嘌呤霉素筛选后,细胞无明显形态学变化,生长良好,稳定持续表达绿色荧光(图2)。以上结果表明,过表达慢病毒成功转染BRL细胞,且获得高表达稳转株。
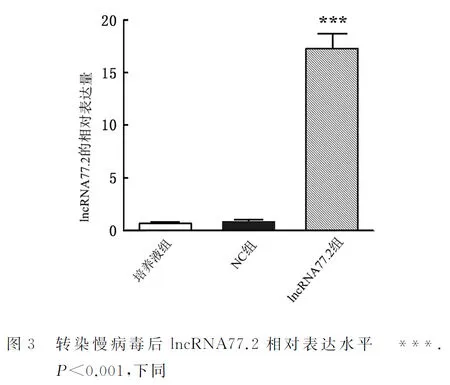
2.2 RT-PCR检测lncRNA77.2的表达情况通过RT-PCR对过表达慢病毒组、空病毒NC组及培养液组的lncRNA77.2水平进行检测。结果显示,与空病毒NC组、培养液组相比,慢病毒组细胞中lncRNA77.2的水平极显著升高,且差异有统计学意义(P<0.001)。lncRNA 77.2过表达慢病毒以MOI=4感染BRL细胞48 h后,过表达效果为17倍(图3)。
再对培养液组、ASO-NC组、各lncRNA77.2干扰组的相对表达量进行检测。结果显示,与ASO-NC组、培养液组相比,3条序列的200,250,300 nmol/L 组,包括ASO-3中100 nmol/L组的lncRNA77.2表达量均显著降低;而ASO-1和ASO-2的100 nmol/L组的相对表达量与对照ASO-NC组相比无显著性差异。ASO-1以250 nmol/L 浓度干扰效率最高,为54%(图4);ASO-2以250 nmol/L 浓度干扰效率最高,为72%(图5);ASO-3以100 nmol/L浓度干扰效率最高,为56%(图6);因此,初步筛选干扰质粒ASO-2以250 nmol/L 浓度转染BRL细胞敲低效果最好。图7所示,进一步优化时间曲线,确定了ASO-2序列以浓度250 nmol/L 转染BRL细胞24 h,对lncRNA77.2水平的干扰效率最高,为78%。
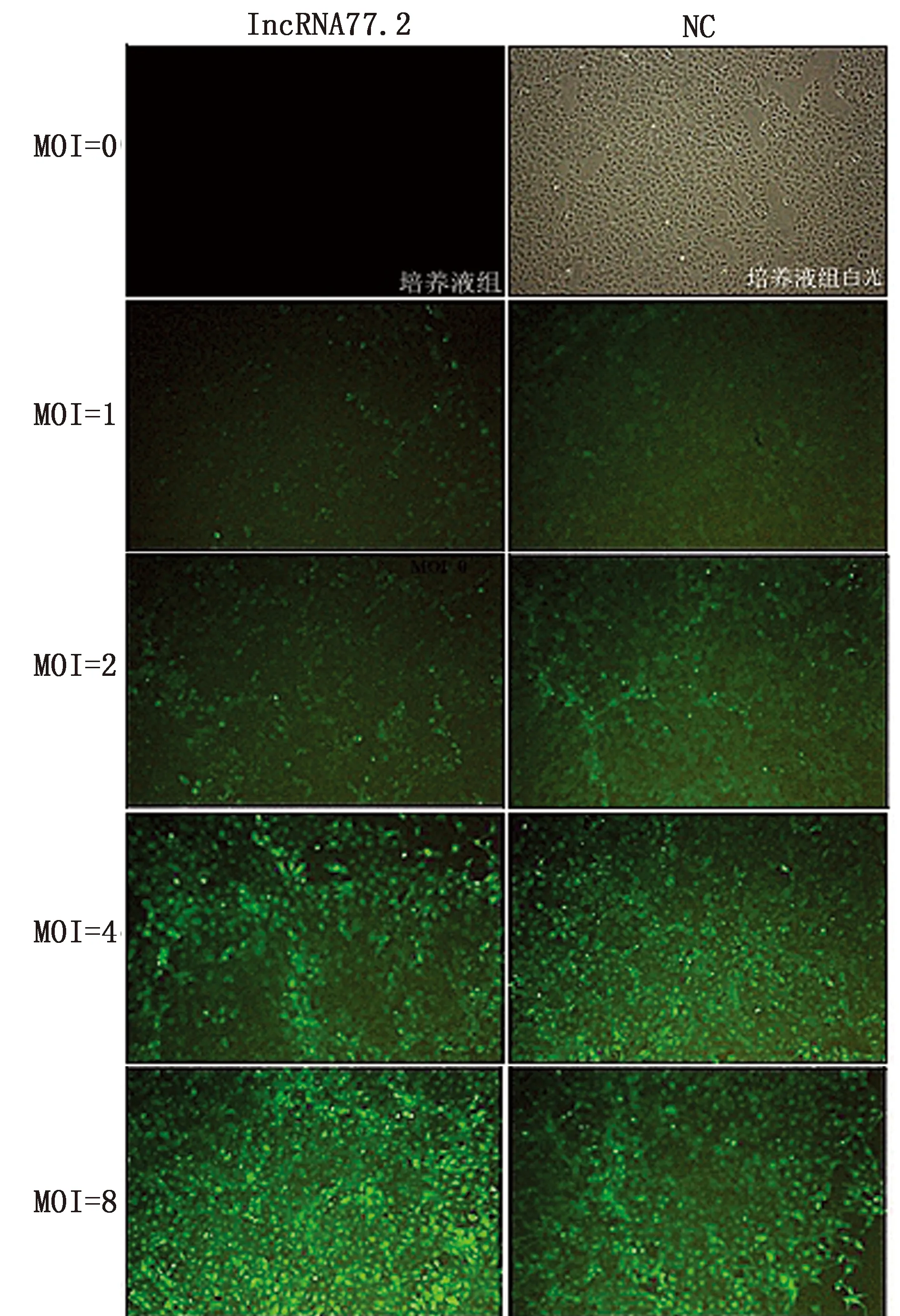
图1 不同MOI病毒转染BRL细胞后GFP蛋白表达情况(40×)
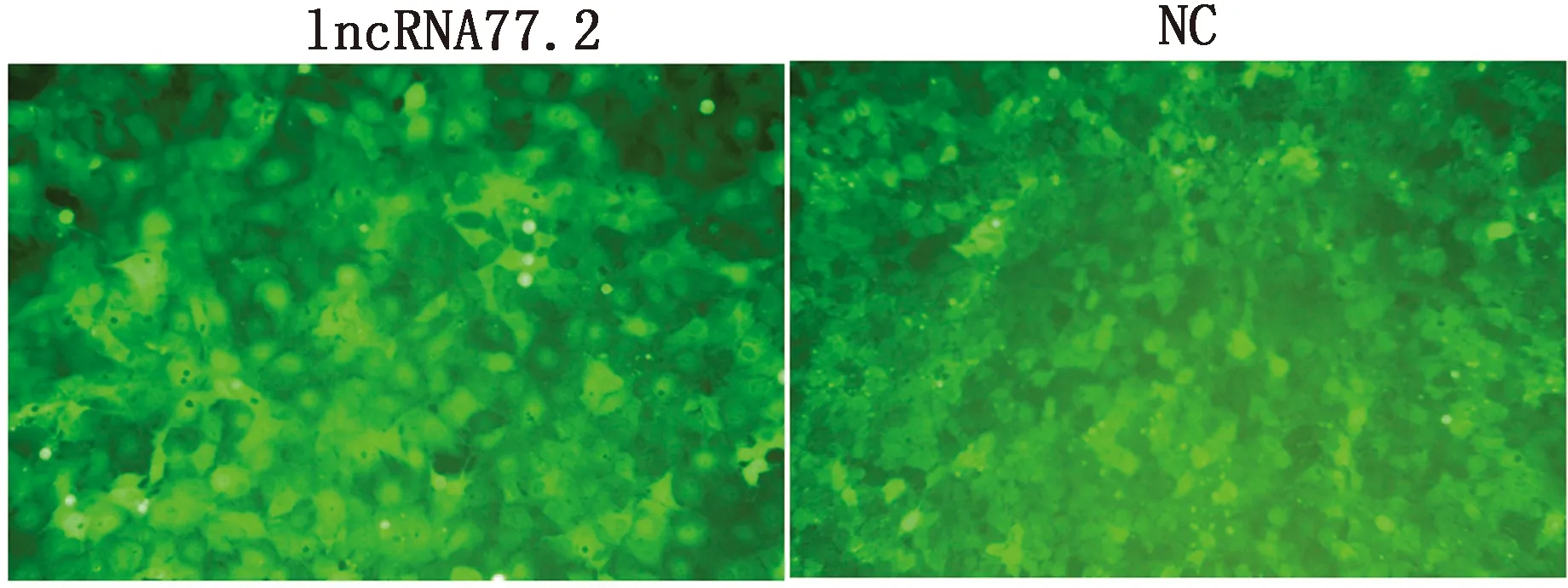
图2 嘌呤霉素筛选后BRL细胞稳定表达GFP(100×)

3 讨论
lncRNA起初被认为是没有功能的“暗物质”。随着新一代高通量测序技术的不断发展与完善,越来越多的研究人员开始关注lncRNA的鉴定和功能研究,不断发现大量具有重要生理、病理功能的lncRNA基因,使得人们对lncRNA的认识出现了质的飞越。存在于哺乳动物细胞中的大部分lncRNA定位于细胞核内,其中一些可以调节关键的核过程,例如NEAT1、TERRA,以及最近发现的新型EIciRNA,在动物细胞中发挥多种分子调控机制[15-16]。由于RNAi机制主要位于细胞质中,siRNA和shRNA介导的核内RNA耗尽的效率很低。化学修饰的嵌合DNA反义寡核苷酸(ASO)可以通过Watson-Crick碱基配对特异性结合其靶RNA,形成DNA-RNA杂双链体,这种DNA-RNA异源双链体是普遍存在的核酸内切酶RNase H的底物,它介导靶RNA链的降解,用来敲低特定核内lncRNA的细胞[17-18]。
BOLIN等[19]通过构建ASO质粒以敲低鸡成纤维细胞(DF-1)中的lncRNA-Six1,评估其在细胞增殖和活力中的作用。本试验针对核内lncRNA 77.2设计了3条不同的ASO干扰序列,并设置不同的浓度梯度转染BRL细胞,发现ASO-2质粒以250 nmol/L转染24 h时对靶基因的干扰效率最高,极显著地敲低了核内lncRNA77.2水平(P<0.01)。进一步优化了ASO转染的时间曲线,观察到转染24 h后干扰效率高于48 h。推测质粒载体本身及转染试剂可能对细胞具有一定的损害,转染时间过长使得细胞的耐受降低,影响转染效率。同时,本试验选用了过表达慢病毒转导,慢病毒载体(LV)相当于γ-逆转录病毒载体(γ-RVs)具有稳定整合到靶细胞基因组的能力,导致目的基因的持续表达[20]。有研究报道,腺病毒按照MOI=20感染BRL-3A细胞48 h,能使Hsp70表达量比无病毒组高(P<0.01)[21]。与腺病毒载体相比较,慢病毒一次性可导入的基因容量更大,转染效率高且表达更加稳定。同时相比腺病毒转染的效果,慢病毒转染并不会使细胞产生明显的免疫反应,使转染效果更加优异[22]。本试验亦采用嘌呤霉素抗性筛选获得了lncRNA77.2的高表达稳转株,为以后lncRNA77.2相关的功能研究建立了基础模型。JIANG等[23]通过构建lncRNA DANCR稳定过表达慢病毒成骨细胞株(FOB),发现lncRNA DANCR通过抑制miR-33a-5p上调受体酪氨酸激酶AXL,促进骨肉瘤的肿瘤进展和癌症干性特征。
本试验表明,重组慢病毒按照MOI=4感染BRL细胞48 h,lncRNA77.2的表达量比空病毒NC组极显著升高(P<0.01),过表达效果为17倍;ASO-2序列以最佳浓度250 nmol/L转染BRL细胞24 h,lncRNA77.2的表达量比对照ASO-NC组极显著降低(P<0.01),干扰效率为78%。该试验为探究重组慢病毒和ASO介导的lncRNA77.2感染细胞的方法及lncRNA77.2在BRL细胞中的作用机制奠定基础。
