日粮中添加栀子花对LPS诱导免疫应激仔猪淋巴细胞中炎症蛋白表达的影响
2020-09-25王秋菊王梦竹崔一喆贾军峰
王秋菊,王梦竹,崔一喆,贾军峰
(黑龙江八一农垦大学 动物科技学院,黑龙江 大庆 163319)
免疫应激是导致仔猪生长抑制的重要因素之一,主要是由细菌、病毒和内毒素等刺激猪的免疫系统所致,给养猪业带来极大危害[1]。给动物注射一定剂量的脂多糖(LPS)是模拟免疫应激的常用方法,会诱导机体合成和分泌过量的炎性细胞因子和炎性介质[2]。肠型碱性磷酸酶(IAP)是 LPS 脱磷酸作用的关键酶。内源性IAP可以缓解LPS引起的炎症反应,外源性IAP对肠道黏膜损伤有修复作用[3]。NF-κB作为LPS介导的重要下游通路,可参与机体多种炎症反应,并介导多种炎症介质和酶的基因表达与调控[4]。LPS诱导后还可增加单核细胞、巨噬细胞抗炎细胞因子的表达[5]。抑制过度的免疫反应尤其是炎性细胞因子的过量产生,对缓解免疫应激性炎症具有重要作用[6]。阻断NF-κB的活性可抑制炎症反应的发展[7]。栀子作为传统中药,无论是单味中药栀子还是中药单体栀子苷或中药有效部位环烯醚萜类在抗炎方面有着大量的文献报道[8]。近年来的研究发现,栀子苷具有抗炎和抑制NF-κB/IκB通路和细胞黏附分子产生等药理活性[9]。本试验通过注射LPS建立仔猪免疫应激模型,以LPS诱导的炎症反应调节信号通路为主线,研究饲料添加栀子花粉对仔猪外周血淋巴细胞NF-κB、IAP表达和炎症细胞因子产生的影响,旨在为减轻仔猪免疫应激以及替代抗生素的研究提供理论依据,为筛选新的饲料添加剂和预防仔猪免疫应激提供新思路。
1 材料与方法
1.1 药物及毒素LPS来源于大肠杆菌O55:B5(Sigma-Aldric公司)。将LPS溶于生理盐水中并以20 g/L的储存液保存。栀子花,购买自广州市天河区五山街道五山大药房。
1.2 试验动物21日龄杜长大三元杂交断奶仔猪,由广东农科院饲料研究所提供。
1.3 试验设计选取24头体质量相近的21日龄杜长大三元杂交断奶仔猪,随机分为4组,每组6头,试验Ⅰ、Ⅱ、Ⅲ组分别为低浓度、中浓度和高浓度中药添加组,另一组为炎症对照组。所有组都饲喂基础日粮进行预饲,3 d后试验Ⅰ、Ⅱ、Ⅲ组分别于每天、每头仔猪的基础日粮中添加栀子花粉1.25,2.50,5.00 g,对照组继续饲喂基础日粮。试验期内,仔猪均自由饮水,自由采食,试验期10 d。试验期间准确记录每天每栏的采食情况,并分别在预饲期前后及试验结束当天早上对仔猪进行空腹测体质量,计算每栏平均日增重、平均日采食量和料重比。
1.4 样品采集于饲养第10天上午全部测体质量,每头仔猪前腔静脉采血,并按100 μg/kg 腹腔注射大肠杆菌脂多糖(LPS),并继续饲喂原有日粮,在注射后0,3,24 h分别采血,分离血清和血液中的淋巴细胞。
1.5 淋巴细胞的提取将用PBS稀释后的血液缓慢加在等量的淋巴细胞分离液(SIGMA,美国)上,室温2 562 r/min离心30 min,小心吸出血沉棕黄雾状层,收集并清洗离心后将细胞置于冰上,分别用少量Trizol和RIPA裂解液重悬冻存后待用。
1.6 指标检测
1.6.1淋巴细胞中相关蛋白的Western blot检测 将冻存的RIPA裂解液稀释的淋巴细胞取出,通过BCA试剂盒(Themo,美国)测定并统一样品浓度后,加入蛋白上样缓冲液(Bio,美国)100℃煮沸10 min 充分变性;将样品按顺序加入10孔SDS-PAGE凝胶(Bio,美国)中,200 V恒压电泳30 min;通过湿转的方法将蛋白转印至0.45 μm PVDF膜(Millipore,德国)上,使用快速封闭液(碧云天,中国)封闭15 min 后使用相应一抗4℃孵育过夜;TBST清洗5次,每次10 min;二抗室温摇床孵育1 h;TBST清洗5次,每次10 min;ECL化学发光显影。以β-actin蛋白为内参,使用Photoshop cc软件扫描条带灰度值,检测NF-κB通路及IAP相关蛋白并进行分析。
1.6.2血清相关炎症因子的检测 按照试剂盒Raybiotech(美国)说明书通过蛋白质芯片的方法定量检测IL-1b、IL-4、IL-6、IL-8、IL-10、IL-12、IFN-γ和TNF-α等的含量。
1.7 数据处理试验数据采用Excel 2013进行整理,采用SPSS 16 进行单因素方差分析,并采用Duncan氏法进行多重比较,以P<0.05为有差异性显著判定标准,结果用平均值±标准误进行表示,采用GraphPad Prism 5.0绘制图表。
2 结果
2.1 栀子花对仔猪生长性能的影响由表1可见,与不饲喂栀子花的致炎对照组相比,添加栀子花粉能显著降低仔猪的日增重及日采食量(P<0.05),但低、中剂量组料重比提高不明显。
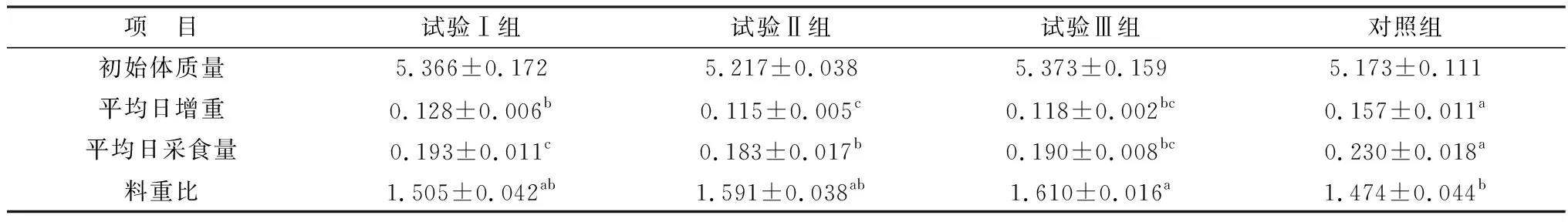
表1 栀子花对仔猪生长性能的影响 kg
2.2 栀子花对淋巴细胞NF-κB通路及IAP相关蛋白表达的影响
2.2.1注射LPS之前 仔猪淋巴细胞中NF-κB通路及IAP相关蛋白结果如图1所示。从图1可以看出,在注射LPS前,即饲喂栀子花10 d后,各试验组与对照组相比,NF-κB通路上的P65、磷酸化的P65(P-P65)、碱性磷酸酶IAP、蛋白抑制因子IκB及其磷酸化的IκB(P-IκB)蛋白表达受到了栀子花添加的不同影响。与对照组相比,试验Ⅰ、Ⅱ、Ⅲ 组NF-κB通路上的P65蛋白表达量均显著低于对照组(P<0.05),且随栀子花添加量减少而表达量降低;试验Ⅰ、Ⅱ 组磷酸化的P-P65蛋白表达量显著低于对照组(P<0.05),试验Ⅲ组仔猪淋巴细胞中P-P65的蛋白表达量没有显著变化(P>0.05)。试验Ⅰ、Ⅱ组仔猪淋巴细胞中IAP蛋白表达量显著低于对照组(P<0.05),试验Ⅲ组IAP表达没有显著变化(P>0.05)。同时,试验Ⅰ组的IκB蛋白显著降低(P<0.05),试验Ⅱ、Ⅲ 组的IκB蛋白表达量与对照组相比无显著性差异(P>0.05);而试验Ⅰ、Ⅱ、Ⅲ 组P-IκB蛋白表达量均显著低于对照组(P<0.05),且试验Ⅲ 组P-IκB蛋白表达量最低(P<0.05)。
2.2.2注射LPS后3 h 仔猪淋巴细胞中NF-κB通路及IAP相关蛋白结果如图2所示。从图2可以看出,在注射LPS之后3 h,与炎症对照组相比,NF-κB通路上的P65蛋白表达量没有显著变化(P>0.05),而试验Ⅲ 组仔猪淋巴细胞中P-P65蛋白表达量在LPS注射3 h后显著减低(P<0.05)。试验Ⅰ、Ⅱ 组仔猪淋巴细胞中IAP蛋白表达量在LPS注射3 h后显著低于炎症对照组(P<0.05)。同时,试验Ⅰ组的IκB蛋白显著低于对照组(P<0.05),而试验Ⅲ 组P-IκB蛋白表达量显著低于炎症对照组(P<0.05)。
2.2.3注射LPS后24 h 仔猪淋巴细胞中NF-κB通路及IAP相关蛋白结果如图3所示。从图3可以看出,在注射LPS之后24 h,与炎症对照组相比,试验Ⅰ、Ⅱ、Ⅲ 组仔猪淋巴细胞中NF-κB通路上的P65蛋白表达量没有发生显著变化,只有试验Ⅰ组表达量略高;而仔猪淋巴细胞中P-P65蛋白表达量却在试验Ⅰ、Ⅱ、Ⅲ 组中均显著低于对照组(P<0.05),且以试验Ⅲ 组的P-P65蛋白表达量最低(P<0.05)。试验Ⅰ、Ⅱ、Ⅲ 组仔猪淋巴细胞中IAP蛋白表达量在LPS注射24 h后均显著低于对照组(P<0.05),且随着栀子花添加量减少而IAP表达量降低(P<0.05)。同时,试验Ⅰ、Ⅱ、Ⅲ 组的IκB蛋白表达量与炎症对照组相比没有显著性差异,只有试验Ⅲ组的P-IκB蛋白表达量显著低于对照组(P<0.05);而试验Ⅱ、Ⅲ 组P-IκB蛋白表达量显著低于对照组(P<0.05),且随着栀子花添加剂量增加而表达量逐渐降低(P<0.05)。
2.3 栀子花对血清中细胞因子含量的影响栀子花对仔猪血清中细胞因子含量的影响见表2。结果显示,添加栀子花对LPS致炎前后的各个细胞因子具有不同的影响。试验Ⅲ 组IL-1b、IL-6、IL-8、IL-12和IFN-γ在致炎后0,3,24 h的含量均较对照组显著降低(P<0.05),试验Ⅱ 组TNF-α含量较对照组显著降低(P<0.05);试验Ⅱ、Ⅲ 组IL-4含量较同一时间的对照组显著升高(P<0.05),而试验Ⅱ 组IL-10含量较同一时间的对照组显著升高(P<0.05)。
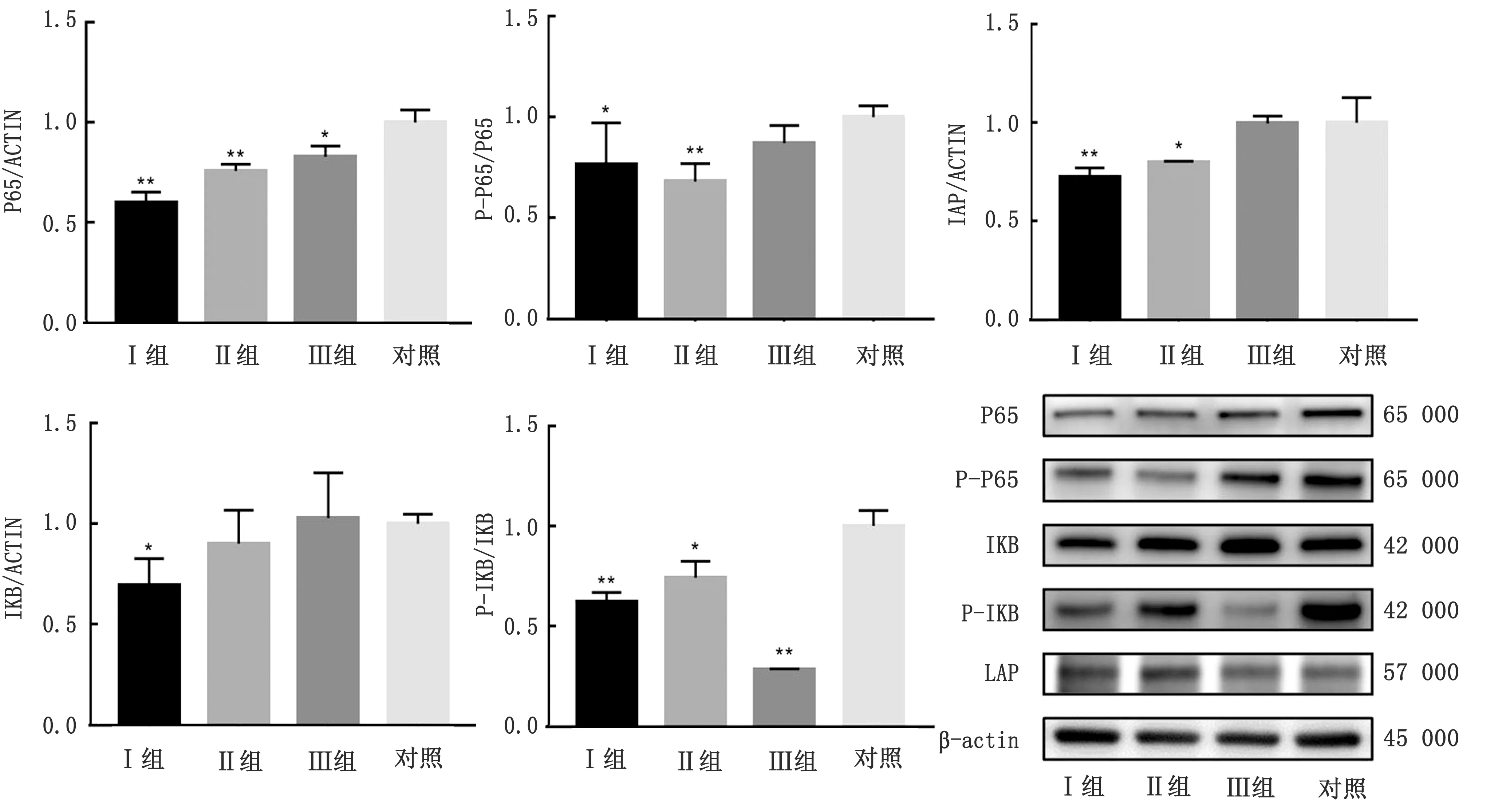
图1 注射LPS之前淋巴细胞NF-κB通路及IAP相关蛋白的相对表达量 *.表示与对照组相比,相对蛋白表达量差异显著(P<0.05);**.表示与对照组相比,相对蛋白表达量差异极显著(P<0.01)。下同

图2 注射LPS后3 h淋巴细胞NF-κB通路及IAP相关蛋白的相对表达量
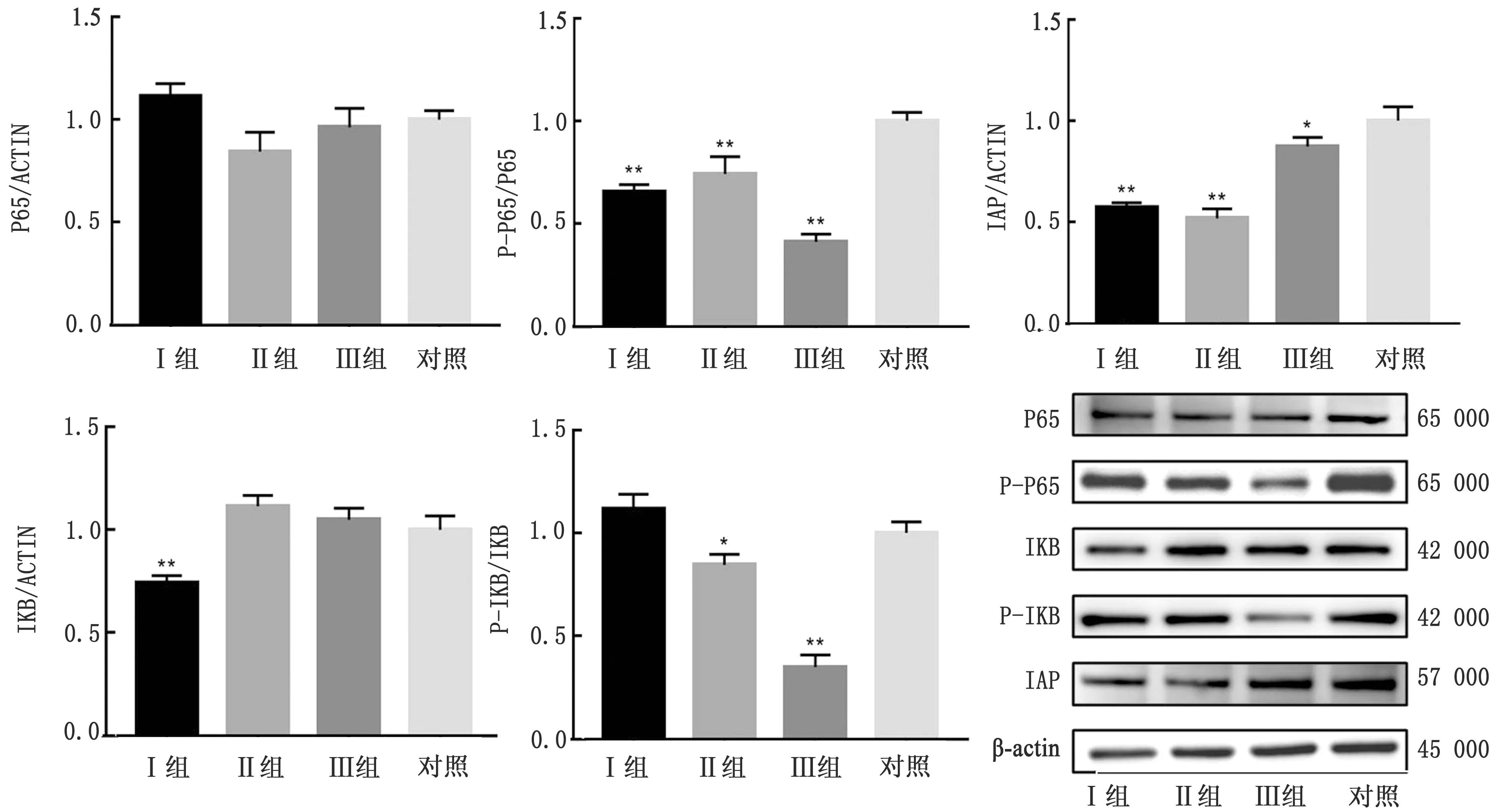
图3 注射LPS后24 h淋巴细胞NF-κB通路及IAP相关蛋白的相对表达量
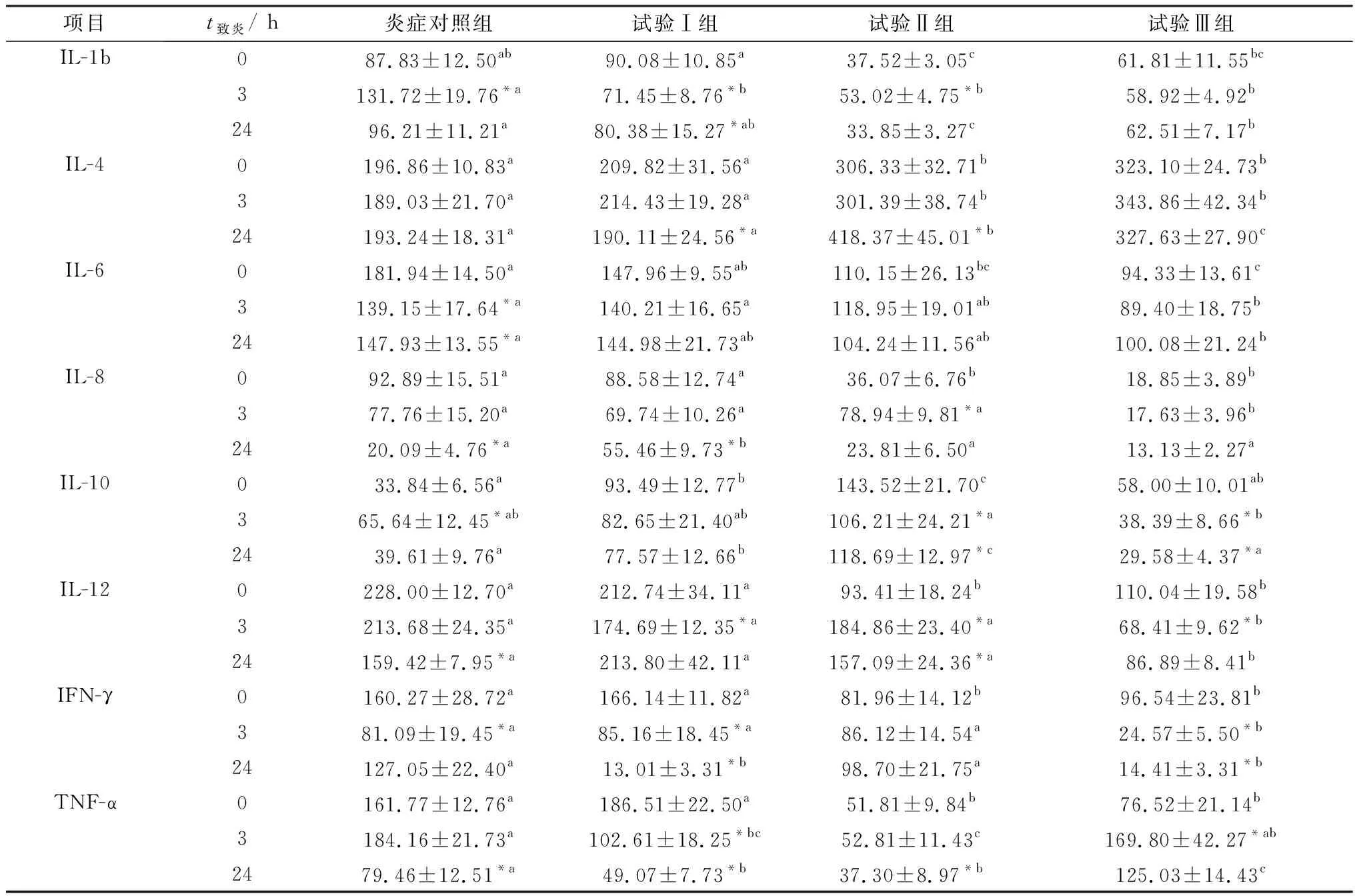
表2 栀子花对仔猪血液中细胞因子含量变化的影响 ng/L
3 讨论
3.1 栀子对细胞信号通路的影响细胞质中的抑制物IκB与NF-κB结合,使NF-κB处于失活状态。当机体处于炎症状态时,抑制物IκB磷酸化并降解失活,NF-κB不受IκB抑制后由失活状态转为活状态,并转移入细胞核,诱导相关靶基因转录后表达蛋白的增多,包括各种细胞因子和趋化因子[10]。栀子花汤在抗炎机制中的作用与抑制 NF-κB信号途径有密切关系。研究发现,由LPS诱导的巨噬细胞炎症反应,当用栀子苷治疗后,同时加入 NF-κB抑制剂,细胞中的炎症因子TNF-α、IL-6的表达量明显减少,说明栀子苷的抗炎机制与抑制NF-κB信号通路有关[11]。同时有研究进一步发现,栀子抑制NF-κB活性的同时,也抑制TLR4、MMP-9的表达而发挥抗炎作用[12]。在治疗LPS诱导的小鼠乳腺炎及用药干预小鼠乳腺炎上皮细胞后发现,栀子苷具有明显抗炎及抗细胞凋亡的作用[12]。在血液系统方面,栀子苷对败血症小鼠抗炎的作用机制与TLR信号通路有关,通过干预TLR信号通路,进而减少前炎症细胞因子的产生,最终降低小鼠的死亡率[13]。
NF-κB通路是炎症调节的重要因素,它能够调节多种炎性因子的表达,尤其在炎症性肠炎(IBD)的治疗中尤为重要。本试验验中致炎前,NF-κB通路相关蛋白磷酸化程度有所降低,致炎后治疗组通路内上下游蛋白表达有一定降低,但磷酸化表达程度显著低于对照组,说明栀子在治疗断奶仔猪炎症的过程中能够抑制P65及IκB的磷酸化,进而发挥抗炎作用。
大量试验表明,IAP能通过水解LPS的脂质A基团,从而达到对LPS的解毒作用[14]。本试验中,致炎前后药物组的IAP蛋白表达均高于对照组,说明栀子能调节仔猪体内IAP的表达对仔猪炎症的抑制起到重要作用。
3.2 栀子对炎症细胞因子的影响研究表明,LPS进入机体引发炎症后,引发天然免疫系统的应答,各种炎症因子急剧变化,会诱导TNF-α、IL-6、IL-8、IL-1β等细胞炎症因子的释放,而大量炎症细胞因子的释放能诱发炎症反应的进行,造成微循环血流淤滞,造成器官功能损伤,甚至导致组织坏死[15-16]。有研究发现,栀子苷能明显降低细胞炎症因子的释放,如在对由LPS诱导的肺炎模型小鼠治疗中,栀子苷能降低细胞炎性因子的表达[17]。体外培养由LPS诱导损伤的大鼠巨噬细胞,通过栀子苷治疗后发现细胞中炎症因子TNF-α、IL-6和IL-1β的表达量明显降低[18]。同时,在治疗大鼠脑损伤方面也发现,栀子苷能明显减少血液中IL-1β、IL-6和IL-8水平,而IL-10水平升高,对大鼠的神经有明显的保护作用[19]。栀子具有很强的抗氧化、淬灭自由基及抑癌活性。临床上有抗炎镇痛、保肝利胆等作用,对急性出血坏死性胰腺炎具有明显的治疗作用,对胰细胞的结构和功能具有保护作用,可减轻胰腺病损,降低早期死亡率,纠正各项病理障碍,促进代谢和功能的恢复;也有抗迟发型超敏反应等作用[20]。本试验中,致炎细胞因子IL-1β、IL-8、IL-10、IL-12在栀子花粉高剂量添加组中的含量呈现显著降低,与前人研究结果一致。TNF-α是一种能够直接杀伤肿瘤细胞而对正常细胞无明显毒性的细胞因子,是启动抗炎反应的关键因子;而IFN-γ可通过活化NK细胞及细胞毒性T淋巴细胞,引起机体的免疫反应,起到抗病毒作用。在本试验中,高剂量给药组TNF-α和IFN-γ均显著下降,说明栀子花对炎症起到一定预防和抵抗作用。
本试验结果表明,栀子通过调节炎症通路蛋白表达,抑制炎症产生,并刺激抗炎细胞因子增加、促炎细胞因子减少,起到对LPS诱导仔猪免疫应激的保护作用,为栀子作为抗炎药物或添加剂的应用打下理论基础。
