月桂酸单甘油脂(GML)对致病性念珠菌生物被膜的作用
2020-09-25马生妍周学章
马生妍,周学章
(宁夏大学 西部特色生物资源保护与利用教育部重点实验室,宁夏 银川 750021)
念珠菌是临床常见的人畜共患的条件性致病菌,在机体菌群紊乱失衡、免疫功能低下或者受损后入侵增殖导致宿主感染[1]。其中,白色念珠菌感染在念珠菌属中的发病率最高[2-3],而在常见非白色念珠菌中,克柔念珠菌分离率在部分地区呈现上升趋势,感染不断增加[4],而且对氟康唑天然耐药,在唑类药物之间交叉耐药现象严重,对抗真菌药物的耐药率最高[5]。DU等[6]对宁夏地区临床型奶牛乳房炎奶样真菌病原进行分离鉴定发现主要为非白色念珠菌,其中克柔念珠菌分离率最高,而且对唑类药物存在一定耐药性。影响念珠菌在宿主形成致病能力的主要原因是毒力因子的表达,生物被膜形成作为念珠菌致病性和耐药性的促成因素是被研究的一个重要毒力因子[7],并与其他毒力因子包括菌丝形成,黏附与物质表面、细胞表面疏水性等均有密切关系。而且,念珠菌形成致密网状的生物被膜结构为真菌细胞抵抗药物治疗提供了一个保护屏障,使其在恶劣的环境中得以生存[8],并且可以抵抗常用抗真菌药物,使其对抗真菌药物的敏感性降低甚至产生耐药[9],能够保护细胞免受宿主免疫系统的攻击[10],并且可以为复发性感染提供感染源[11]。有限的抗真菌药物种类以及耐药的广泛出现使得真菌感染治疗面临着严峻的挑战。因此,寻找新型的抗念珠菌的药物以及有效的抗生物被膜的药物显得意义更大。
天然产物易于生物利用并且具有潜在的抗真菌特性[12],可替代抗菌药物作为治疗疾病的选择[13]。月桂酸单甘油酯(glycerol monolaurate,GML)是一种存在于母乳、椰子油和美洲蒲葵中的天然物质,具有广泛的生物活性,如抗炎、抗肿瘤和抗菌作用[14]。研究表明,GML是脂肪酸及其衍生物中抑菌活性最强的化合物,对幽门螺杆菌、金黄色葡萄球菌、单核增生李斯特菌、蜡样芽孢杆菌等细菌的生长繁殖有极强的抑制作用[15]。THORMAR等[16]还发现,GML具有抗病毒活性。LI等[14]通过阴道凝胶给药试验,证明GML能有效防止恒河猕猴感染猴免疫缺陷病毒(SIV)。GML能够抑制革兰阳性菌生物被膜的形成以及外毒素的产生,并且高质量浓度GML具有杀菌作用[15]。GML已被FDA认定是安全的食品添加剂(GRAS)。由于非白色念珠菌与白色念珠菌在细胞结构的组成上存在极大差异,GML对非白色念珠菌的抑菌机制是否与白色念珠菌相同,尚需进一步的研究加以证实。因此,本试验综合克柔念珠菌的高耐药性和逐年升高的检出率,选择白色念珠菌和对氟康唑耐药的克柔念珠菌作为研究对象,探究GML抑制白色念珠菌及克柔念珠菌生物被膜形成的作用机制,旨在为治疗致病性念珠菌引起的真菌疾病提供科学依据。
1 材料与方法
1.1 受试菌株白色念珠菌SC5314由宁夏医科大学附属医院实验中心惠赠;克柔念珠菌ATCC6258购买于美国模式培养物集存库;分离株CK1-CK7分离自患乳房炎奶牛乳样,经生化鉴定。
1.2 主要试剂及药品GML由宁夏智弘生物科技有限公司提供;氟康唑(中国,大连美仑);MOPS(中国,北京索莱宝);RPMI1640粉末(美国GIBCO);XTT、维生素K3(大连美仑公司);Total RNA提取试剂(北京艾德莱公司);PCR试剂(德国QIAGEN公司)。
1.3 菌液制备菌液复苏、划线纯化连续培养3次,使真菌处于对数生长期,挑取较大的单个菌落到YPD液体培养基中37℃ 120 r/min振荡培养过夜。
1.4 药液原液的配制及保存GML(大连美仑生物技术有限公司)用无水乙醇溶解为100 g/L质量浓度的储存液分装后置于-80℃存储备用。
1.5 GML对念珠菌的最低抑菌浓度(MIC)和最低杀菌浓度(MFC)测定参照 M27-A3方案,采用微量稀释法测定MIC。将GML按倍比稀释8个梯度(质量浓度分别为500,250,125,62.5,31.3,15.6,7.8,3.9 mg/L),取100 μL 依次加到各孔中,在96孔板中分别设生长对照孔和空白对照孔,37℃培养24 h,肉眼观察结果。取10 μL菌悬液涂布于沙氏固体培养基上,37℃培养48 h后培养基上没有菌落生长的最低药物质量浓度即为MFC,重复3此。
1.6 时间-抑菌曲线测定采用酶标比浊法测定。YPD液体培养基稀释菌液至1×105CFU/mL,加入MIC 质量浓度GML的为试验组,并设置不加药对照组,各组同步摇床培养(120 r/min,37℃),每2 h 取样立即用分光光度计测D600值,重复3次,必要时适当稀释,直至生长达到稳定期。以作用时间为横坐标,△D600为纵坐标,绘制时间-抑菌曲线。
1.7 GML对成熟生物被膜的影响及SMIC50/SMIC80测定将菌液浓度稀释至1×106CFU/mL,96孔板为载体37℃培养生物被膜,24 h后初步鉴定生物被膜的形成。弃去培养基PBS洗3次,提前稀释好GML的质量浓度即500,250,125,62.5,31.3,15.6,7.8,3.9 mg/L,各质量浓度GML依次加入1~8孔中,每孔加入200 μL,并设9孔为阴性对照孔,10孔为空白对照孔,每组设8个复孔,37℃培养24 h,加入XTT-甲萘醌溶液避光孵育2 h,检测各孔在490 nm波长处的D值,并计算抑制率,重复3次取平均值。SMIC50为抑制率达到50%时最小黏附抑菌浓度的值。
1.8 Spot assay 检测白念珠菌生物被膜细胞活性配制不同质量浓度GML与同体积不同浓度的菌液混匀,各取 5 μL,按浓度由高到低的顺序,依次点种于固体沙氏培养基上,在 37℃恒温培养箱中培养 48 h,观察菌落生成情况并拍照。
1.9 CLSM检测GML对念珠菌活性及生物被摸厚度的影响在激光共聚焦培养皿中37℃培养 24 h构建生物被膜。PBS洗3次,加入不同质量浓度的GML作用12 h,荧光素二乙酸酯(FDA)10 mg/L和碘化丙啶(PI)5 mg/L的混合物500 μL在避光条件下共染30 min。用激光共焦扫描显微镜(CLSM)488 nm和555 nm激发波长激发FDA和PI进行各自成像,通过对Z轴进行逐层扫描,获得样品的生物被膜厚度。
1.10 不同质量浓度GML抑制克柔念珠菌生物被膜形成早期黏附阶段的测定通过XTT减低法检测。将100 μL的菌液(1×106CFU/mL)接种于96孔板中37℃培养,分别培养1,2,3,4 h后吸弃培养基及未黏附菌,PBS洗3次,加入稀释好的GML(质量浓度分别为500,250,125,62.5,31.3,15.6,7.8,3.9 mg/L)37℃培养24 h,每孔加入XTT-甲萘醌溶液避光孵育2 h,490 nm处检测吸光值,每组设8个复孔。
1.11 细胞表面疏水性试验采用水-烃两相测定念珠菌细胞表面疏水性。将2×106CFU/mL菌液加入6孔板中,与不同质量浓度GML 37℃静止培养形成生物被膜,离心收集菌体,YPD培养基制备菌悬液(D600 nm=1.0)。1.2 mL菌悬液加入0.3 mL正辛烷置于新的玻璃试管中,剧烈涡旋混匀 3 min静置后使两相分离,立即测定水相D600 nm值并计算CSH值。
1.12 GML对菌丝和芽管的抑制作用活化后菌液配制成2×106CFU/mL浓度,取500 μL加入24孔板中,再加入不同质量浓度GML 500 μL,37℃静置培养,每2 h涂片显微镜观察菌体形态并拍照。芽管生长的判断标准:计数芽管形成百分率时,芽管生长的长度超过菌体直径2倍以上为正常生长芽管;否则认为芽管受抑制。计数过程中使用Motic显微镜系统上测定芽管长度。
1.13 分泌酶活性检测将培养至对数生长期菌悬液调节浓度至1×107CFU/mL,取10 μL滴加于蛋黄琼脂培养基表面继续培养,观察菌落形成沉淀环情况并测定直径,计算PZ值,来检测磷脂酶活性。同样在牛血清白蛋白培养基培养检测天冬氨酸蛋白酶活性。每组重复3次。PZ=菌落直径/总直径。PZ值越小,酶活性越大。
1.14 GML对生物被膜形成相关基因表达量的影响不同试验株菌悬液(2×106CFU/mL)分别与MIC质量浓度的GML于6孔板中混合,并设空白对照组,37℃培养48 h后,离心收集菌体,PBS洗3次,进行总RNA提取,然后通过超微量分光光度计进行浓度与纯度的检测。合成各基因的cDNA链作为模板进行实时定量检测,用于扩增特定基因的引物序列如下(表1)。全部基因在下列条件下进行扩增:95℃30 s;95℃5 s,53℃30 s,40个循环;95℃15 s,60℃30 s,95℃15 s。具体操作方法参照试剂说明书进行。实时荧光定量PCR分别测定目的基因及内参ACT的Ct值,试验结果取其平均值,基因表达水平用倍数变化来表示(2-ΔΔCt法)。

表1 白色念珠菌PCR引物
1.15 统计学方法试验组不同药物浓度均设8个复孔,试验重复3次最后取平均值。数据均以“平均值±标准差”表示,试验结果用SPSS软件进行显著性检验,P<0.05表示与对照组间差异显著,P<0.01 表示与对照组间差异极显著。
2 结果
2.1 GML对念珠菌体外抑菌活性测定药敏试验检测GML对浮游状态白色念珠菌和克柔念珠菌的最小抑菌浓度(MIC),并以氟康唑作为质控药物,SC5314和ATCC6258作为质控株控制整个试验的条件。GML对氟康唑表现为敏感的白色念珠菌SC5315的MIC和MFC分别为250 mg/L和500 mg/L;GML对氟康唑抗性菌株克柔念珠菌的MIC和MFC分别为15.6 mg/L和31.25 mg/L(表2)。

表2 GML对念珠菌的最小抑菌质量浓度(MIC)和 最小杀菌质量浓度(MFC) mg/L
2.2 时间-抑菌曲线测定由图1可知,通过使用MIC质量浓度的GML干预,SC5314生长受到抑制;克柔念珠菌ATCC 6258、CK1对照组经过4 h的延滞期(△D≤0.05)后迅速进入对数生长期,使延滞期分别延长至12 h和10 h;试验数据表明,GML作用效果显著,即抑制SC5314生长,有效延长克柔念珠菌延滞期,对GML抑菌杀菌均具有重要意义。
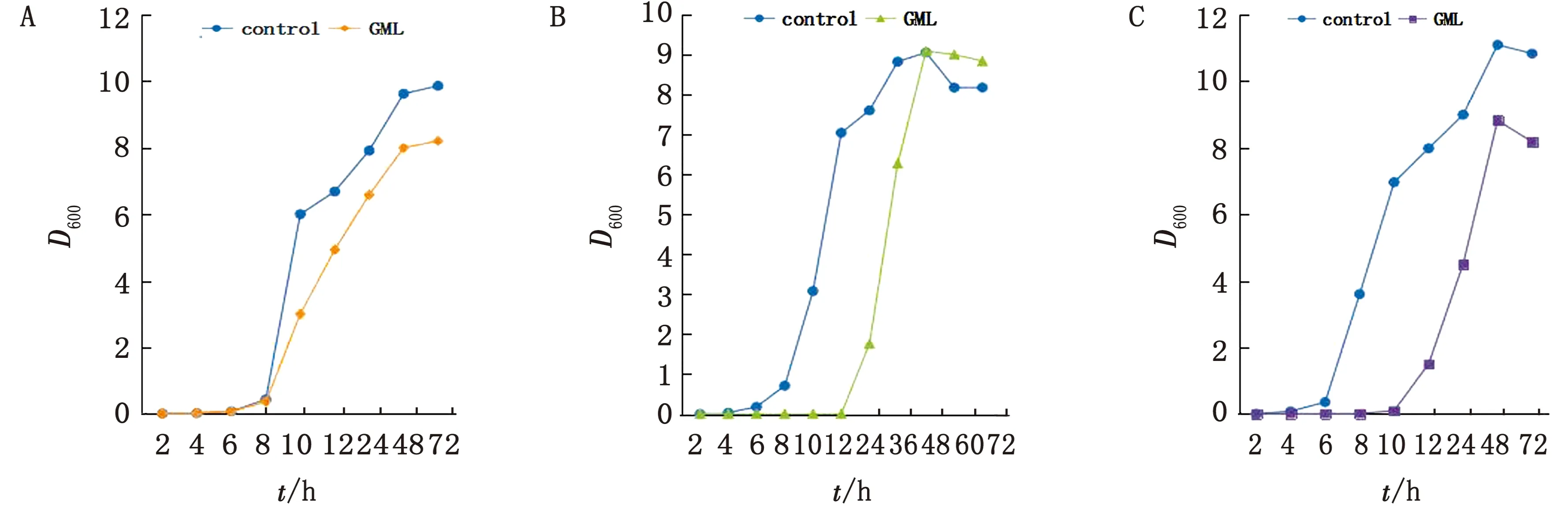
图1 GML时间-抑菌曲线测定 A.SC5314;B.ATCC6258;C.CK1
2.3 GML对念珠菌成熟生物被膜的影响及SMIC测定培养24 h后,倒置显微镜观察生物被膜形态,出现菌丝交织的多层的生物被膜结构,具有典型的微生物被膜特征(表3)。GML对克柔念珠菌ATCC6258、CK1和白色念珠菌SC5314成熟生物被膜具有抑制作用,并具有质量浓度依赖性,GML对克柔念珠菌生物被膜形成的抑制作用优于白色念珠菌;克柔念珠菌生物被膜的SMIC50为62.5 mg/L,白色念珠菌SMIC50>1 000,500 mg/L质量浓度对ATCC6258生物被膜形成的抑制作用达到100%(图2)。
2.4 GML对念珠菌生物被膜的厚度及细胞活性的抑制作用Spot assay试验如图3所示,空白对照组细胞菌落数最多,细胞活性最好;GML干预下随着质量浓度递增,细胞菌落数逐渐减少,细胞活性减弱,高质量浓度GML比低质量浓度GML对菌株的抑制作用显著。另外,我们还通过 CLSM 更直观地考察GML对念珠菌生物被膜形成的抑制作用,如图3所示,随着GML质量浓度的增大,由PI标记的死细胞的数量和荧光强度逐渐增大。同时,GML可有效减小生物被膜的厚度,其中MIC浓度的 GML作用48 h后,对白色念珠菌SC5314生物被膜的厚度由对照组的37.4 μm下降至26.38 μm;对克柔念珠菌ATCC6258生物被膜的厚度由对照组的18.88 μm下降至13.5 μm;对克柔念珠菌分离株CK1生物被膜的厚度由对照组的16.74 μm 下降至9.86 μm(图3)。

表3 不同质量浓度GML对成熟生物被膜的影响
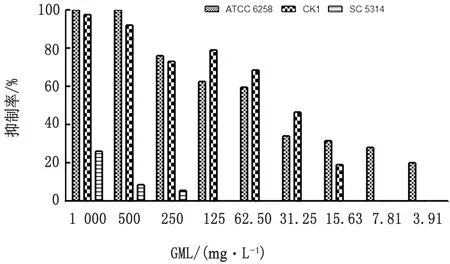
图2 不同质量浓度GML对致病性念珠菌24 h成熟生物被膜的影响
2.5 GML对菌丝及芽管形成的影响通过显微镜记录念珠菌酵母相向菌丝相转变情况(图4),空白组芽管在2 h后可见菌体缠绕,MIC和2MIC质量浓度组出芽率较低,几乎均呈现酵母相;在8 h时,低质量浓度组和空白组出现大量菌丝缠绕,MIC和2MIC质量浓度组芽管出芽率依旧保持低水平且芽管长度较小。
2.6 不同质量浓度GML对抑制念珠菌生物被膜形成早期黏附阶段的影响试验结果显示,GML对念珠菌黏附的抑制作用呈时间剂量依赖,黏附时间越短、浓度越高,抑制作用的效果越好。不同质量浓度GML对ATCC6258生物被膜形成早期黏附性的影响见表4,其中125 mg/L GML,与对照组相比,对黏附1 h 和4 h后的克柔念珠菌的抑制率分别为78.81%(P<0.01)和13.8%。
不同质量浓度GML对CK1生物被膜形成早期黏附性的影响见表5,15.63 mg/L GML组对黏附1 h抑制作用极显著(P<0.01),对黏附2 h抑制作用显著(P<0.05)。不同质量浓度GML对SC5314生物被膜形成早期黏附性的影响见表6,在GML质量浓度高于250 μg/mL对3 h内黏附可达到显著抑制(P<0.05)。
2.7 细胞表面疏水性测定克柔念珠菌细胞表面疏水性较白色念珠菌强,不同质量浓度GML作用后均能减小细胞表面疏水性,GML在质量浓度为1/2MIC时就可显著降低细胞表面疏水性(图5)。
2.8 磷脂酶活性测定磷脂酶活性筛选克柔念珠菌未检测到磷脂酶活性为阴性菌株。由图6可以看出,磷脂酶阳性菌株白色念珠菌SC5314与对照相比,不同质量浓度GML处理的生物被膜状态念珠菌磷脂酶的酶活性没有显著性差异,因此,酶活性没有降低。这些发现表明,GML对磷脂酶没有调节作用。
2.9 天冬氨酸蛋白酶活性测定天冬氨酸蛋白酶酶活性筛选克柔念珠菌未检测到磷脂酶活性为阴性菌株。由图7可以看出,天冬氨酸蛋白酶阳性菌株白色念珠菌SC5314与对照相比,不同质量浓度GML处理的生物被膜状态念珠菌磷脂酶的酶活性没有显著性差异,因此,酶活性没有降低。这些发现表明GML对天冬氨酸蛋白酶依然没有调节作用。
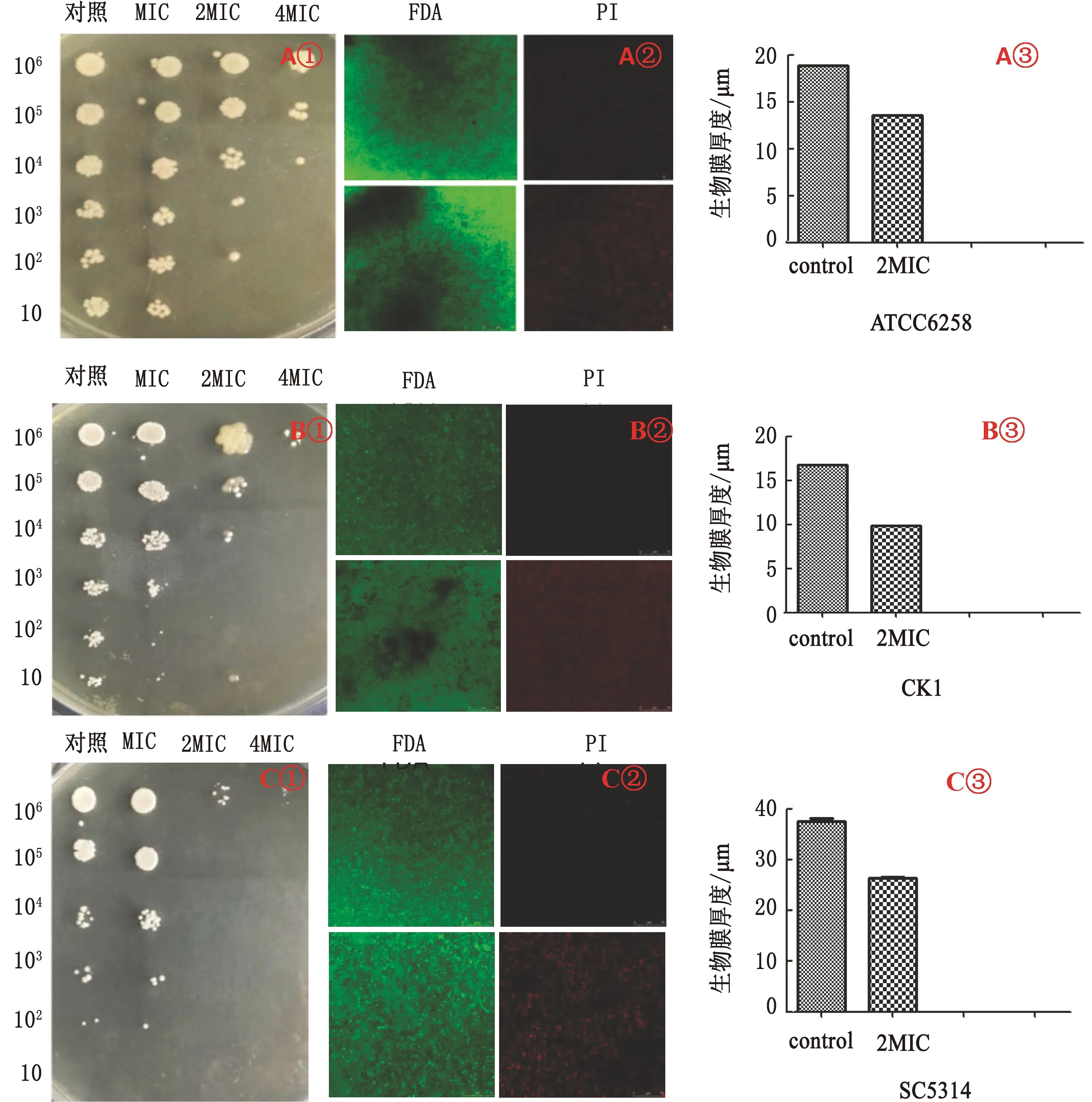
图3 GML对念珠菌生物被膜活性及厚度的影响 A.ATCC6258;B.CK1;C.SC5314;①.Spot assay检测生物被膜细胞活性;②.CLSM下FDA/PI成像;③.生物被膜厚度
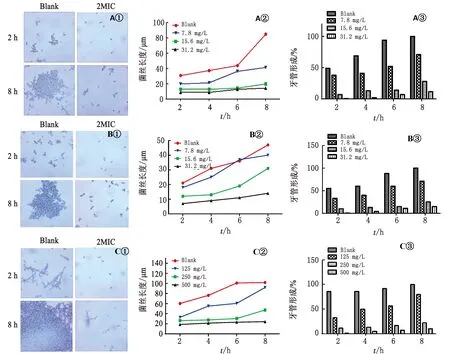
图4 GML对致病性念珠菌菌丝及芽管形成的影响 A.ATCC6258;B.CK1;C.SC5314;①.显微镜观察菌丝形成(400×);②.芽管长度;③.芽管生产率
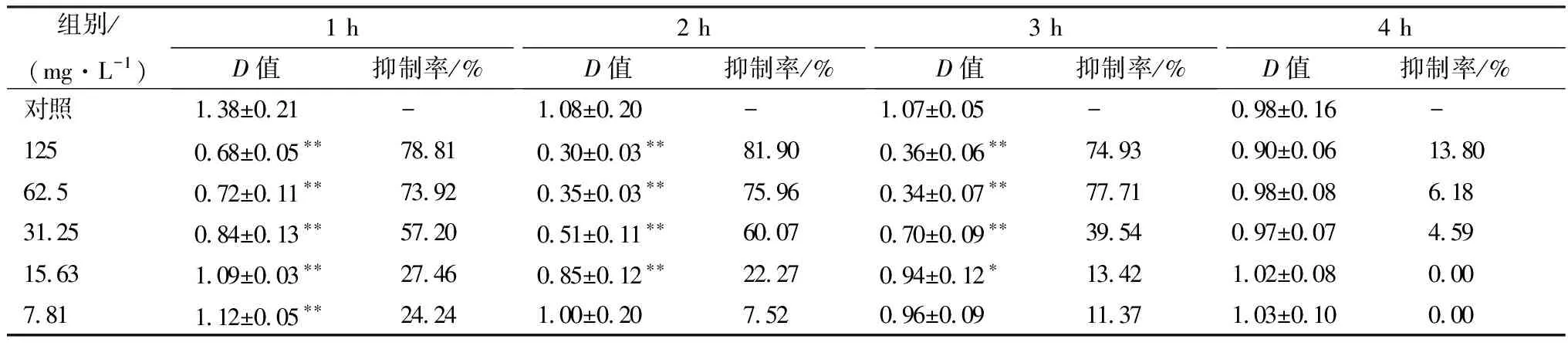
表4 不同质量浓度GML对ATCC6258生物被膜形成早期黏附性的影响

表5 不同质量浓度GML对CK1生物被膜形成早期黏附性的影响

表6 不同质量浓度GML对SC5314生物被膜形成早期黏附性的影响
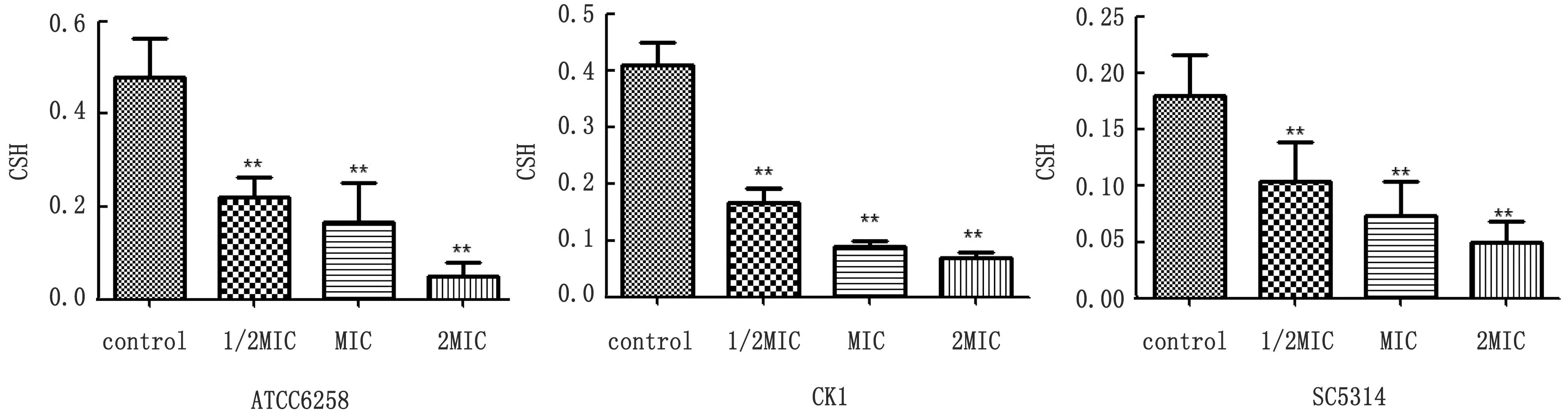
图5 GML对细胞表面疏水性(CSH)的影响 **.P<0.01
2.10 GML 对念珠菌生物被膜形成相关基因表达量的影响图8显示,GML能显著降低白色念珠菌生物被膜形成相关基因的表达水平,与对照相比,ALS3、HWP1、ECE1和ERG11分别下调79%,50%,81%和91%;克柔念珠菌ATCC6258和CK1的ERG11基因分别下调69%和65%(图9);表明GML能通过抑制黏附基因和菌丝形成基因的表达量来抑制其生物被膜的形成。
3 讨论
因为念珠菌感染引起的高发病率和念珠菌耐药性的产生,以及目前常用的抗真菌药物面临一定的局限性,这让更多研究者致力于开发新型抗真菌药物。已有研究发现,GML对大多数细菌均具有良好的抑菌杀菌活性[17],由于存在多个作用靶点使耐药现象不易产生[18]。而我们药敏试验结果显示GML对念珠菌也具有潜在抗菌活性,这与SELEEM等[19]研究结果一致。但是,尚未见对非白色念珠菌抑菌作用研究的相关报道。我们研究发现,GML对白色念珠菌和克柔念珠菌均有抑制作用以及杀真菌作用。GML对克柔念珠菌抑制作用较为显著,MIC较白色念珠菌小16倍,可能因为克柔念珠菌在病原性和毒性上与白色念珠菌不同,其比白色念珠菌弱。

图6 磷脂酶活性测定结果 A.磷脂酶活性筛选结果(左图磷脂酶阳性,右图磷脂酶阴性);B.GML对磷脂酶阳性菌SC5314磷脂酶活性的影响
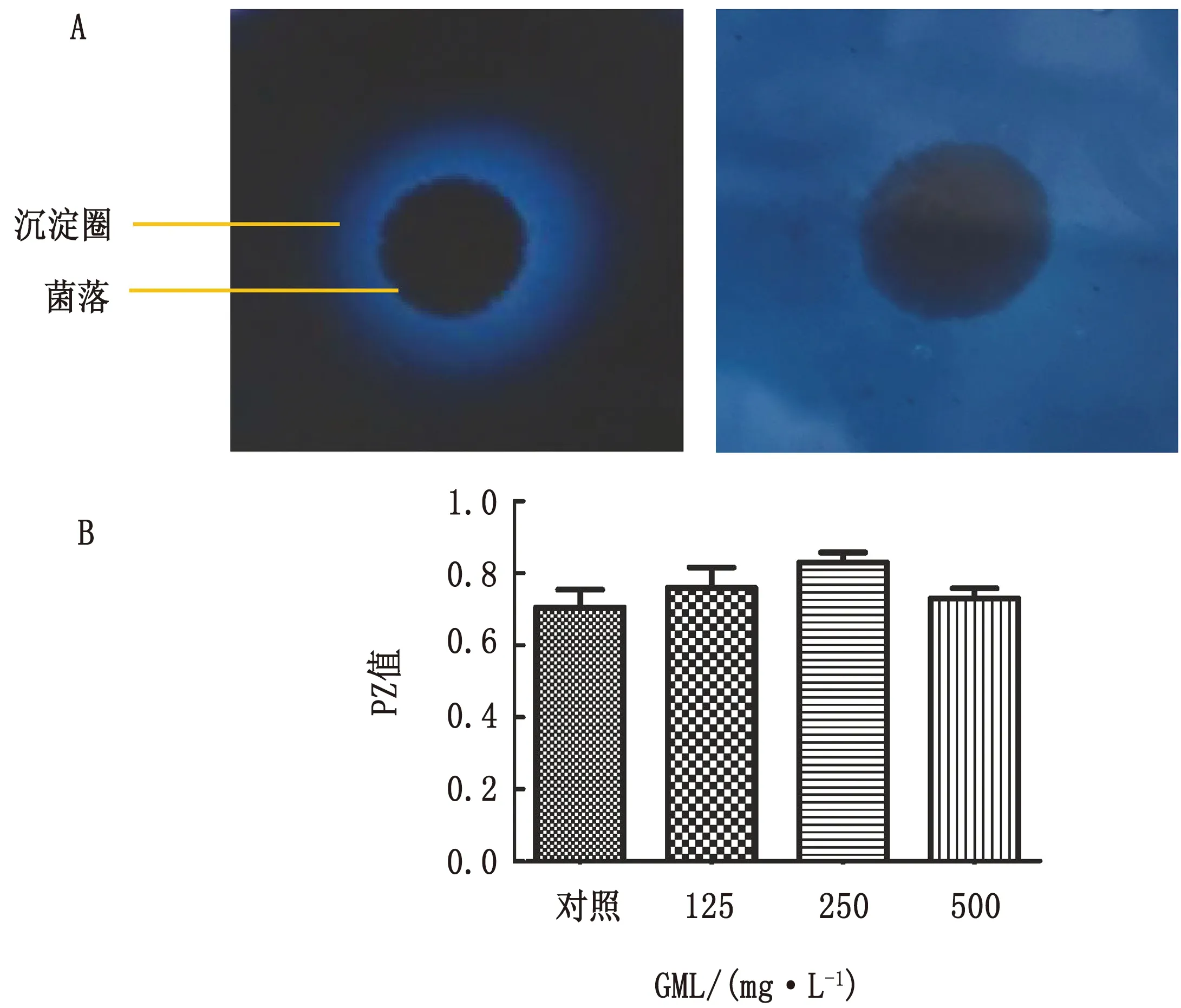
图7 天冬氨酸蛋白酶活性测定结果 A.天冬氨酸蛋白酶活性筛选结果(左图阳性菌落,右图阴性菌落);B.GML对天冬氨酸蛋白酶阳性菌SC5314蛋白酶活性的影响
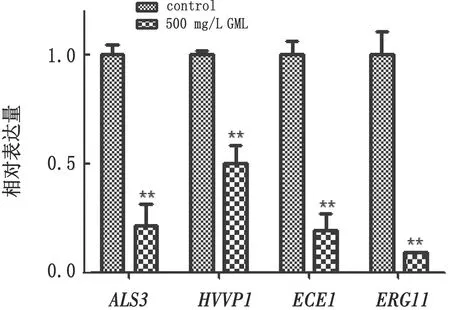
图8 GML对白色念珠菌生物被膜形成相关基因表达量的影响 与对照组相比,**.示P<0.01,n=3。下同
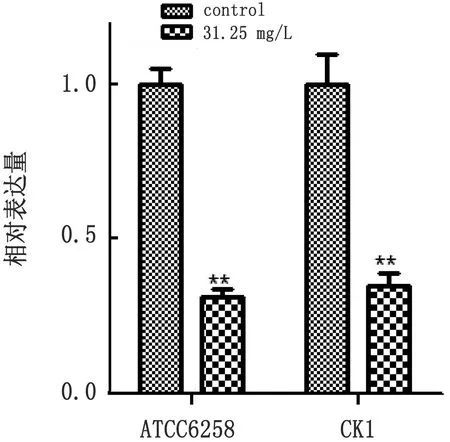
图9 GML对克柔念珠菌ERG11基因表达量的影响
念珠菌形成成熟的生物被膜后对抗菌药物治疗具有较强耐受性,目前治疗念珠菌生物被膜的药物的敏感性仍然很低[20]。GML作为一种酯型抑菌剂,具有亲水基团和易溶于生物被膜的疏水基团,可通过细胞壁与细胞膜相结合,使细胞膜的通透性和流动性发生改变,导致细胞自溶,破坏生物被膜。另外,GML从表面上松散已建立的细菌生物被膜,使生物被膜内分离的细菌被杀死[15]。本试验通过XTT法、Sport assay、激光共聚焦显微镜检测GML作用后对念珠菌生物被膜细胞代谢活性和结构的影响,发现GML干预24 h后各菌株的生物被膜活性均有显著抑制且呈现剂量依赖性抑制效果,GML对克柔念珠菌生物被膜形成的抑制作用优于白色念珠菌,当质量浓度达到500 mg/L对克柔念珠菌生物被膜形成的抑制作用达到100%。而且,GML不仅可以抑制生物被膜的形成,还可以破坏成熟生物被膜的维持,有效降低生物被膜的厚度和活力。
念珠菌具有许多毒力因子,可以促进生物被膜形成并在宿主体内定植较长时间,导致组织损伤[21]。首先,白色念珠菌形态转换是致病的核心,酵母相与附着和传播有关,而菌丝相使白色念珠菌更有效地入侵黏附宿主组织并形成成熟的生物被膜,逃避宿主吞噬细胞杀伤。本试验结果表明,GML能显著抑制念珠菌菌丝的形成,降低芽管的形成能力,高质量浓度可完全抑制菌丝生成。念珠菌黏附宿主表面的能力是感染期间成功定植和持久的先决条件。我们通过XTT试验计算真菌生长抑制率,较低质量浓度GML对克柔念珠菌生物被膜形成1,2,3,4 h早期黏附阶段抑制作用较白色念珠菌强,其作用具有质量浓度及时间依赖性。细胞表面疏水性(CSH)也与黏附和生物被膜形成密切相关。本试验结果显示,GML作用可以降低细胞表面相对疏水性,且呈浓度剂量依赖性,表明GML能通过降低CSH来阻碍其黏附作用。
白色念珠菌编码细胞壁蛋白的HWP1是在菌丝表面上表达的独特黏附基因,是生物被膜形成所必需的[22]。编码与α-凝集素类似的蛋白质的ALS3基因在黏附中起重要作用,也有助于生物被膜形成[23]。ECE1是菌丝诱导基因,可刺激菌丝的形成和延长。麦角甾醇合成途径中关键的编码基因ERG11,其过表达产物会导致白色念珠菌对唑类药物产生耐药性,并且有试验指出ERG11参与了白色念珠菌的黏附以及菌丝的形成这两个过程[24]。本试验结果表明, GML作用后,白色念珠菌ALS3、HWP1、ECE1和ERG11基因表达水平分别下调79%,50%,81%和91%;克柔念珠菌的ERG11基因分别下调69%和65%。总之,GML可以通过降低黏附,形态转变和杀真菌作用来抑制致病性念珠菌生物被膜的形成。
