1株鹅H5N6亚型流感病毒的分离鉴定与遗传进化分析
2020-09-25刘佳卉李子荷李军伟张传美蒋文明
刘佳卉,李子荷,李军伟,张传美*,蒋文明
(1.青岛农业大学 动物医学院,山东 青岛 266109;2.中国动物卫生与流行病学中心,山东 青岛 266032)
1996年在中国广东省首次从鹅体内分离到H5N1亚型禽流感病毒(AIV),2010年以后在中国的活禽市场中检测到H5N2、H5N6、H5N8等新亚型出现[1-2],2014年H5N6亚型AIV在中国四川省首次感染人类。据世界卫生组织报告,H5亚型AIV已经造成了数百人感染和死亡,在家禽养殖业中造成的经济损失更是难以估量。目前,将H5亚型流感病毒分为Clade0~9分支,在中国以Clade2.3.4.4为主,多种分支并存[3]。这些H5病毒持续进化,与不同的NA基因发生重排,组成新的亚型,目前有N1、N2、N6、N8亚型共同存在。有研究证实,目前流行的H5N6亚型是由H5N1和H6N6亚型重组而来[4]。近几年来H5N6亚型被监测到的比例增加,且毒株的致病力有逐渐增强的趋势[5]。
2018年7月份,在中国东部地区某散养鹅群中分离得到1株H5N6亚型流感病毒,本试验对其进行遗传进化分析和对SPF鸡致病性的研究,所有试验均在生物安全三级实验室完成。
1 材料与方法
1.1 试验动物及主要试剂6周龄SPF鸡及9日龄SPF鸡胚均购自济南斯派福瑞禽业科技有限公司。AIV荧光RT-PCR检测试剂盒购自QIAGEN公司;克隆载体试剂盒购自北京擎科新业生物技术有限公司;核酸提取试剂盒、胶回收试剂盒和E.coliDH5α购自TaKaRa公司。
1.2 采样及检测采集鹅的口腔拭子,提取核酸,使用QIAGEN公司的AIV荧光RT-PCR检测试剂盒检测。
1.3 引物合成比较GenBank中多个H5亚型AIV基因序列,参考HOFFMANN等[6]的全基因扩增引物,由青岛擎科梓熙生物技术有限公司合成8对全基因测序引物。
1.4 全基因测序及遗传进化分析分别扩增病毒的8个基因片段,PCR扩增产物经琼脂糖凝胶电泳检测,回收目的片段产物,克隆于T载体后,由青岛擎科梓熙生物技术有限公司进行序列测定。
测序结果使用SeqMan软件拼接,NCBI网站在线BLAST比对,在GenBank中下载参考序列。使用DNAStar软件对病毒的全基因序列进行同源性分析,并推导其氨基酸序列。用MEGA 7软件的Clustal W方法比对,用Neighbor-Joining方法基于遗传距离构建系统发育进化树,Bootstrap值为1 000。
1.5 鸡胚半数感染量(EID50)测定将病毒尿囊液进行10倍系列稀释,每个稀释度接种5枚9~10日龄的SPF鸡胚,0.2 mL/胚,37℃孵化,每12 h观察鸡胚的死亡情况,记录鸡胚的死亡时间。连续观察至120 h,将存活的鸡胚在4℃冷冻致死后,收集所有鸡胚的尿囊液,用血凝试验测定鸡胚的感染情况,参照Reed-Muench的方法计算病毒的EID50。
1.6 SPF鸡致病性试验将18只6周龄的SPF鸡作脚标编号,其中6只经滴鼻点眼的方法接种0.2 mL 含有106EID50的病毒尿囊液,3只不处置作为同居组;另外6只接种同样剂量无菌PBS 作为空白对照组。攻毒后连续观察14 d,记录SPF鸡的临床症状和死亡情况。
在攻毒后3 d,各组随机剖检攻毒组和空白对照组各3只,无菌采集其盲肠扁桃体、心脏、气管、肺脏、脑、肝脏、脾脏、肾脏和法氏囊9个脏器,各称取1 g,加入1 mL无菌PBS充分研磨至匀浆状,4℃、12 000 r/min 离心5 min,取上清液提取核酸,使用QIAGEN公司的AIV荧光RT-PCR检测试剂盒检测AIV核酸。
另外在攻毒后2,3,5,7,9 d定时采集口咽和泄殖腔棉拭子置于PBS中,-80℃保存,用于病毒检测。提取核酸,使用QIAGEN公司的AIV荧光RT-PCR检测试剂盒来测定病毒感染SPF鸡后的排毒情况。
2 结果
2.1 全基因测序及遗传进化分析测序结果用SeqMan软件拼接,NCBI网站在线BLAST比对分析发现,病毒的8个基因片段分别与不同的毒株相似度最高,其中NP基因与M基因均与人源H5N6亚型相似度最高,HA、NA、PA、NS与2015-2016年国内流行的H5N6亚型相似度最高,PB2基因来自H9N2亚型,PB1基因来自H5N1亚型,这表明该病毒的遗传来源非常复杂(表1)。
HA基因的遗传进化分析表明,HA基因位于Clade2.3.4.4分支中的Group C。与参考毒株A/chicken/Ganzhou/GZ21/2015(H5N6)同源性最高,为98%。与参考毒株A/goose/Guangdong/1/1996(H5N1)的同源性为91.4%(图1)。
氨基酸序列分析结果表明,HA基因具有9个潜在糖基化位点(表2)。HA蛋白的裂解位点处PLRERRRKRGLF具有多个连续碱性氨基酸,符合高致病性AIV分子特征。
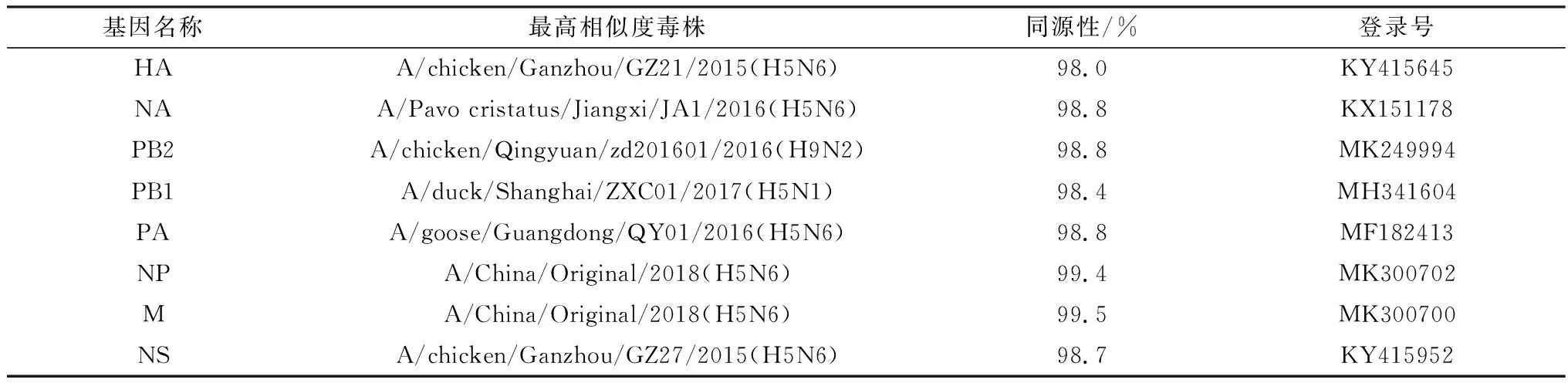
表1 该H5N6亚型分离株序列比对分析

图1 分离株HA基因的进化树
在耐药性位点分析中,NA氨基酸序列的119位为E,152位为R,275位为H,293位为R,295位为N,这些氨基酸位点均没有发生突变,可以推测该病毒对神经氨酸酶抑制剂类药物如扎那米韦和奥司他韦类药物仍然敏感。在M2蛋白中没有发现与金刚烷胺耐药性相关的氨基酸位点的改变,推测对金刚烷胺类药物依然敏感。

表2 分离株HA潜在糖基化位点分析
2.2 EID50测定测得该毒株的EID50为 10-6.25/0.2 mL。
2.3 SPF鸡致病性试验通过滴鼻点眼途径将病毒感染SPF鸡后,连续观察14 d并记录各组死亡情况,感染组在4 d内全部死亡,同居组在5 d内全部死亡,对照组无死亡(图2)。
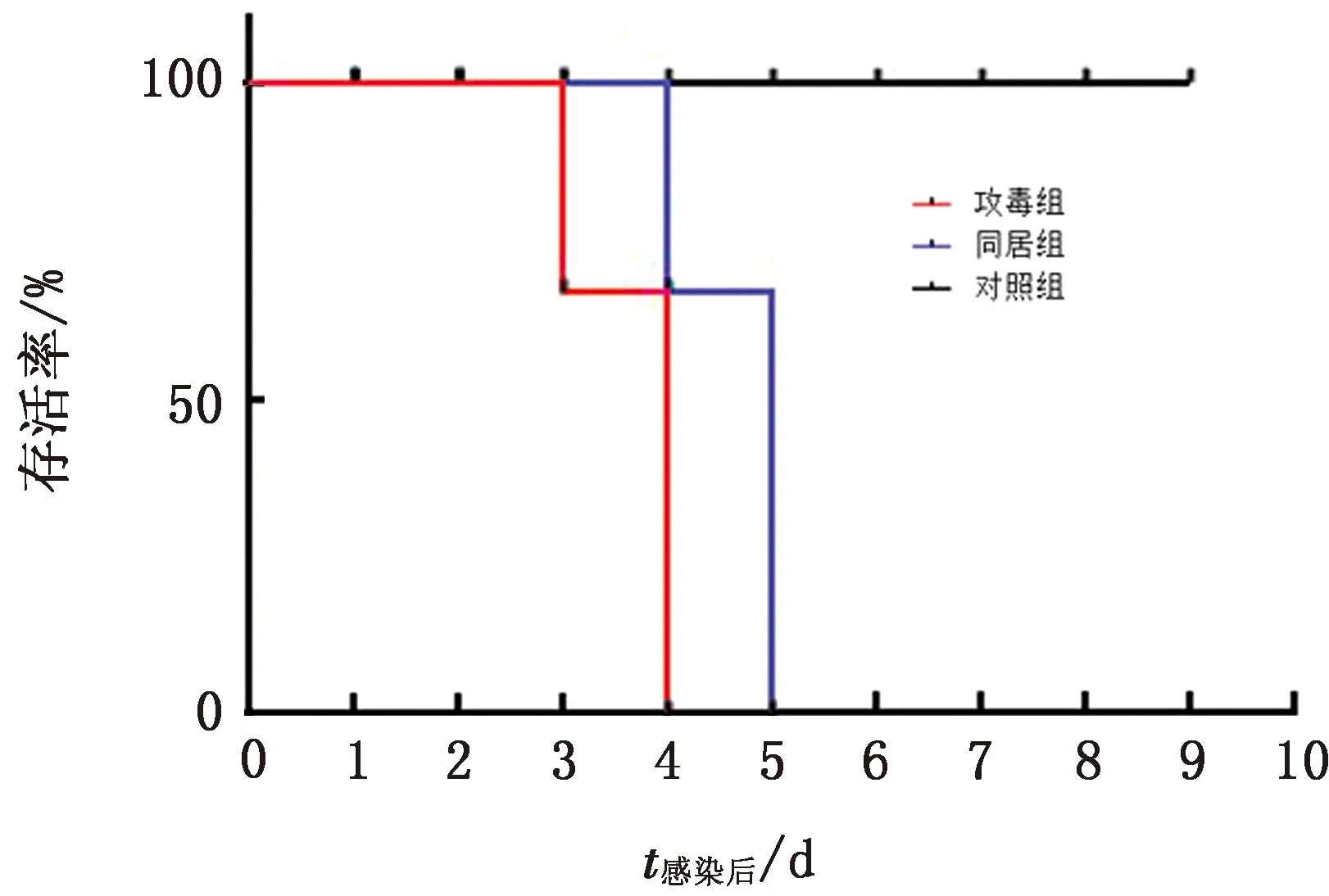
图2 SPF鸡攻毒后的存活率
2.4 H5N6亚型AIV在SPF鸡体内的复制情况和排毒情况在攻毒后3 d剖杀感染组和对照组鸡各3只,感染组和同居组被检的9个脏器(盲肠扁桃体、气管、心脏、肝脏、肺脏、脾脏、肾脏、脑和法氏囊)均能检测到病毒复制;对照组未检测出病毒的复制。试验结果说明该毒株在SPF鸡各脏器均能复制。
3 讨论
调查过程中我们发现,该养殖户在一片桃林中散养了大约百余只鹅,意在建设一个小型的简易生态农场:鹅吃树下的草和虫子,所排粪便可为桃树提供肥料。而且我们发现该桃林与一片野生树林毗邻,树林中有大量的鸟类包括多种候鸟栖息,这就为流感病毒的传播埋下了隐患。这些散养的鹅可能通过与野鸟或其排泄物、羽屑等接触而感染病毒。
Clade2.3.4.4分支的H5亚型流感病毒在全球各地与不同的NA基因片段和内部基因片段发生重组,已经产生了H5N1、H5N2、H5N6、H5N8等不同的亚型[7]。该分支的病毒进化速度快,几年间已经进化为多个亚分支,本试验的鹅源分离株属于GroupC,与国内近年H5N6亚型病毒的进化关系密切,其裂解位点序列符合高致病性AIV的分子特征。对SPF鸡致病性的研究结果表明,该分离株能够感染鸡,SPF鸡的死亡率为100%,病毒在鸡的各组织脏器中均能够有效复制,表明该分离株对鸡的致病性较强。
高致病性AIV发病突然、死亡迅速、传染性很强,除了给家禽养殖业造成严重损失之外,也给人类健康带来极大威胁。到目前为止,H5亚型AIV已经造成了数百人的感染和死亡,越来越多的AIV获得了跨越宿主限制感染人类的能力[8]。本试验分离株的NP基因与M基因均与人类H5N6亚型分离株遗传进化关系密切,可能具有感染人类的风险,这警示我们应该密切关注野鸟及家禽中AIV的流行和变异情况。
