1株乳源蜡样芽胞杆菌的分离鉴定及致病性分析
2020-09-25易华山马鲜平廖启超张云珍邓艳红陈忠琼梁望旺谢远兵
易华山,马鲜平,赵 瑶,廖启超,朱 飘,张云珍,王 艳,邓艳红,郑 凯,陈忠琼,梁望旺,谢远兵
(1.西南大学 动物科学学院,重庆 402460;2.重庆市兽医科学工程研究中心,重庆 402460;3.重庆市荣昌区昌元街道农业服务中心,重庆 402460;4.重庆市动物疫病预防控制中心,重庆 401120;5.重庆市永川区动物疫病预防控制中心,重庆 402160)
蜡样芽孢杆菌(Bacilluscereus,Bc)是芽孢杆菌属的一种革兰阳性、兼性厌氧、产芽孢的条件性致病菌[1-2]。研究表明,Bc在低温或高温条件下生长,广泛分布于土壤、水、空气、动物饲料、蔬菜、食品和环境中而极易造成食品、饲料污染而引起食品腐败、人和动物食物中毒;也是引致人和动物眼球炎等肠外感染及心内膜炎、脑膜炎及菌血症等系统性感染及医院感染的重要病原菌[1-3]。不同的细胞外毒力因子决定Bc毒性,临床分为腹泻型和呕吐型。溶血素BL (HBL)和非溶血性肠毒素(NHE)为hblA、hblC、hblD及nheA、nheB、nheC基因编码的三重蛋白复合物,还有细胞毒素K (cytK)、肠毒素FM (entFM)、肠毒素S (entS)、肠毒素T (bceT)分别为cytK、entFM、entS、bceT基因编码的单基因产物,它们引起腹泻型;呕吐型菌株毒力与呕吐毒素有关,它是由Ces基因编码的非核糖体肽合成酶合成的热稳定环十二肽,这些毒力因子与人和动物食物中毒密切相关[4-6]。Bc在动物生产设备、工业或医学设备上形成生物膜而抵抗常用消毒剂消杀,因此,Bc在食品加工和医院环境中广泛存在,成为医院感染的主要病原之一[2]。近年来,由Bc引起的食品安全问题愈发严重,特别是乳源条件致病性Bc对婴幼儿乳制品的污染及耐药性Bc株的致病性令人堪忧[3,7-8]。多位点序列分型(multilocus sequence typing,MLST)是一种基于管家基因PCR扩增与核苷酸序列测定相结合,广泛用于细菌种属结构分析和溯源性研究的分析方法[9-11]。本试验从奶牛乳房炎患牛奶样中,通过MYP选择性培养基、蜡样芽孢杆菌显色培养、全自动微生物鉴定系统、16S rRNA、药敏试验、MLST分型及对小鼠致病性分析等,分离鉴定出1株奶源耐药致病性Bc,为防控奶源Bc污染及奶牛乳房炎防治提供依据。
1 材料与方法
1.1 试验动物及主要试剂18~22 g清洁级BALB/c小鼠,雌雄各半,购自重庆腾鑫生物技术公司。Tris碱、YEAST EXTRACT、TRYPTONE购自OXOID公司;琼脂糖购自碧云天生物技术公司;PCR premix购自TaKaRa公司;DL2000 DNA Marker购自全式金生物技术有限公司;细菌基因组DNA提取试剂盒购自北京天根生物技术有限公司;MYP培养基及蜡样芽孢杆菌显色培养基购自上海科玛嘉生物有限公司;BD BBL Crystal 革兰阳性菌鉴定试剂盒(245240,荧光法+比色法)购自碧迪医疗器械(上海)有限公司;丙氨酸氨基转移酶(谷丙转氨酶/ALT/GPT)试剂盒(C009-3-1,IFCC紫外比色法)、天门冬氨酸氨基转移酶(谷草转氨酶/AST/GOT)试剂盒( C010-3-1,IFCC紫外比色法)、乳酸脱氢酶(LDH)试剂盒 (A020-1-2,比色法)、碱性磷酸酶(ALP)测定试剂盒(A059-3-1,IFCC紫外比色法)、谷胱甘肽过氧化物酶( GSH-Px )(A005-1-1,比色法)、超氧化物歧化酶(SOD)(A001-3-1,WST-1 法)和丙二醛( MDA )(A003-1-2,TBA法)检测试剂盒均购自南京建成生物制品有限公司;其他常用试剂为进口或国产。
1.2 细菌分离、生长及染色特性无菌采集重庆某奶牛场乳房炎患牛奶样,经MYP选择性培养基划线培养分离出1株疑似蜡样芽孢杆菌,进行革兰染色观察。用接种环划线接种在普通琼脂平板、血平板及蜡样芽孢杆菌显色平板上,37℃培养24 h,进行生长特性及染色特性观察。
1.3 全自动微生物鉴定系统生化鉴定对分离菌株单菌落连续在MYP培养平板上划线接种,再挑取单菌落继续在蜡样芽孢杆菌显色培养基上进行划线接种,经10次分离纯化,革兰染色、镜检菌体形态及染色特性后,将其进行LB液体培养基培养18 h,选用BD BBL Crystal GP鉴定卡进行生化鉴定,具体操作按BD BBL CrystalTM革兰阳性菌鉴定试剂盒(荧光法+比色法)操作步骤进行。
1.4 Bc 16S rRNA的鉴定挑取纯培养的菌落至3 mL LB液体培养基中,37℃培养16 h,按照细菌基因组DNA提取试剂盒(北京天根生物技术有限公司)说明书操作步骤进行细菌基因组提取。采用通用引物27F和1492R,以提取的细菌基因组为模板,进行PCR扩增16S rRNA基因。PCR反应条件:95℃预变性4 min;95℃变性45 s,60℃退火50 s,72℃延伸60 s,35个循环;72℃延伸8 min。取PCR扩增产物5 μL于1%琼脂糖凝胶电泳检测后,对纯化的PCR产物送华大基因重庆测序部进行测序,测序结果进行 BLAST比对;利用MEGA7.0软件基于NJ法进行分离菌株16S rRNA基因系统进化树分析,建树检验方法设置为Bootstrap method,检验次数为1 000次,Transition+Transversions计算遗传模型距离。
1.5 药敏试验吸取100 μL分离菌纯培养液用涂菌棒在血平板中涂布均匀,再用无菌镊小心夹取16种药敏纸片,按美国临床实验室标准委员会推荐的K-B纸片法进行药敏试验。
1.6 Bc的MLST分型根据Bc的MLST数据库(http://pubMLST.prg/bcereus/)所提供的glpF、gmK、ilvD、ilvD2、pta、pur、pycA、tpi管家基因引物序列,由华大生物技术有限公司合成。以分离菌基因组DNA为模板,分别用8对管家基因引物进行PCR扩增。反应体系为PCR Mastermix 12.5 μL,DNA模板1 μL,Reversed primer 1 μL,Forward primer 1 μL,ddH2O调至终体积25 μL。反应条件:95℃预变性5 min;95℃变性45 s,60℃退火45 s,72℃延伸30 s,35个循环;72℃ 5 min。取5 μL PCR产物在1%琼脂糖凝胶(含EB)上进行电泳检测后送华大生物技术有限公司进行双向测序,对所测序列在https://pubmlst.org上进行比对分析,得到相应的等位基因编码(aelle ID)。8个等位基因编码上传至相应的基因座中,自动匹配出序列类型MLST profiles,并选取匹配成功ST型基因编码相关的Bc 20株,使用MEGA7.0基于NJ法进行系统发育树分析。
1.7 Bc毒力相关基因PCR扩增以分离菌基因组DNA为模板,参考文献[4]以hblA、hblC、hblD、nheA、nheB、nheC、cytK、entFM、Ces基因引物序列(表1),由华大生物技术有限公司合成。PCR扩增体系为PCR Mastermix 12.5 μL,DNA模板1 μL,Reversed primer 1 μL,Forward primer 1 μL,ddH2O调至终体积至25 μL。反应条件:95℃预变性5 min;95℃变性45 s,58℃退火45 s,72℃延伸30 s,35个循环;72℃ 5 min。取5 μL PCR产物在1%琼脂糖凝胶(含EB)上进行电泳检测后送华大生物技术有限公司进行双向测序。

表1 毒力相关基因引物序列
1.8 对小鼠的致病性试验试验前用PCR方法检测试验小鼠粪便BcentFM基因呈阴性。试验小鼠饲养在严格消毒的鼠笼内,自由采食、饮水,每天定时更换垫料,攻毒前禁食8 h、不禁水。饲料、垫料由重庆腾鑫生物技术公司订购,采用常规方法对试验小鼠的饮用水、饲料、垫料进行Bc检测,结果呈阴性。参考文献[12]制备4×1012CFU/mL攻毒菌液,对攻毒菌液进行 100,10-1,10-2,10-3倍比稀释。随机将50 只 BALB/c 小鼠分为 4 个试验组和1个对照组,10 只/组,不同稀释度菌液0.5 mL/只,其中 5 只口服接种, 5 只腹腔接种;对照组小鼠分别口服、腹腔注射等体积培养基,连续观察 30 d,并统计发病及死亡情况,及时剖检死亡及异常小鼠,进行HE染色显微镜观察组织病变。采用累计法(Reed-Muench法)[13]计算半数致死量(LD50)。无菌采集小鼠心、肝脏、脾脏、肺脏、肾脏等组织及肠内容,接种至Bc显色培养基培养24 h,常规菌落PCR方法进行分离鉴定。小鼠ALT、AST、LDH及ALP血清指标及肝组织GSH-Px、SOD和MDA含量测定按南京建成生物公司检测试剂盒操作说明进行。
2 结果
2.1 分离菌生长及染色特性分离菌在甘露醇卵黄多黏菌素琼脂(MYP)平板上37℃培养18 h生长良好,形成周围有白色至淡粉红色的融蜡样菌落(图1A);在Bc显色培养基上形成具有白色光晕的蓝色菌落(图1B);在血平板上,形成白色蜡样菌落(图1C)。显微镜观察,革兰染色阳性,菌体为杆状,呈链状排列,两端钝圆,可形成芽孢,芽孢有的位于中心有的稍偏于一端(图1D)。
2.2 生化鉴定挑取Bc显色培养基培养的单菌落,接种液体LB培养基中37℃培养18 h后,再经革兰染色,应用全自动微生物鉴定系统进行生化鉴定。结果显示,荧光阴性对照呈阴性(FCT-),L-苯丙氨酸-AMC阳性(FPH+),L-色氨酸-AMC阳性(FTR+),4MU磷酸盐阳性(FHO+),海藻糖阳性(TRE+),蔗糖阴性(SUC-),阿拉伯糖阴性(ARA-),p-硝基苯基-β-D-葡萄糖苷阳性(BGL+),p-硝基苯基-磷酸酯阳性(PHO+),尿素阴性(URE-),4MU-β-D-葡萄糖苷阴性(FGC-),4MU-α-D-葡萄糖苷阳性(FGS+),L-精氨酸-AMC阴性(FAR-),4MU-β-D-葡萄糖苷酸阴性(FGN-),乳糖阴性(LAC-),甘油阴性(GLR-),p-n-p-β-D-二糖苷阳性(PCE+),p-硝基酚-α-D-麦芽糖甙阴性(PAM-),七叶苷阳性(ESC+),L-缬氨酸-AMC阳性(FVA+),L-焦谷氨酸-AMC阳性(FPY+),4MU-N-乙酰基-β-D-半乳糖胺阳性(FGA+),L-异亮氨酸-AMC阳性(FIS+),甲基-α&β-配糖物阴性(MAB-),麦芽三塘阴性(MTT-),果糖阳性(FRU+),脯氨酸&亮氨酸-p-硝基苯胺阳性(PLN+),ONPG& p-N-p-β-D-糖苷阴性(FGO-),精氨酸阳性(ARG+),鉴定为Bc,鉴定概率为99.9%,命名为Bc 2018CQ-CMM01株。
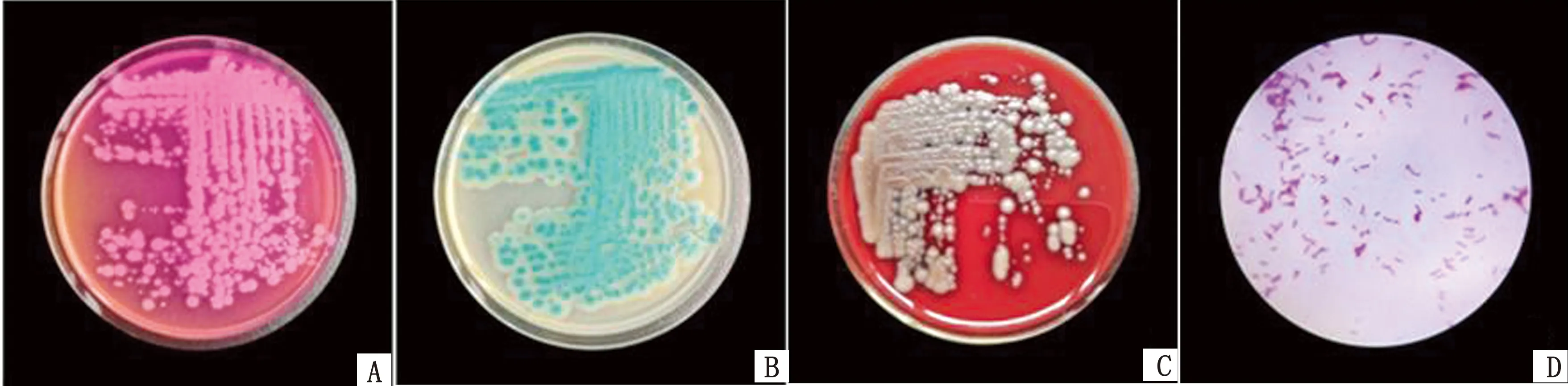
图1 Bc分离株的生长及染色特性 A.甘露醇卵黄多黏菌素琼脂(MYP)平板;B.Bc显色培养基;C.血平板;D.显微镜观察
2.3 Bc 16S rRNA的鉴定取2018CQ-CMM01分离株菌液5 mL,利用细菌基因组提取试剂盒提取基因组DNA,通过核酸质量浓度检测仪检测质量浓度为215.9 mg/L,利用引物27F和1492R进行PCR扩增,经琼脂糖凝胶电泳检测后产物送重庆华大基因公司测序,测序结果经NCBI BLAST在线软件比对分析,该基因序列和GenBank中的Bc韩国(FJ982661.1)、美国(NZ_JURK01000037.1)、斯里兰卡(MG827268.1)、马来西亚(MN093796.1)株同源性为100%,与美国(NZ_ASPZ01000016.1)株同源性为99.9%;同孟加拉国(MH741259.1)、埃及(AF390086.1)、印度(KC990812.1)、菲律宾(MK968814.1)、伊拉克(MK480518.1)株同源性为99.5%以上。使用MEGA7.0基于NJ法建立2018CQ-CMM01株16S rRNA基因系统发育树,发现2018CQ-CMM01株与韩国(FJ982661.1)、孟加拉国(MH741259.1)、美国(NZ_JURK01000037.1)、埃及(AF390086.1)、斯里兰卡(MG827268.1)、印度(KC990812.1)、马来西亚(MN093796.1)、菲律宾(MK968814.1)、伊拉克(MK480518.1)和美国(NZ_ASPZ01000016.1)分离株聚为一类,同日本(NZ_BIYE01000043.1)、南非(NZ_QNGD03000042.1)株聚为一大类,同美国(NZ_ASPZ01000016.1)分离株亲缘关系最近(图2)。
2.4 药敏试验通过药敏纸片K-B方法,对分离株进行药敏试验,将复方新诺明、大观霉素等16种革兰阳性菌药敏纸片呈梅花形均匀贴在已涂布分离菌的琼脂平板上,测量抑菌圈直径来判定细菌对测定药物的敏感程度,结果显示分离的Bc对青霉素G、红霉素、苯唑西林、四环素、克拉霉素、环丙沙星、左氧氟沙星等极度敏感,对大观霉素、万古霉素、多黏菌素B耐药(表2)。
2.5 管家基因PCR扩增及MLST分型以分离株基因组DNA为模板,分别用8个管家基因的特异性引物进行PCR扩增,扩增产物电泳检测获得500 bp 左右的目标条带(图3)。8个管家基因PCR产物测序序列在https://pubmlst.org的Bc数据库比对查询等位基因序列,获得7个相应的等位基因编码(allele),多位点序列分型结果显示该分离菌株基因型为ST476。选取与该型基因编码相关Bc 20株ST型(表3),与ST476基因座序列进行系统进化分析,表明ST476与ST1813、ST1341、ST1832、ST2350、ST825聚为一类,同ST2327、ST764和ST1815处于不同的进化分支上,并与ST74及ST2214处于不同的进化分支上,ST476与ST1813亲缘关系最近(图4)。
2.6 Bc毒力相关基因PCR扩增以分离菌基因组DNA为模板,分别以hblA、hblC、hblD、nheA、nheB、nheC、cytK、entFM、Ces基因引物序列进行PCR扩增,扩增产物电泳检测,结果hblA、hblC、hblD、nheA、nheB、nheC、cytK、entFM基因扩增片段分别为480,750,550,300,730,400,800,1 200 bp,同预期片段大小一致;没有扩增出Ces基因的目的片段(图5)。对扩增产物测序结果表明,nheA基因片段同日本分离的炭疽杆菌(AP019731.1)毒力基因同源性高达96.91%,entFM基因片段同美国Bc(CP001186.1)同源性为97.45%,nheB基因片段同挪威Bc(CP001283.1)同源性高达95.48%,其他基因测序结果表明均为Bc毒力相关基因(表4)。

图2 分离菌16S rRNA基因系统进化树
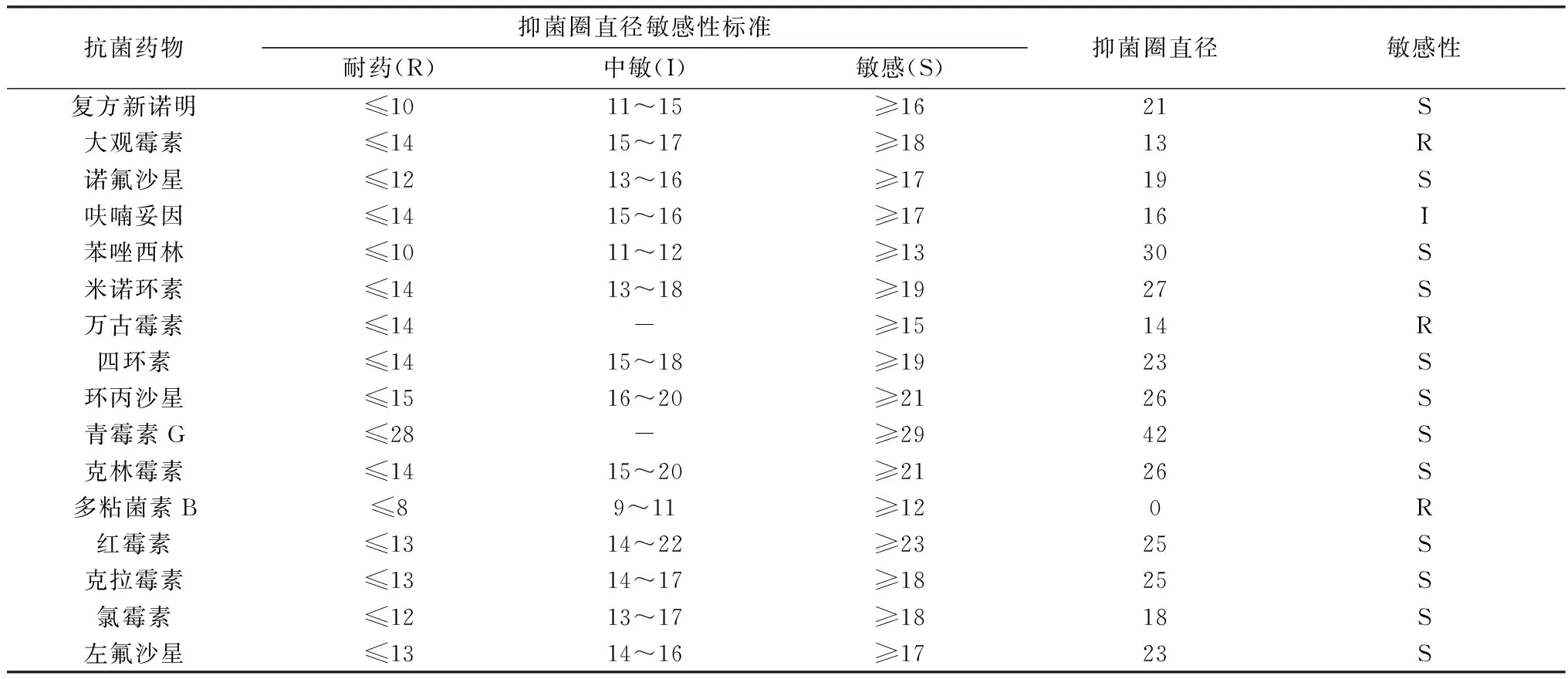
表2 分离菌株的药物敏感性试验结果 mm
2.3 小鼠致病性试验攻毒后小鼠均出现不同程度的腹泻、采食量下降、被毛松乱、精神沉郁、嗜睡等症状。攻毒后5 d最高剂量组(4×1011CFU/mL)小鼠开始出现死亡,攻毒后10 d最高剂量组小鼠全部死亡。次剂量组(4×1010CFU/mL和4×109CFU/mL),分别死亡8只和6只,死亡时间主要集中在攻毒后11~13 d。最低剂量组(4×108CFU/mL)未出现死亡,对照组小鼠未发病和死亡。采用Reed-Muench法计算该分离菌LD50为 1.44×1010CFU。剖检发病死亡小鼠,发现肝表面颜色变淡,肿大、质脆,呈黄白色,剂量越大,颜色越淡,有的出现明显散在坏死灶;脾脏肿大,充血;肺脏有出血坏死;心肌变性坏死;肠道黏膜脱落,肠道内充满黄褐色水样液体等病变特征;同剂量组死亡小鼠中,经腹腔注射攻毒小鼠病变更加明显。无菌条件下采集病死小鼠肝脏、肠内容物及肺脏中均分离出目的细菌,经菌落PCR扩增,PCR产物测序,比对为目的菌。与正常对照组比较,不同剂量Bc攻毒组小鼠血清ALT、AST、LDH及ALP含量均明显升高,差异显著 (P<0.05 )。与正常对照组比较,不同剂量Bc攻毒组小鼠肝脏组织SOD、GSH-PX含量明显降低,MDA含量显著升高,差异显著(P<0.05)(表5)。对次剂量组(4×1010CFU/mL)小鼠剖检,取肝脏经HE染色观察正常组小鼠肝中央静脉、肝血窦结构清晰,肝细胞无坏死、变性。攻毒组肝细胞肿大、肝索排列紊乱,肝细胞空泡变性,肝血窦变窄;肠黏膜脱落,变性坏死;肾间质淤血,肾小管上皮细胞脱落,近曲小管上皮细胞坏死、脱落及出现蛋白管型,肾小囊腔增宽、出血等(图6)。
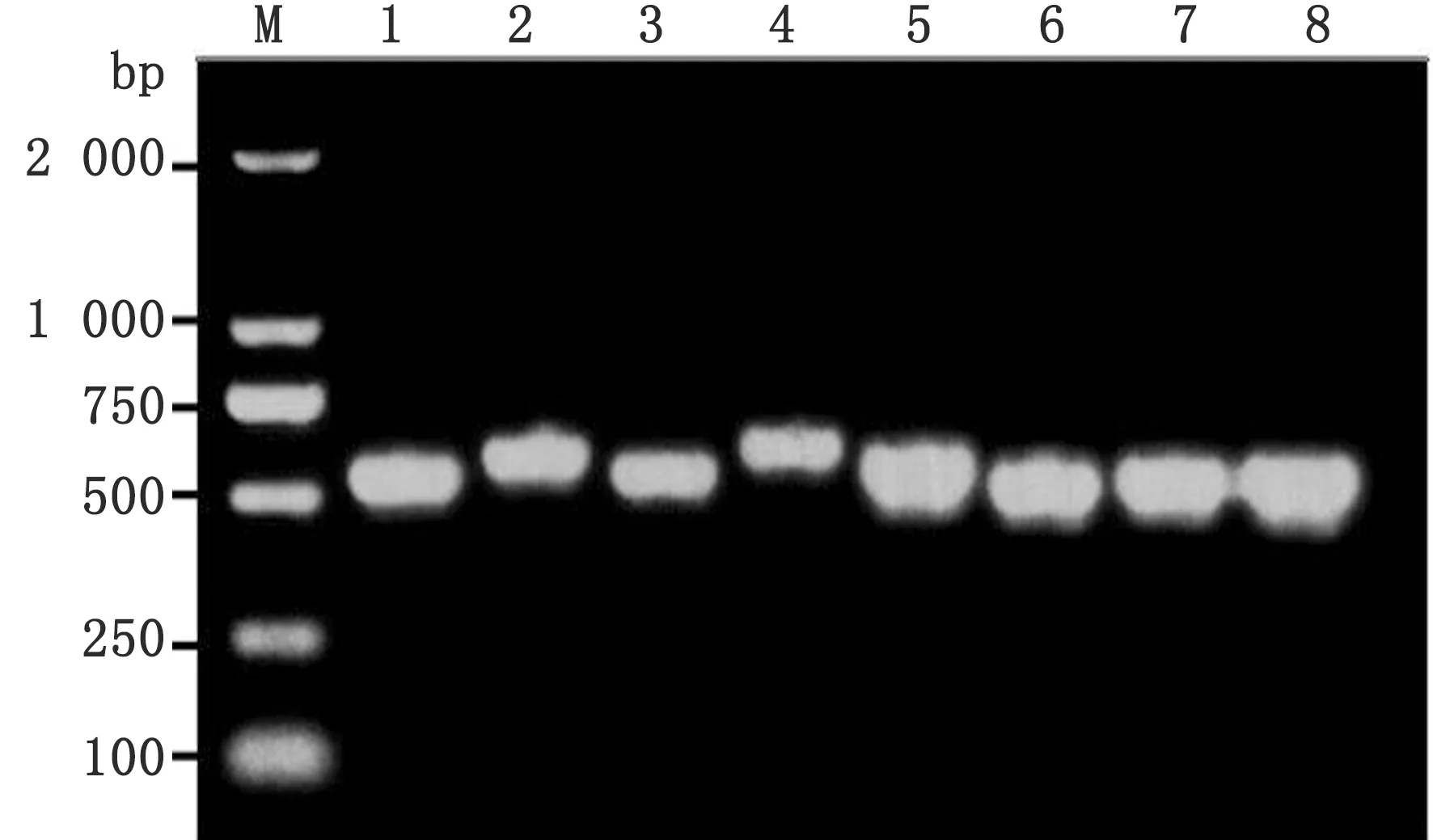
图3 分离菌管家基因PCR产物 M.DL2000 DNA Marker;1~8.分离菌glpF、gmK、ilvD、ilvD2、pta、pur、pycA及tpi扩增产物
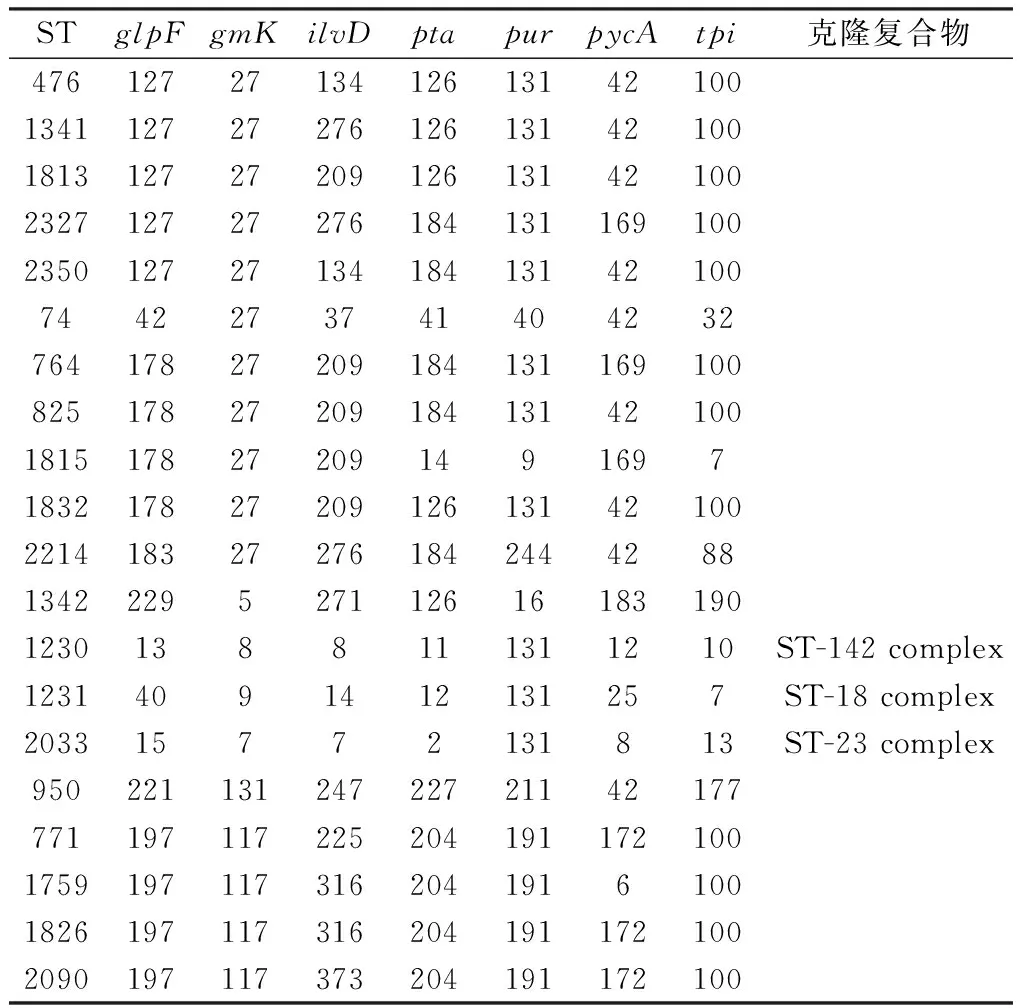
表3 Pubmlst数据库Bc 20株ST型
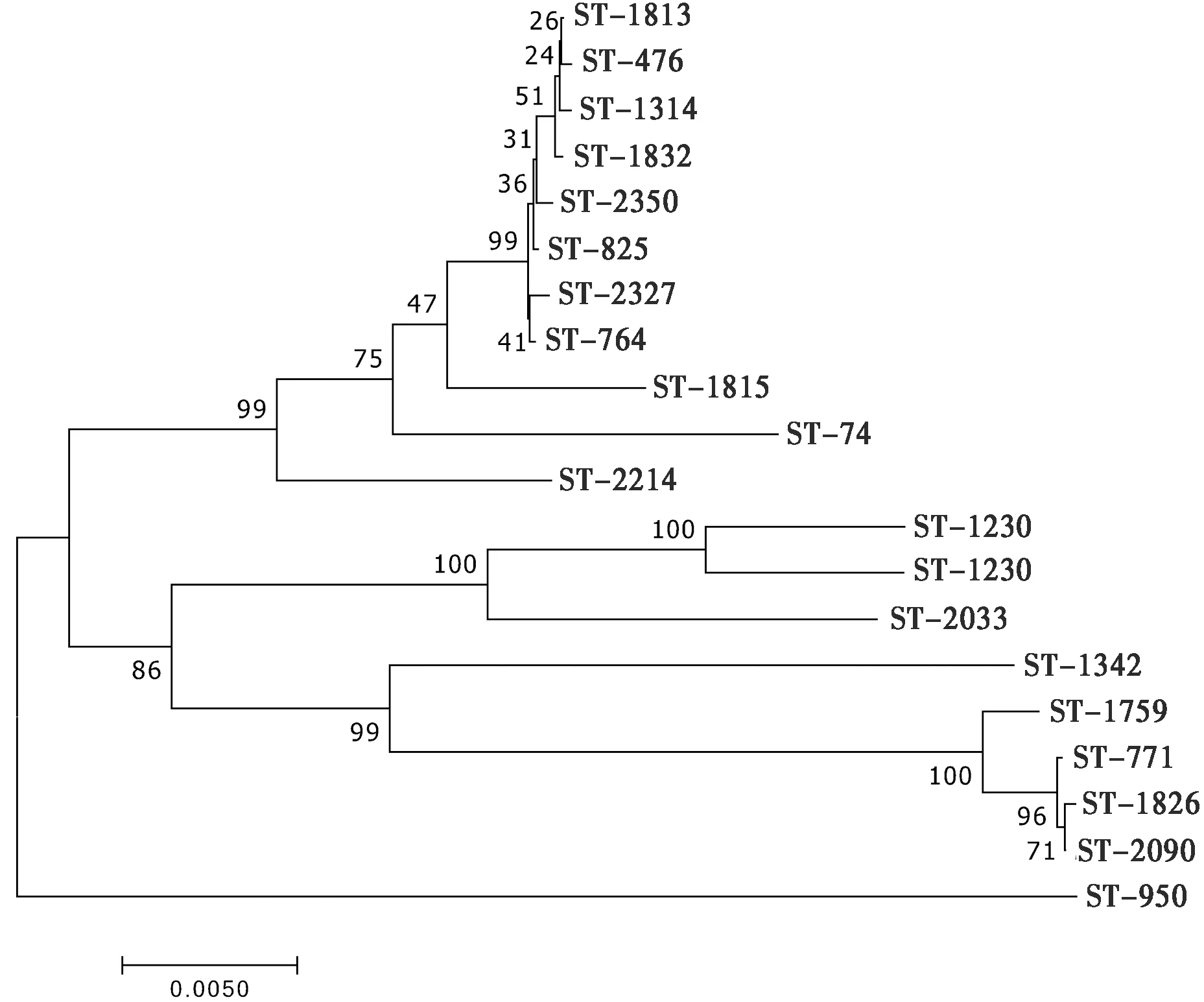
图4 不同ST型20株Bc系统进化树

图5 分离菌毒力相关基因PCR产物 M.DL2000 DNA Marker;1~9.分离菌hblA、hblC、hblD、nheA、nheB、nheC、cytK、entFM及Ces基因扩增产物
3 讨论
Bc是革兰阳性或不确定、产芽孢、需氧杆菌,通常存在于各种自然环境和食物基质中,是一种条件性致病菌[1,14-15]。目前的研究认为Bc广泛存在于乳牛场环境及奶制品加工设施中,导致了鲜奶及奶制品污染;特别是从巴氏杀菌奶中分离的Bc更适应在低温环境生长,有些能在低温(6℃)牛奶中生长从而导致奶制品变质及人类食物中毒[16-17]。本试验利用MYP选择培养基、Bc显色培养基分离培养得到1株疑似Bc的纯培养物,经全自动微生物生化鉴定、16S rRNA扩增从乳房炎患牛奶样中分离鉴定了1株耐药Bc(2018CQ-CMM01)株。研究表明,大肠埃希菌、金黄色葡萄球菌、粪肠球菌、克雷伯菌、乳房链球菌、停乳链球菌等是奶牛乳房炎的主要致病菌,也有研究表明Bc也是奶牛乳房炎的病原菌之一[18-19]。2017年,OWUSU-KWARTENG等[4]从30份生奶样品中分离出14株Bc,对青霉素、阿莫西林、头孢吡肟100%耐药,而对苯唑西林(92%),氨苄西林(98%)等β-内酰胺类抗生素耐药,而对氯霉素、四环素、红霉素、庆大霉素、万古霉素、克林霉素、环丙沙星、新诺明、达福曾汀等敏感。本试验中Bc分离株2018CQ-CMM01对氯霉素、四环素、红霉素、克林霉素、环丙沙星、新诺明等敏感,对万古霉素、多黏菌素B、大观霉素、青霉素耐药,可见本试验中分离株的耐药性不同于OWUSU-KWARTENG等[4]分离株,这种有别于其他Bc β-内酰胺耐药的分子机制有待进一步研究。

表4 分离菌毒力基因特征
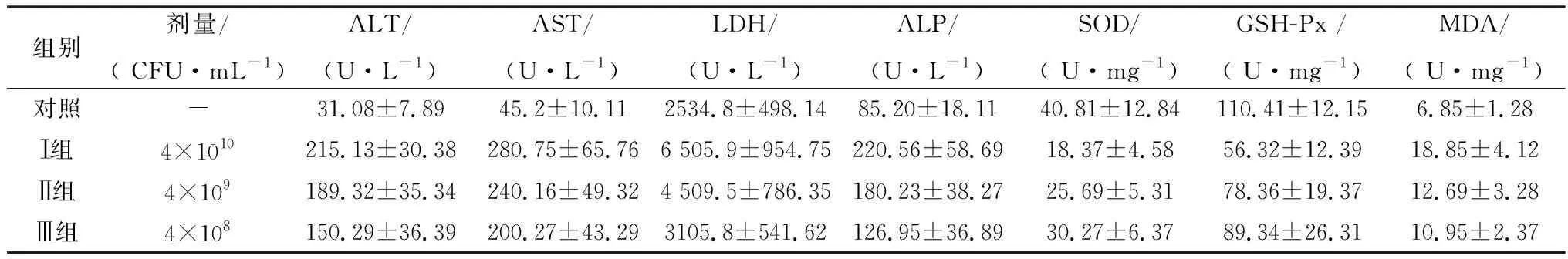
表5 Bc对小鼠ALT、AST、ALP、SOD、GSH-Px和MDA的影响
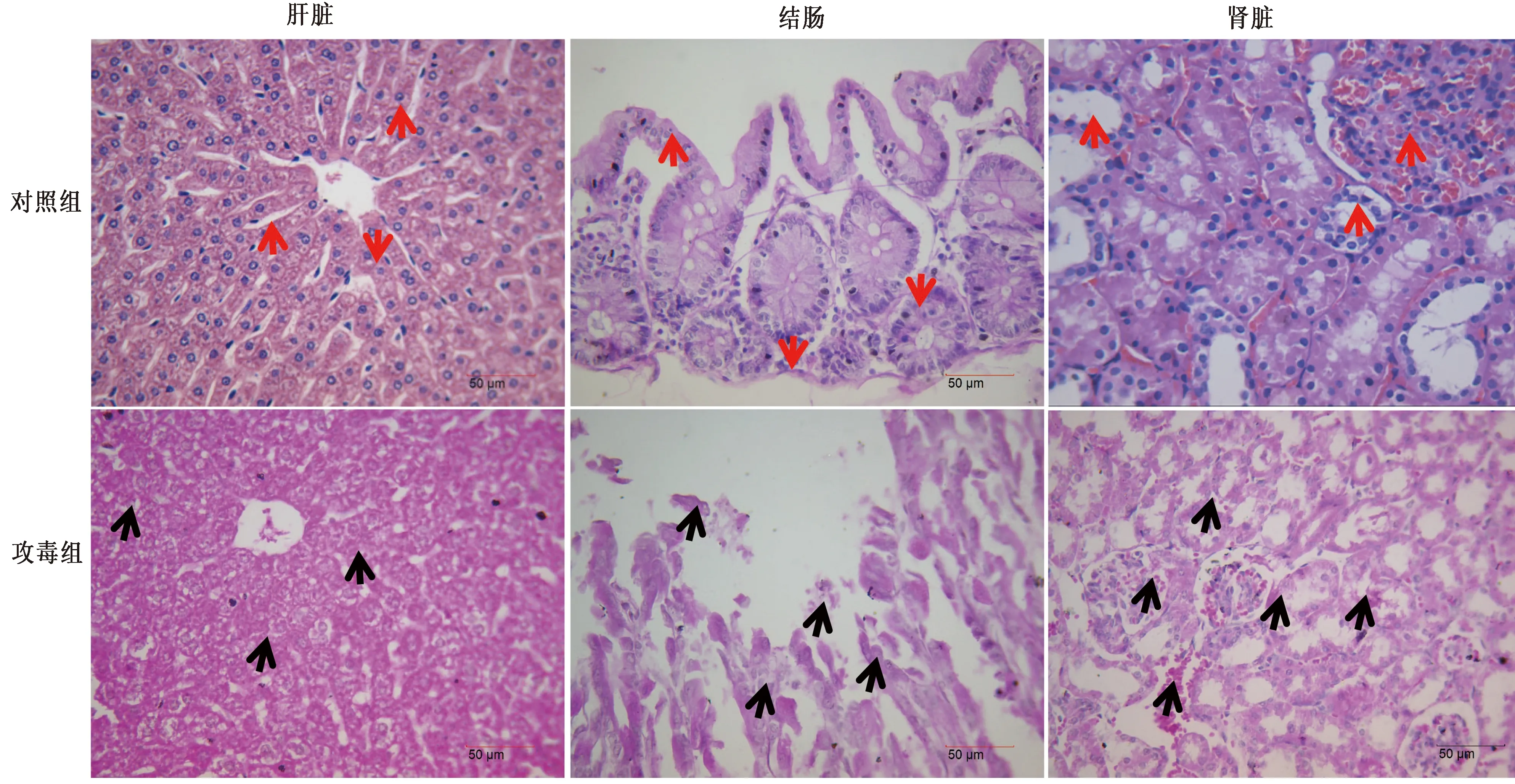
图6 Bc感染小鼠组织病理变化(HE染色)
核糖体蛋白是细菌核糖体重要的保守组分,是细菌鉴定和系统发育关系研究的理想靶点[20]。本试验中分离株2018CQ-CMM01 16S rRNA序列与GenBank韩国(FJ982661.1)、美国(NZ_JURK-01000037.1)、斯里兰卡(MG827268.1)、马来西亚(MN093796.1)株同源性为100%,与美国(NZ_ASPZ01000016.1)株同源性为99.9%;在系统进化上同美国(NZ_ASPZ01000016.1)株亲缘关系最近。研究表明,分离于巴氏消毒奶的美国Bc株(NZ_ASPZ01000016.1)可在6℃低温条件下生长,比较基因组学研究结果进一步表明,细菌的冷适应性同细菌基因组编码的一系列具有冷适应特征的肽酶及冷适应相关的蛋白(如DEAD-box helicases、伴侣蛋白DnaJ)有关;对一些致病性的Bc株DnaJ和MLST分型研究表明,Bc流行株与炭疽杆菌密切相关[7,16]。本试验中分离株2018CQ-CMM01是否具有冷适应相关的基因特征有待于进一步研究。
MLST通过分析多个(6~8个)管家基因内部片段核苷酸序列,对每个基因点指派1个等位基因数值,从而建立对应的等位基因图谱,由于其高度的可重复性和可比性,可进行全球范围内的细菌进化分析和分子流行病学调查研究[9,17]。我国从2012年首次上传乳源分离株至今,有94个乳源分离株在库,分为86个ST型,本试验得到的ST476不包括其中,ST476可能为中国新型乳源Bc分离株[17]。ST476与ST1813、ST1341、ST1832、ST2350、ST825之间亲缘性较近,表明在这些不同地区、不同来源菌株之间MLST分型的管家基因相对保守,可用来研究细菌进化特征与趋势以及大规模分子流行病学调查研究,为阻止致病菌传播和感染提供科学参考。
研究也表明,Bc的hblA、hblC、hblD、nheA、nheB、nheC、cytK、entFM、bceT、hlyII共10个肠毒素基因和cesB呕吐基因被认为是Bc特有的毒力因子,通常认为肠毒素基因与腹泻相关,而呕吐基因与呕吐有关,这些基因编码各种肠毒素和其他毒性因子,被认为在哺乳动物感染中发挥重要作用[21-22];其中45%的Bc菌株含有hblACD,93%的菌株含有nheABC基因簇,cytK、entFM、bceT、hlyII、cesB基因阳性率分别为73%,96%,75%,54%,5%[14]。研究也表明,芽孢杆菌属苏云金芽孢杆菌、Bc及炭疽杆菌等在拥有相同或类似的毒力基因,Bc肠毒素基因和其他毒力因子基因在炭疽杆菌和苏云金芽孢杆菌中均有广泛分布[3,23-24]。本研究中,hblA、hblC、hblD、nheA、nheB、nheC、cytK、entFM基因同Bc和炭疽杆菌同源性较高,没有扩增到Ces基因,表明本试验中分离株可能属于腹泻型Bc。最新的研究也表明,在新生儿重症监护室、蔬菜、巴氏消毒奶及零售食品、大米等分离鉴定出致病性Bc,因此加强Bc腹泻型和呕吐型相关毒力评价和建立风险评估机制对有效控制Bc的污染,防范Bc引起的食物中毒都具有重要意义[3-4,24-26]。
研究表明,ALT、AST、LDH反映肝脏蛋白合成及分解代谢状况,其血清活性的升高是评价肝损伤的重要指标[27]。SOD 和 GSH-Px通过清除代谢产生的氧自由基而减轻肝细胞氧化损伤,其活性的高低可直接反映机体清除氧自由基能力的大小;MDA可与生物大分子结合而形成加醛复合物,进一步破坏细胞膜的结构和功能,MDA 含量的高低,可反映机体组织或细胞受自由基攻击和损伤的严重程度;因此通过检测肝脏中 GSH-Px、SOD 和 MDA 的含量,可以确定肝组织脂质过氧化和受自由基损伤的程度[28-29]。本试验中与正常对照组小鼠比较,攻毒组小鼠,肝表面颜色变淡,呈黄白色,散在坏死灶,小鼠血清ALT、AST、LDH明显升高;SOD、GSH-PX含量明显降低,而MDA 明显升高;表明Bc导致小鼠肝脏损伤与抗氧化酶活性降低及脂质过氧化作用等有关。Bc曾在日本、瑞典、冰岛、加拿大和美国在内的许多国家暴发过疫情,而近来由于1名成年男子患Bc引起的肺炎,更加引起了人们对人类公共卫生安全的关注[30-32]。随着我国奶牛业的迅猛发展,乳源Bc的污染,特别是冷适应性、致病性Bc更需引起高度重视,有必要在乳源检测中重视和加强Bc的监测,对人类公共卫生具有重要意义。
