山东蛋鸡群马立克病临床病例的综合诊断及流行毒株的分子特征分析
2020-09-25张会霞曹胜亮姜胜男宋一诺刘思当
张会霞,张 慧,曹胜亮,李 悦,姜胜男,宋一诺,刘思当
(山东农业大学 动物科技学院,山东 泰安 271018)
鸡马立克病病毒(Marek's disease virus,MDV)是一种严格的细胞结合性、致瘤性禽疱疹病毒。由MDV感染引起的鸡马立克病(Marek's disease,MD)是一种恶性淋巴瘤及免疫抑制性疾病,对全球养鸡业造成了巨大的经济损失[1-3]。MD的临床症状包括瘫痪、消瘦、衰竭和死亡,病鸡的肿瘤病灶呈全身性分布,可侵害各内脏器官、皮肤、眼睛、肌肉及外周神经[4]。MDV分为3个血清型,即1型(GaHV2)、2型(GaHV3)和3型(MeHV1)[4-5],其中只有血清1型具有致病性,包括致瘤的强毒株及致弱变异株,而从鸡和火鸡中分离的血清2型和3型呈非致病性[6]。根据鸡群死亡率、组织器官病变率和疫苗的保护情况,血清1型MDV又可以分为温和MDV(mMDV)、强毒MDV(vMDV)、超强毒MDV(vvMDV) 以及超超强毒MDV(vv+MDV)[7]。几十年来,MDV对鸡群的致病力不断增强,大多数流行毒株已由mMDV转化为vMDV或vvMDV。
MD是一种可以用疫苗进行免疫预防的肿瘤性疾病,疫苗株主要有血清1型的CVI988/Rispens株、MDV-2的SB1株及MDV-3的HVT株,而在我国只有用血清1型CVI988/Rispens疫苗显示出可靠的保护性。虽然我国广泛采用了国际市场上最有效的细胞结合疫苗,但近年来在国内鸡群中,接种CVI988/Rispens的鸡群免疫失败的病例频繁报道,给养鸡业造成了巨大损失[8-10],然而,在疫苗接种后出现MD的病因尚不清楚。本试验从2019年5月份以来山东省各地送诊的疑似MD肿瘤病鸡中确诊3例,观察分析了其病变特征,并对检测到的MDVs的Meq、gE和gI基因进行了遗传进化分析,进一步丰富了我国MDV的分子流行病学数据,为MD的防控提供了新的参考依据。
1 材料与方法
1.1 病料及鸡胚成纤维细胞3个MD阳性病例分别来自山东省的菏泽(京红1号,160日龄)、聊城(海兰,160日龄)和泰安地区(海兰,120日龄),均在1日龄时接种CVI988/Rispens疫苗,100~160日龄时出现消瘦,开产后产蛋率低,持续性死亡,个别鸡虹膜呈灰白色,瞳孔缩小且边缘不整。10日龄SPF鸡胚购自济南家禽所,按常规方法制备鸡胚成纤维细胞 (chicken embryo fibroblasts,CEF)。
1.2 致瘤病毒检测对3个阳性病例采集的脾脏组织进行研磨并提取组织DNA,利用特异性引物检测常见致瘤病毒(MDV、ALV、REV)的感染情况。
1.3 病毒分离无菌采集病鸡的抗凝血1 mL(每毫升血中含肝素钠0.2 mL),2 000 r/min离心5 min,无菌环境中分离外周血淋巴细胞,接种到长至单层的次代CEF,37℃、5%CO2孵育2 h后换为1%维持液。继续培养5~7 d观察有无病毒蚀斑出现。如果没有出现明显蚀斑,则盲传1代,继续观察。
1.4 组织病理学诊断取剖检病鸡的心脏、肝脏、脾脏、肺脏、肾脏、腺胃、肌胃、胸肌、法氏囊、坐骨神经组织于中性10%甲醛溶液中固定,常规石蜡切片,HE染色,光镜下观察组织病理学变化。
1.5 MDV致病相关基因克隆及序列分析按照全基因组DNA提取试剂盒(天根)说明书操作,对MDV分离株的细胞培养物进行全基因组DNA提取,利用特异性引物扩增MDV的Meq(Marek's EcoQ-encoded protein)、gI(glycoprotein I)、gE(glycoprotein E)基因。PCR扩增目的片段,胶回收目的片段(天根)并连接到pEASY-T1载体(全式金)上,摇菌转化重组质粒并进行验证,验证后的片段送测序公司(上海生工)进行测序分析。利用Lasergene v7.1 序列分析软件包对核苷酸序列数据进行编辑,并与参考序列进行同源性比对。最后,在GenBank/EMBL/DDBJ数据库中保存了所有经验证的新核苷酸基因序列。利用MEGA 6.0软件,采用邻接法进行遗传进化分析。本试验中使用的参考毒株的详细信息和背景见表1。
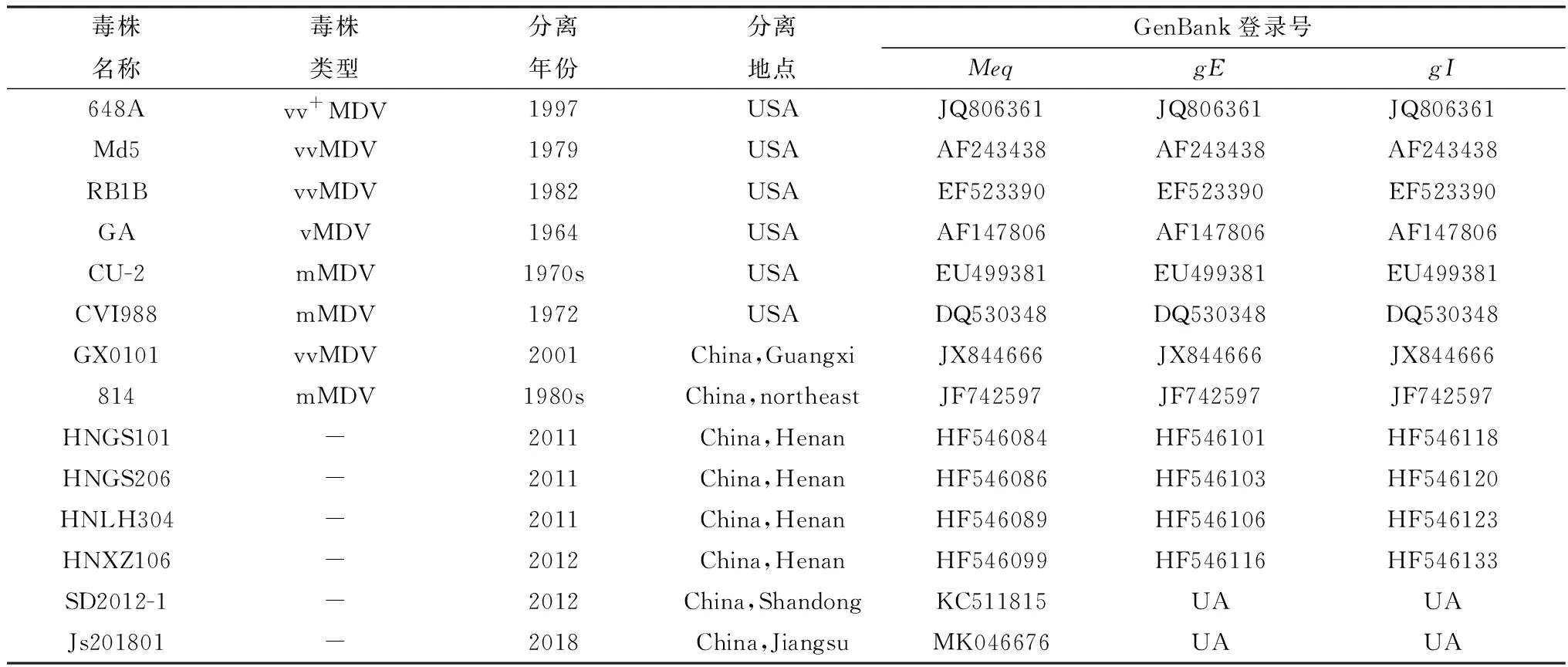
表1 参考毒株信息一览表
2 结果
2.1 致瘤病毒检测提取病变组织的基因组,用MDA、ALV和REV的特异性引物进行PCR检测,结果发现来自菏泽及聊城的病例为MDV单独感染,而来自泰安地区的病例为MDV和ALV-A混合感染。
2.2 病鸡剖检变化及组织病理学观察对送检病鸡剖检发现,其心脏、肝脏、肺脏、肾脏表面及切面均见灰白色肿瘤病灶,脾脏颜色变淡、显著肿大(图1A~D)。镜检发现心脏组织有淋巴样瘤细胞浸润,心肌纤维变性坏死(图1E);肝组织中有弥散性分布的肿瘤病灶,瘤细胞为大小和形状不一的淋巴样瘤细胞(图1F),多见核分裂象;脾脏淋巴样瘤细胞呈弥漫性浸润性生长,红髓、白髓结构消失,瘤细胞多发生坏死 (图1G);肺组织被弥漫性浸润增生的淋巴样瘤细胞取代(图1H);肾小管间瘤细胞灶状浸润增生,肾实质被大小不等的瘤细胞取代(图1I),肿瘤细胞呈明显的多型性;坐骨神经周围及神经纤维间淋巴样瘤细胞浸润增生(图1J)。
2.3 MDV流行毒株的分离与鉴定从病鸡肿瘤组织中分离的淋巴细胞接种单层次代CEF,培养7 d 后,仍无明显细胞病变,盲传1代4 d后可见典型的MDV蚀斑(图2),将分离到的3株MDV命名为SDHZ1、SDLC1、SDTA1。这些分离株在CEF上经过传代培养后,均能较好地适应CEF,并在接种CEF细胞单层后 3~5 d形成典型的病毒蚀斑。
2.4 MDV流行毒株Meq、gE、gI基因遗传进化分析对MDV的Meq、gE、gI基因进行扩增,结果分别扩增出1 020,1 494,1 068 bp条带。对本试验分离到的3个MDV流行毒株以及参考毒株的Meq基因进行系统进化树分析,结果发现Meq基因主要形成3大进化主干(图3 A),第1个大的进化主干共包含2个小的进化分支,流行株SDHZ1与中国超强毒株SD2012-1、Js201801形成一个主要的独立进化分支。而流行株SDLC01、SDTA1与以GX0101为代表的中国强毒株形成另一个主要的独立进化分支。此外,温和疫苗毒株(如CVI988、CU-2和814)与中国的HNGS201、HNLH304株形成第2个大的进化主干。来自于美国的vvMDV、vv+MDV形成第3个大的进化主干。
对MDV参考毒株以及流行毒株gE基因的分子进化分析表明,它们形成两大进化主干(图3B),其中3个流行毒株紧密相邻,并与中国经典毒株GX0101形成一个大的进化分支,而此前鉴定的河南分离株HNGS201和HNLH304与疫苗株CVI988和CU-2以及部分美国强毒株共同形成第2个大的进化分支。基于gI基因的分子进化分析也获得了相似的分析结果,这些毒株主要形成2个大主干(图3C),其中新分离到的3株MDV与中国强毒株GX0101以及HNXZ106形成第一个分支,而CVI988和CU-2以及部分美国强毒分离株形成另外一个大分支。
2.6 流行毒株MDVs的Meq、gE、gI基因编码氨基酸突变分析对分离的3个流行毒株的Meq基因氨基酸序列和其他参考株MDVs进行比对分析(图4),Meq基因编码的氨基酸突变在13个位置上呈现规律性,包括71,77,80,88,93,115,139,176,180,217,277位。除分离株HNGS201和HNLH304外,大多数中国毒株以及流行毒株的突变在77(K→E)、80(D→Y)、115(V→A)、139(T→A)、176(P→R)、217(P→A)和277(P→A)均有发生。有趣的是,SDHZ1与Js201801(vvMDV)在88(A→T)和93(Q→R)发生相同突变。
流行毒株的gE和gI基因编码的氨基酸同源性很高(图4)。HNGS201、HNGS304与美国MDV毒株的gE基因编码的氨基酸有6个相同的突变位点,而包括新分离到的3株MDVs在内大多数中国分离的MDVs的gE基因编码的氨基酸在第23,28,392,453,455,469位出现了H和R、A和V、I和L、D和G、T和A、A和D的互换现象。同样,在gI基因编码的氨基酸中,除了SDHZ1第3位氨基酸未发生互换,SDLC1和SDTA1与大部分中国毒株相同,在第3,112,142,165,223位发生了V和L、D和G、A和S、A和V、I和V互换。
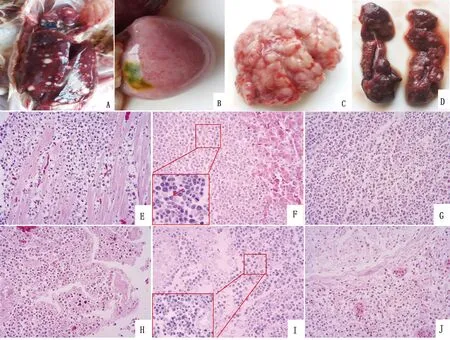
图1 病鸡剖检变化及组织病理学观察结果 心脏、肝脏表面肿瘤结节(A);脾脏肿大(B);肺脏表面白色结节(C);肾脏灰白色结节(D);心脏(E)、肝脏(F)、脾脏(G)、肺脏(H)、肾脏(I)、坐骨神经(J)均见淋巴样瘤细胞浸润(HE,400×);F、I左下角小图(HE,1 000×)箭头代表淋巴样瘤细胞核分裂象
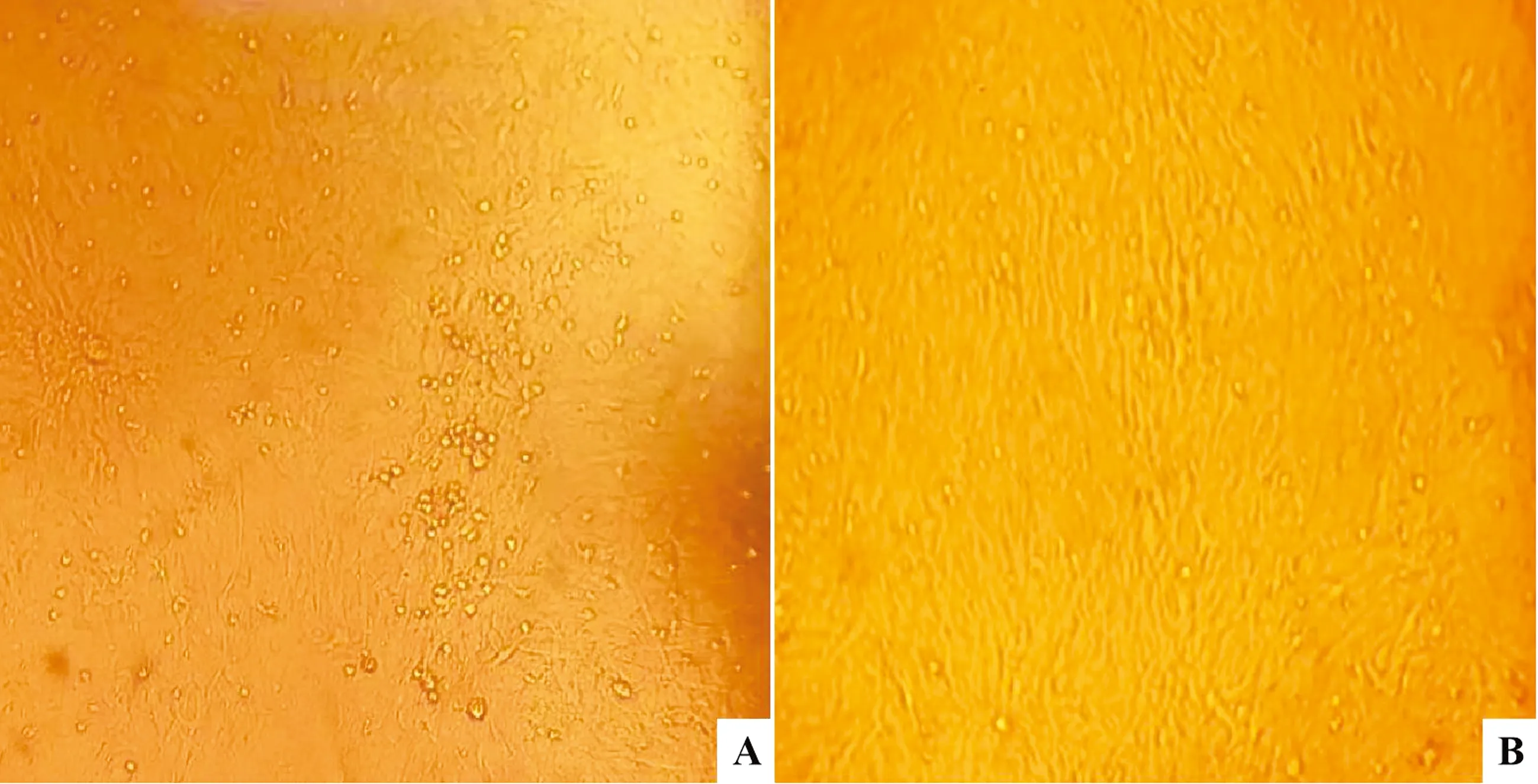
图2 病毒分离结果 A.正常CEF细胞;B.CEF出现的蚀斑
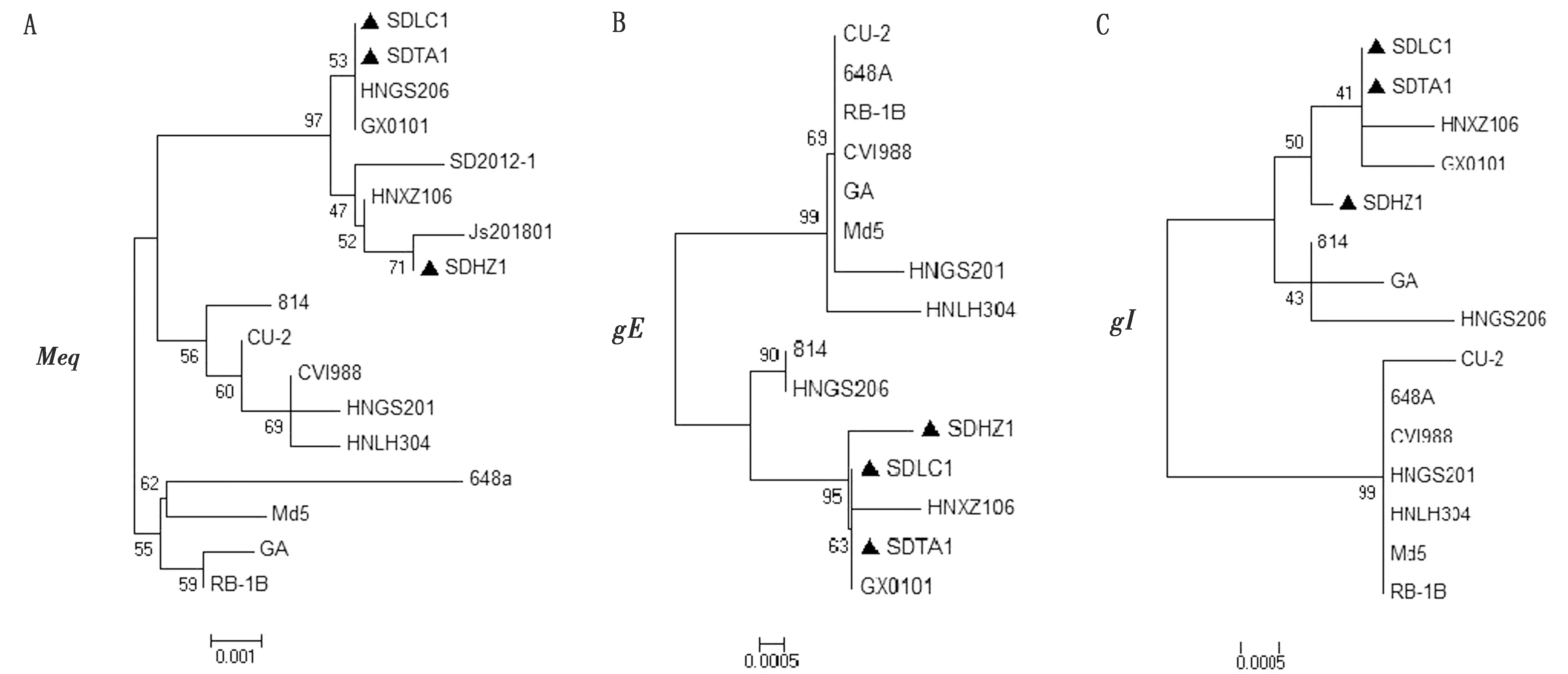
图3 基于Meq、gE、gI基因序列的MDV分离株的遗传进化树 A.Meq基因;B.gE基因;C.gI基因;▲.新分离毒株标记
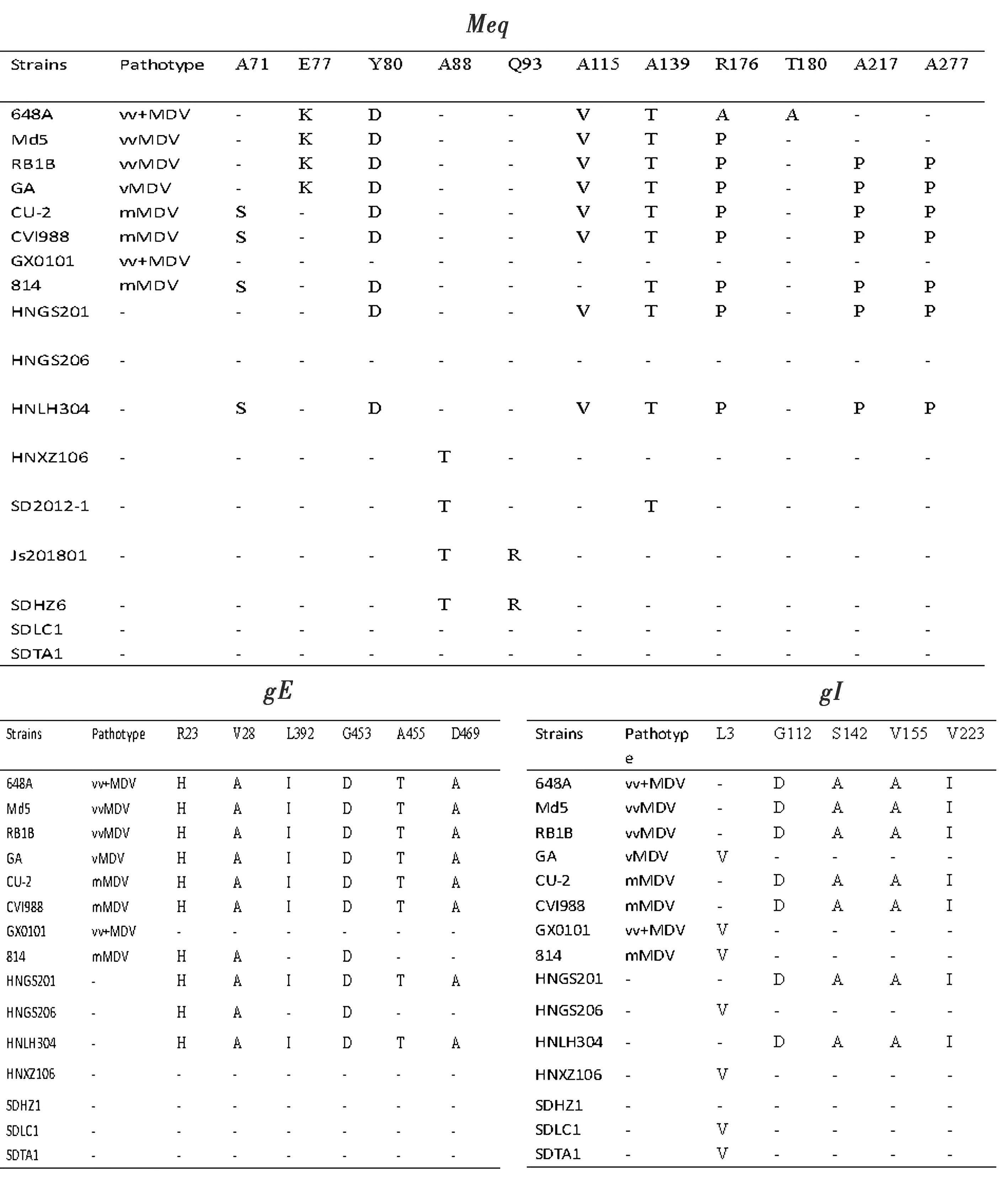
图4 分离株和参考MDVs的Meq、gE、gI的氨基酸序列比较
3 讨论
自1968年首次分离到MDV以来,MD在世界各国广泛发生,给养鸡业造成了巨大的经济损失[11-12]。2019年5月份以来,山东多地蛋鸡场MD的疑似病例明显增多,且发病鸡群均进行了进口疫苗的免疫。
随着MD疫苗的推广普及,MDV野毒株的致病性也在逐渐增强[13]。然而,导致MD毒力增强的主要原因目前仍不清楚。据报道,Meq基因的多态性和突变似乎与毒性有关[14]。Meq基因被认为是MDV的主要毒力基因,参与肿瘤形成及免疫抑制,Meq基因的突变也可能与毒力增强相关[15]。疱疹病毒的糖蛋白在病毒感染、成熟、附着、细胞间传播以及病毒生命周期等方面起着重要的作用[16]。此外,糖蛋白gE和gI与病毒的免疫逃逸功能存在一定联系,还可作为遗传进化分析的潜在遗传标记[17]。因此,本研究对从临床病例中扩增的Meq、gE和gI基因与国内外参考毒株进行系统进化及氨基酸突变分析,结果发现在山东地区流行的毒株中gE和gI基因高度保守,且与国内参考毒株相应基因同源性均较高,相比之下,与国外参考株之间差异较大。在进行氨基酸同源性比较时,3个流行毒株与大部分中国参考毒株的gE基因编码的氨基酸在第23,28,392,453,455,469位出现了H和R、A和V、I和L、D和G、T和A、A和D的互换现象。而SDLC1和SDTA1毒株与大部分中国毒株的gI基因编码的氨基酸相同,在第3,112,142,165,223位的V和L、D和G、A和S、A和V、I和V发生了互换。这些交换氨基酸的变异可以作为MDV在中国流行株gE和gI基因中的一种地域性的遗传标志。
在Meq系统进化树分析中,国内MDV分离株的基因型组成一个独立的分支[18-19]。本试验分离到的3株MDV与绝大多数分离鉴定的国内MDV强毒株距离较近,与GX0101同处于一个较大的进化分支,而与MD疫苗株CVI988及美国毒株遗传距离较远。在Meq基因编码的氨基酸上,山东地区分离到的3株MDV在第71位(S→A)、115 (V→A)、139 (T→A)、176 (P→R)发生的突变与强毒株GX0101株有相同的突变,这说明我们分离到的毒株是野毒株而不是疫苗株,这些发病鸡群很有可能因感染毒力较强的MDV毒株而发生免疫失败。有研究报道,Meq编码的氨基酸的176位突变(Pro→Ala)破坏了Meq原有的Pro重复序列,进而导致MDV强毒株突变为超强毒株[19]。而在本试验中所检测到的毒株第176位虽然没有发生Pro(P)→Ala(A),但是由Pro(P)→Arg(R),也使Meq基因编码的氨基酸原有的Pro重复序列受到破坏,这与MDV超强中国分离株SD2012-1和QD2014突变相同[20-21],该位点的突变有可能与MDV超强毒株的毒力有关。
本试验通过病理剖检、组织病理学观察、PCR检测及病毒分离确定送诊的临床病例为MD,并从中分离到3株血清1型MDV,且SDTA1为MDV与ALV-A亚群混感。经遗传进化分析发现,新分离的MDVs普遍具有中国流行株的遗传标记,与超强毒株GX0101同源性很高,且SDHZ1与Js201801(vvMDV)同源性极高,极有可能是超强毒株。这些分离株的致病性及毒力还需通过动物试验进行进一步的研究。鉴于MD对养鸡业的危害,持续监测MDV的流行动态及其致病特征有助于我国MD的诊断防控。
