全国细菌耐药监测网技术方案(2020年版)
2020-09-24全国细菌耐药监测学术委员会
全国细菌耐药监测学术委员会
全国细菌耐药监测网(China Antimicrobial Resistance Surveillance System,CARSS)是唯一由政府建立,覆盖全国二、三级医疗机构的大型细菌耐药性监测网络。通过本监测网络,可获取有科学价值的、分层的细菌耐药性及变迁信息,掌握全国细菌耐药性流行趋势及新威胁,为政府、卫生健康行政部门制定相关政策及评估干预措施的有效性提供科学依据。
全国细菌耐药监测网包括主动监测和被动监测两种形式,常规开展被动监测,定期或不定期开展主动监测。主动监测技术方案根据监测目标另行制定。
本方案仅涉及被动监测。为了维持监测结果的有效性及可比性,保证监测结果质量,特制订本方案。
本方案由国家卫生健康委员会合理用药专家委员会全国细菌耐药监测学术委员会讨论通过,每年审核,定期修订。
1 监测范围
收集网点医院按规范化操作、自临床标本中分离的有临床意义和公共卫生意义的普通细菌及其抗菌药物敏感性试验(以下简称药敏试验)结果。以收集资料为主,必要时,收集菌株用于复核结果和质量控制。
为了提高监测数据质量,各网点医院应提高临床标本,特别是无菌体液标本送检率;提高送检标本,特别是痰液、血液标本合格率。各实验室应提高细菌,特别是苛养菌的检出率,应掌握分离细菌的临床意义,注意收集感染病原菌。
2 目标细菌
目标细菌为自临床标本中分离的有临床意义的细菌,包括以下标本及细菌:①无菌部位标本(血液、脑脊液、骨髓、胸水、膀胱穿刺尿液、腹水、无菌腔隙穿刺液、组织等)来源的所有非污染细菌;②开放部位合格标本(痰、咽拭子、尿液、粪便等)来源的具有临床意义的细菌。
3 目标细菌鉴定
采用专业认可的鉴定系统或手工方法进行目标细菌鉴定。所有分离细菌尽可能鉴定到种,如表皮葡萄球菌,而非凝固酶阴性葡萄球菌。
4 药敏试验
根据国际标准、行业要求或仪器制造商建议,规范地进行药敏试验,可采用手工法、仪器法,报告抑菌圈直径(mm)、最低抑菌浓度(MIC值,mg/L)。
全国细菌耐药监测网不接受仅为“耐药(R)”“中介(I)”“剂量依赖敏感(SDD)”“敏感(S)”的报告结果。
采用自动或半自动仪器进行药敏试验时,应按照仪器制造商的要求补充试验,报告经补充试验确认的药敏结果。
商品化药敏试验药物浓度范围若不覆盖判断折点,需根据本院临床需要及本方案要求进行补充试验,报告经补充试验确认的药敏结果。
5 特殊耐药性检测方法(不包含分子生物学检测方法)
5.1 甲氧西林(苯唑西林)耐药葡萄球菌
5.1.1 金黄色葡萄球菌和路邓葡萄球菌甲氧西林(苯唑西林)耐药性 待测菌按照纸片扩散法操作步骤,采用30 µg头孢西丁纸片于33~35 ℃孵育16~18 h,或按照肉汤微量稀释法操作步骤,33~35 ℃孵育,头孢西丁16~20 h,苯唑西林24 h。头孢西丁≤21 mm或≥8 mg/L,或苯唑西林 ≥4 mg/L为甲氧西林(苯唑西林)耐药金黄色葡萄球菌或路邓葡萄球菌。
5.1.2 路邓葡萄球菌、伪中间葡萄球菌、施氏葡萄球菌、表皮葡萄球菌以外的凝固酶阴性葡萄球菌甲氧西林(苯唑西林)耐药性 待测菌按照纸片扩散法操作步骤,采用30 µg头孢西丁纸片于33~35 ℃孵育24 h,或按照肉汤微量稀释法操作步骤,采用苯唑西林于33~35 ℃孵育24 h,头孢西丁≤24 mm或苯唑西林≥0.5 mg/L为甲氧西林(苯唑西林)耐药凝固酶阴性葡萄球菌(MRCNS)。头孢西丁纸片法若18 h后即出现耐药可报告为MRCNS。
5.1.3 表皮葡萄球菌甲氧西林(苯唑西林)耐药性 采用头孢西丁纸片法、苯唑西林肉汤微量稀释法检测。检测方法同5.1.2。待测菌亦可按照纸片扩散法操作步骤,采用1 µg苯唑西林纸片于33~35 ℃ 孵育16~18 h,苯唑西林≤17 mm为甲氧西林(苯唑西林)耐药表皮葡萄球菌。
5.1.4 伪中间葡萄球菌和施氏葡萄球菌甲氧西林(苯唑西林)耐药性 采用苯唑西林纸片法或肉汤微量稀释法检测。检测方法同表皮葡萄球菌。
5.2 青霉素不敏感肺炎链球菌
对于苯唑西林纸片抑菌圈直径≤19 mm的肺炎链球菌,需测定MIC值,以确定其对青霉素的敏感性。
5.3 高水平氨基糖苷类药物耐药肠球菌筛选试验
5.3.1 纸片扩散法 将0.5麦氏浊度待测菌菌悬液接种于MH平板,贴120 µg庆大霉素或300 µg链霉素纸片,(35±2)℃孵育16~18 h,抑菌圈直径 ≤6 mm为耐药、≥10 mm为敏感,7~9 mm为不确定,需以肉汤微量稀释法或琼脂稀释法确 认。
5.3.2 肉汤微量稀释法 按照肉汤微量稀释法标准操作要求将待测菌菌悬液接种于含500 mg/L庆大霉素脑心浸液(BHI)肉汤于(35±2)℃孵育24 h,或接种于含1 000 mg/L链霉素的BHI肉汤于(35±2)℃孵育24~48 h(若24 h敏感继续孵育),任何生长为耐药。
5.3.3 琼脂稀释法 将10 µL 0.5麦氏浊度待测菌菌悬液接种于含500 mg/L庆大霉素BHI平板于(35±2)℃孵育24 h,或接种于含2 000 mg/L链霉素BHI平板于(35±2)℃孵育24~48 h(若24 h敏感继续孵育),>1个菌落为耐药。
5.4 金黄色葡萄球菌和肠球菌属对万古霉素敏感性
万古霉素MIC≥8 mg/L菌株筛查试验:将0.5麦氏浊度待测金黄色葡萄球菌菌悬液10 µL或肠球菌菌悬液1~10 µL接种于含6 mg/L万古霉素的BHI平板(最好用微量移液管滴加,也可以用棉拭子在菌悬液中浸润后挤干,涂布直径10~15 mm或划线接种),(35±2)℃孵育24 h,>1个菌落可能为金黄色葡萄球菌对万古霉素敏感性降低或肠球菌属对万古霉素耐药。
5.5 β内酰胺酶检测
5.5.1 葡萄球菌属
5.5.1.1 青霉素MIC≤0.12 mg/L或抑菌圈直径 ≥29 mm的金黄色葡萄球菌 待测菌按照纸片扩散法操作步骤,10U青霉素纸片(35±2)℃孵育16~18 h,如纸片边缘界限清晰(cliff现象)为β内酰胺酶阳性,否则为阴性。
5.5.1.2 青霉素MIC≤0.12 mg/L或抑菌圈直径 ≥29 mm的金黄色葡萄球菌和凝固酶阴性葡萄球菌 以头孢硝噻吩纸片刮取MH或血琼脂平板孵育16~18 h后青霉素或头孢西丁纸片抑菌圈边缘菌落,室温1 h或遵循产品说明书,出现红色/粉红色为β内酰胺酶阳性。当金黄色葡萄球菌头孢硝噻吩试验阴性时,需经青霉素纸片边缘试验确证其是否为产β内酰胺酶菌株。
5.5.2 流感嗜血杆菌和卡他莫拉菌 以头孢硝噻吩纸片刮取(35±2)℃孵育的HTM平板(流感嗜血杆菌)或35 ℃孵育20~24 h后MH平板(卡他莫拉菌)上的菌落,红色/粉红色为β内酰胺酶阳性。
5.6 克林霉素诱导性耐药试验
5.6.1 葡萄球菌属 按照纸片扩散法操作步骤,将0.5麦氏浊度待测菌菌悬液接种于MH平板,15 µg红霉素纸片和2 µg克林霉素纸片边缘相距15~26 mm,(35±2)℃孵育16~18 h,与红霉素相邻侧抑菌圈出现“截平”(D形抑菌圈)或克林霉素抑菌圈内有薄雾状生长时为阳性,应报告克林霉素耐药;或将0.5麦氏浊度待测菌菌悬液接种于含4 mg/L红霉素和0.5 mg/L克林霉素的阳离子调节MH肉汤(CAMHB),(35±2)℃孵育18~24 h,任何生长为阳性,应报告克林霉素耐 药。
5.6.2 肺炎链球菌和β溶血链球菌 按照纸片扩散法操作步骤,将0.5麦氏浊度待测菌菌悬液接种于含5%羊血的MH平板或胰酶大豆琼脂平板(TSA),15 µg红霉素纸片和2 µg克林霉素纸片边缘相距12 mm,(35±2)℃,5%CO2孵育20~24 h,与红霉素相邻侧抑菌圈出现“截平”(D形抑菌圈)或克林霉素抑菌圈内有薄雾状生长时为阳性,应报告克林霉素耐药;或将0.5麦氏浊度待测菌菌悬液接种于含1 mg/L红霉素和0.5 mg/L克林霉素的CAMHB(含2.5%~5%溶解马血),(35±2)℃孵育20~24 h,任何生长为阳性,应报告克林霉素耐药。
6 目标药物
我国幅员广阔,各医疗机构用药习惯不同,同一种细菌药敏试验所选择的药物不尽相同。为使细菌耐药监测结果能有效应用于抗菌药物临床使用及管理,表1字体加粗的抗菌药物为各种属细菌必须监测的药物,其他为建议监测药物。
除必须监测的药物外,其他监测药物由各医疗机构微生物学、药学、感染病学专家讨论,遵循以下原则确定:①参照国际、行业要求,并根据标准每年度更新(应至少遵循上一年度的标准);②根据各种属细菌特点,选择相应药物进行药敏试验。尽量包括本医院临床有效的常用抗菌药物,适当选择临床少用但使用价值高的药物;③根据细菌耐药监测结果调整监测药物种类。
7 数据收集与上报
详见《全国细菌耐药监测网信息系统数据上报标准》。
7.1 数据录入
采用WHONET软件录入质控数据、向临床报告的药敏试验结果以及其他监测数据。
7.2 数据上报
质控数据及监测数据上报周期为每季度1次。每季度第一个月15日前,通过“全国细菌耐药监测网信息系统”完成上一季度监测数据传送,并及时确认反馈信息。
7.3 数据审核与反馈
所有上报数据将通过“全国细菌耐药监测网信息系统”自动进行汇总、审核、反馈。审核合格的数据将进入系统数据库进行分析。用户上传的不合格数据信息将反馈至用户并在修正后重新接受。
8 质量控制
全国细菌耐药监测网网点医院至少应遵循以下质量控制要求。
8.1 培养基、试剂
新批号或新购入相同批号的培养基应进行无菌试验、生长试验、生长抑制试验(适用时)。
新批号或新购入相同批号的试剂、染色剂应以质控菌株(已知结果的菌株)进行质控。
全国细菌耐药监测网不接受无质控要求的自动或半自动鉴定、药敏仪器的检测结果。
8.2 药敏试验
8.2.1 日常质控 应每周以质控标准菌株对向临床报告及向本监测网报告的所有药物进行质控。若检测频率小于每周1次,则每个检测日应进行质 控。
8.2.2 失控处理 日常质控失控时,连续检测20~30 d,每一组药物/细菌超出参考范围(抑菌圈直径或MIC值)的频率应不超过(≤)1/20或3/30;也可采用替代质控方案,即连续5 d,每天对每组药物/细菌重复测定3次,每次单独制备接种物,15个数据超出参考范围(抑菌圈直径或MIC值)的结果应不超过(≤)1个,若失控结果为2~3个,则如前述,再进行5 d,每天3次重复试验,30个数据失控结果应不超过(≤)3个。此后,恢复日常质控。
采用自动或半自动仪器进行药敏试验时,应按照仪器制造商的要求进行质控。
8.3 结果复核
全国细菌耐药监测网将定期或不定期收集网点医院监测菌株进行鉴定、药敏复核。
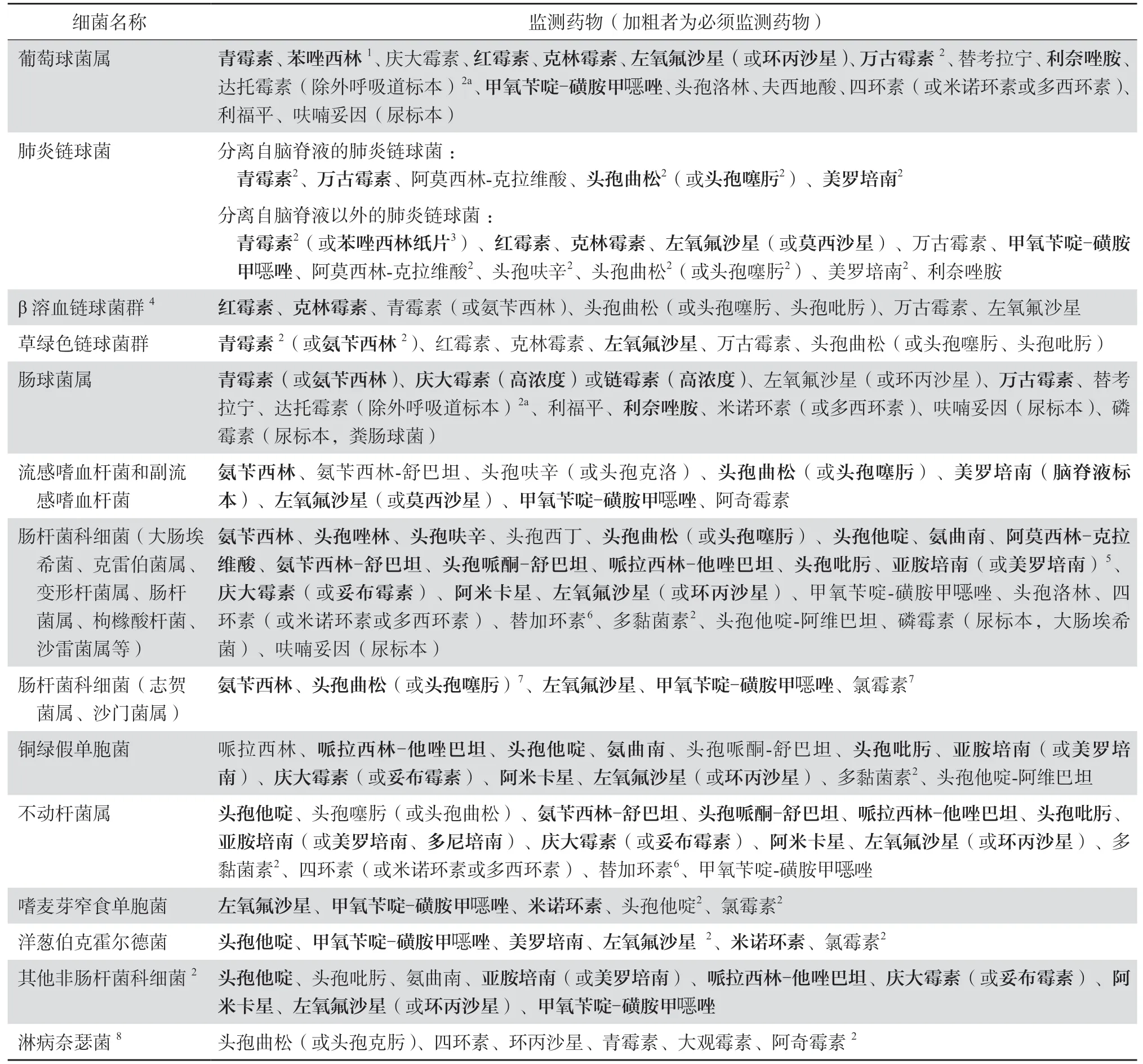
表1 全国细菌耐药监测网监测药物
9 特殊情况处理
当出现下列不常见耐药现象时,各监测网点医院首先需自行复核实验结果,若确认结果属实,需立即与省级监测中心联系,必要时,省级监测中心向全国细菌耐药监测网质量管理中心报告,决定是否送菌。请同时保留菌株直至收到反馈信息。
各省级监测中心将确认情况反馈至申请复核单位,同时,需上报国家卫生健康委员会合理用药专家委员会,由全国细菌耐药监测学术委员会讨论后提出具体措施和意见。
9.1 不常见耐药菌
至少包括:①对万古霉素、替考拉宁、利奈唑胺、达托霉素和替加环素中介及耐药的葡萄球菌;②对青霉素耐药的化脓性链球菌。
9.2 菌种转运
按菌种运送要求取新鲜菌种转种于平皿、冻存管或转运培养基中,在符合生物安全要求的条件下,通过有资质的快递公司寄送。
