卡托普利通过调控lncRNA CHRF表达对帕金森病模型细胞损伤的影响
2020-09-24和晓春刘伟芬李禄辉
和晓春,邱 娟,常 蕾,刘伟芬,李禄辉
(1 河南能源焦煤中央医院西药房,焦作 454000;2 河南能源焦煤中央医院病理科,焦作 454000;3 河南应用技术职业学院制药工程学院,郑州 450042)
帕金森病(parkinson’s disease,PD)是一种老年人常见的神经退行性疾病,认知功能障碍是其临床主要特征,该疾病严重影响患者生活质量[1]。PD发病机制复杂,线粒体功能障碍、氧化应激、神经炎性反应、凋亡等均与其发病相关[2]。研究其具体的发病机制,有针对性的治疗对延缓PD进展具有重要意义。目前主要是通过药物延缓PD的发展,开发保护神经的新药有利于提高PD患者的生活质量,也是今后PD药物治疗的研究方向[3]。卡托普利(captopril,Cap)是一种血管紧张素转换酶抑制剂,常用于治疗高血压。研究报道,卡托普利可不同程度的改善血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)对PC12细胞的抑制作用,并减缓细胞衰老[4]。卡托普利在帕金森病动物模型中可保护黑纹状体多巴胺神经元免受损伤[5]。Cap还可增强抗氧化应激能力,减轻肝细胞脂肪变性及炎症反应,对非酒精性脂肪肝有一定的防治作用[6]。然而,Cap对帕金森模型细胞凋亡和氧化应激的影响及其机制尚不清楚。研究表明,lncRNA在精神相关疾病中起重要作用[7]。心肌肥大相关因子(cardiac hypertrophy related factors,CHRF)上调表达加重了白细胞介素6(interleukin-6,IL-6)诱导的ATDC5细胞炎症性损伤[8]。CHRF体内敲除可明显预防缺血性损伤,并减轻神经功能障碍[9]。说明CHRF可调控细胞的炎症反应,且与神经功能障碍有关。本实验通过用1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpy ridinium ion,MPP+)诱导SK-N-SH细胞建立PD细胞模型,研究Cap对帕金森模型细胞凋亡和氧化应激的影响及其机制是否与CHRF有关。
1 材料与方法
1.1 材料
SK-N-SH细胞购自武汉普赛诺生命科技有限公司;胎牛血清、DMEM培养基购自美国Sigma公司;青霉素-链霉素双抗购自上海素尔生物科技有限公司;1-甲基-4-苯基吡啶离子(1-Methyl-4-phenylpy ridinium ion,MPP+)购自北京谨明生物科技有限公司;卡托普利注射液(生产厂家:常州制药厂有限公司,生产批号:国药准字H10970294,规格:1 ml∶25 mg);丙二醛(malonaldehyde,MDA)试剂盒、谷胱甘肽(glutathione,GSH)试剂盒购自南京建成生物工程研究所;膜联蛋白V-异硫氰酸荧光素/碘化丙锭(Annexin V-FITC/PI)试剂盒购自江苏凯基生物技术股份有限公司;二辛可宁酸(bicinchoninic acid,BCA)试剂盒、RIPA蛋白裂解液购自碧云天生物技术研究所;LipofectamineTM2000转染试剂购自美国Invitrogen公司;FACSCanto Ⅱ流式细胞仪购自美国 Bio-Rad公司。
1.2 细胞培养
SK-N-SH细胞用含10%胎牛血清和1%青霉素-链霉素双抗的DMEM培养液在37 ℃、5% CO2条件下培养,每周换液3次,待细胞融合至90%左右时,进行消化传代,取对数生长期细胞进行实验。
1.3 细胞处理与分组
用100 μmol/L的MPP+处理SK-N-SH细胞建立帕金森病模型,记为MPP+组;用浓度分别为0.5、5、50 μg/ml的Cap处理SK-N-SH细胞24 h后再用100 μmol/L的MPP+处理,作为Cap低、中、高浓度组(MPP++Cap-L组、MPP++Cap-M组、MPP++Cap-H组);未经任何处理的细胞作为对照组(Con);同时以50 μmol/L司来吉兰(SEL)和100 μM的MPP+处理作为阳性对照药组(MPP++SEL)。将si-NC、si-CHRF转染至SK-N-SH细胞中再用100 μmol/L的MPP+处理,记为MPP++si-NC组、MPP++si-CHRF组。将si-CHRF、pcDNA、pcDNA-CHRF转染至SK-N-SH细胞后用50 μg/ml Cap和100 μmol/L MPP+处理,记为MPP++Cap+si-CHRF组、MPP++Cap+pcDNA组、MPP++Cap+pcDNA-CHRF组。
1.4 丙二醛(MDA)、谷胱甘肽(GSH)含量检测
细胞培养48 h后收集各组细胞及细胞培养上清液,用MDA试剂盒、GSH试剂盒分别检测MDA、GSH含量,按试剂盒说明书进行操作。
1.5 流式细胞术检测细胞凋亡
细胞培养48 h后用预冷的磷酸盐缓冲液(PBS)漂洗2次,与500 μl的结合缓冲液混匀。先加入 10 μl Annexin V-FITC,再加入5 μl碘化丙锭(PI),混匀后避光孵育10 min。用流式细胞仪检测细胞凋亡率。每组设3个复孔,实验重复3次。
1.6 蛋白质印迹(western blot)法检测Bcl-2、Bax蛋白表达
细胞培养48 h后提取总蛋白,BCA试剂盒测定蛋白浓度。将蛋白样品进行聚丙烯酰胺凝胶电泳后转至聚偏二氟乙烯膜上,用5%脱脂奶粉室温封闭 1 h,再分别加入一抗(1∶1000),4 ℃孵育过夜,TBST洗膜;加入二抗(1∶2000)室温孵育90 min,TBST洗涤;用ECL发光液显影,用ChemiDoc XRS+系统成像,用Quantity One凝胶分析软件测定各组蛋白条带的灰度值,蛋白相对表达水平=目的条带灰度值/GAPDH条带灰度值。每个蛋白样品设3个重复。
1.7 实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)法检测CHRF表达水平
各组细胞培养48 h,提取总RNA,反转录成 cDNA,按照荧光定量试剂盒说明进行PCR,每个样品设3个重复,循环条件为95 ℃ 5 min,95 ℃ 30 s,60 ℃ 30 s;72 ℃ 30 s,共40个循环;60 ℃延长 5 min。相对表达量用2-△△Ct法计算。CHRF以GAPDH为内参,CHRF上游引物序列:5’-GTGTTAGCCACCACTACCCAGC-3’,下游引物序列:5’--CCACAGCCCACAACTTTCAAG-3’;GAPDH上游引物序列:5’-CCCCATACACAGTGTTAGCC-3’,下游引物序列:5’-GAGTGATTTTCCCGTCC-3’;引物由上海生工生物工程公司合成。
1.8 统计学分析

2 结果
2.1 Cap对MPP+诱导SK-N-SH细胞氧化应激的影响
与对照组相比,MPP+组SK-N-SH细胞中MDA含量升高,GSH含量降低(P<0.05);与MPP+组相比,卡托普利低、中、高浓度组及阳性对照药物组SK-N-SH细胞中MDA含量降低,GSH含量升高,且呈浓度依赖性(P<0.05)。见表1。
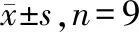
表1 卡托普利对MPP+诱导SK-N-SH细胞氧化应激的影响
2.2 Cap对MPP+诱导SK-N-SH细胞凋亡的影响
与对照组相比,MPP+组SK-N-SH细胞凋亡率升高,Bcl-2表达水平降低,Bax表达水平升高(P<0.05);与MPP+组相比,卡托普利低、中、高浓度组及阳性对照药物组SK-N-SH细胞凋亡率降低,Bcl-2表达水平升高,Bax表达水平降低,且呈浓度依赖性(P<0.05)。见图1和表2。
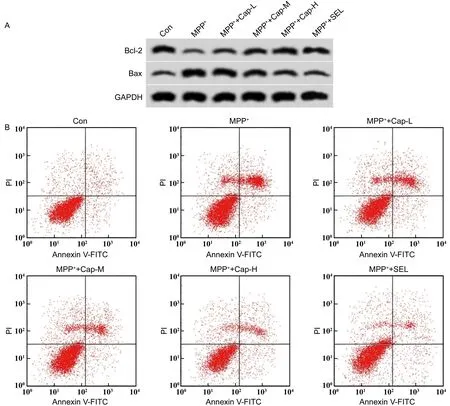
A:凋亡相关蛋白的表达;B:细胞凋亡流式图图1 卡托普利对MPP+诱导SK-N-SH细胞凋亡的影响
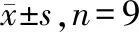
表2 卡托普利对MPP+诱导SK-N-SH细胞凋亡的影响
2.3 Cap对MPP+诱导SK-N-SH细胞中lncRNA CHRF表达的影响
与对照组相比,MPP+组CHRF表达水平升高(P<0.05);与MPP+组相比,Cap低、中、高浓度组及阳性对照药物组CHRF表达水平降低,且呈浓度依赖性(P<0.05)。见表3。
表3 卡托普利对MPP+诱导SK-N-SH细胞中lncRNA CHRF表达的影响
2.4 抑制lncRNA CHRF表达对MPP+诱导SK-N-SH细胞损伤的影响
与MPP++si-NC组相比,MPP++si-CHRF组CHRF表达水平降低,凋亡率降低,Bcl-2表达水平升高,Bax表达水平降低,MDA含量降低,GSH含量升高(P<0.05);与MPP++si-CHRF组相比,MPP++Cap+si-CHRF组CHRF表达水平降低,凋亡率降低,Bcl-2表达水平升高,Bax表达水平降低,MDA含量降低,GSH含量升高(P<0.05)。见图2和表4。

A:凋亡相关蛋白的表达;B:细胞凋亡流式图图2 抑制lncRNA CHRF表达对MPP+诱导SK-N-SH细胞凋亡的影响
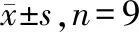
表4 抑制lncRNA CHRF表达对MPP+诱导SK-N-SH细胞损伤的影响
2.5 lncRNA CHRF过表达逆转了Cap(50 μg/ml)对MPP+诱导SK-N-SH细胞损伤的作用
与MPP+组相比,MPP++Cap组CHRF表达水平降低,细胞凋亡率降低,Bcl-2表达水平升高,Bax表达水平降低,MDA含量降低,GSH含量升高(P<0.05);与MPP++Cap+pcDNA组相比,MPP++Cap+pcDNA-CHRF组CHRF表达水平升高,细胞凋亡率升高,Bcl-2表达水平降低,Bax表达水平升高,MDA含量升高,GSH含量降低(P<0.05)。见图3和表5。
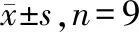
表5 lncRNA CHRF过表达逆转了卡托普利对MPP+诱导SK-N-SH细胞损伤的作用

A:凋亡相关蛋白的表达;B:细胞凋亡流式图图3 lncRNA CHRF过表达逆转了卡托普利对MPP+诱导SK-N-SH细胞凋亡的作用
3 讨论
帕金森病是常发于老年人的一种慢性进行性疾病,随着人口的老龄化,其发病率逐渐升高[10]。氧化应激造成的氧化性损伤可促进多巴胺能神经元凋亡,因此氧化应激在PD发展中起重要作用,抗氧化应激在一定程度上可治疗PD[11]。本实验结果显示,MPP+诱导的SK-N-SH细胞中丙二醛(malonaldehyde,MDA)含量升高,谷胱甘肽(Glutathione,GSH)含量降低,且细胞凋亡率升高。表明MPP+可诱导SK-N-SH细胞氧化应激的产生以及促进细胞凋亡。
研究报道,Cap可下调活性氧簇(reactive oxygen species,ROS)水平和MMP-9的表达,并减轻脑水肿和改善神经功能[12]。Cap通过抑制自噬和激活腺苷酸活化蛋白激酶(AMP-activatedprotein kinase,AMPK)可减弱病毒肽PrP介导的神经元凋亡[13]。Cap对局灶性脑缺血具有神经保护作用[14]。Cap通过脑组织氧化损伤改善了脂多糖诱导的大鼠学习和记忆障碍[15]。Cap对人脐静脉内皮细胞氧化损伤具有保护作用,可提高其活力,增强超氧化物歧化酶(superoxide dismutase,SOD)活性,降低MDA含量,呈现一定的浓度依赖性[16]。本实验结果显示,Cap处理后,MPP+诱导的SK-N-SH细胞中MDA含量降低,GSH含量升高,细胞凋亡率降低,Bcl-2表达水平升高,Bax表达水平降低。表明Cap可抑制氧化应激的产生以及抑制细胞凋亡,Cap对MPP+诱导的SK-N-SH细胞损伤具有保护作用。
研究表明,lncRNA可参与调控细胞凋亡和氧化应激水平,如沉默CHRF可增加脂多糖诱导的H9c2细胞活性、抑制细胞凋亡、抑制ROS的产生和炎性因子的表达,可保护H9c2细胞免受脂多糖诱导的损伤[17]。缬沙坦通过下调CHRF减轻心力衰竭过程中的心脏功能障碍和损伤[18]。以上结果表明CHRF与细胞凋亡,氧化水平及炎症反应均相关。本实验结果显示,MPP+诱导SK-N-SH细胞中CHRF表达水平升高;抑制CHRF表达,抑制了MPP+诱导的SK-N-SH细胞凋亡和氧化应激。Cap处理后,CHRF表达水平降低;卡托普利处理的同时抑制CHRF表达,更显著地抑制了MPP+诱导的SK-N-SH细胞凋亡和氧化应激;且CHRF过表达逆转了Cap对MPP+诱导的SK-N-SH细胞损伤的保护作用。
综上所述,Cap通过下调CHRF表达,可抑制MPP+诱导的SK-N-SH细胞损伤。
