siRNA-Piezo1通过ERK1/2信号通路抑制 滑膜细胞增殖和炎性因子表达的相关机制
2020-09-23何珊王颖芳杜红卫周勇伟李晓飞薛静
何珊, 王颖芳, 杜红卫, 周勇伟, 李晓飞*, 薛静*
(1.浙江大学 附属第二医院 风湿免疫科,浙江 杭州 310000;2.浙江大学 附属金华医院 风湿免疫科,浙江 金华 321000;3.浙江大学 附属金华医院 骨一科,浙江 金华 321000)
类风湿关节炎(rheumatoid arthritis,RA)是一种累及多处关节的免疫性疾病,涉及免疫系统的平衡、滑膜细胞的增殖和炎性因子的释放等多个方面[1-2].滑膜细胞的不断增殖与炎性因子的释放会不断侵袭软骨组织及软骨下骨组织,在生物力学作用下,造成关节畸形,甚至是关节功能的丧失.目前针对RA的治疗主要局限于药物和手术治疗,但效果不佳[3-4].因此寻找一种安全有效的治疗方法十分必要.机械牵张力学信号在骨科相关疾病的作用已经越来越引起人们的关注,其中新型机械通道蛋白Piezo1是最近发现的,与生物力学信号密切相关的跨膜蛋白分子[5-6].有研究证明,Piezo1蛋白参与骨关节炎(osteoarthritis,OA)软骨细胞的凋亡以及成骨细胞的增殖和分化过程[7-8],但是在RA滑膜细胞中的作用尚未见报道.因此,本研究以新型机械激活性离子通道Piezo1为研究对象,探究在人RA成纤维样滑膜细胞(RA fibroblast-like synoviocyte, RAFLS)中的细胞增殖和炎性介质释放过程中的作用,利用EKR1/2的抑制剂PD98059进行干预[9-10],探讨MAPK/ERK1/2信号通路作为Piezo1下游信号通路的可能,并研究相关作用机制.
1 材料与方法
1.1 实验材料
1.1.1 实验组织
以自2017年1月至2018年3月收入浙江大学金华医院(金华市中心医院)的RA患者和车祸截肢患者为研究对象.RA患者行关节镜清理术或者人工全膝关节置换术时获取滑膜组织,抽取膝关节关节液.正常对照者滑膜组织和关节液取自车祸外伤致下肢截肢患者.所有患者均获知情同意,签署知情同意书.本方案获得了浙江大学金华医院伦理委员会的批准,伦理编号为:2017-ZHZXYY-098.
1.1.2 试剂与仪器
胎牛血清、DMEM培养基等均购自北京碧云天生物有限公司;CCK-8试剂盒,白介素1β(interleukin-1β,IL-1β)、白介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)的ELISA试剂盒均购自武汉默沙克生物科技有限公司.荧光定量PCR试剂盒购自日本TAKARA公司;细胞牵张应力加载系统Flexcell 4000T由浙江大学基础医学院生物力学实验室共享.
1.2 实验方法
1.2.1 免疫组织化学染色检测滑膜组织的Piezo1蛋白表达
滑膜组织经体积分数为4%的多聚甲醛固定后,-80 ℃超低温冰箱保存,冰冻切片机切片,厚度为20 μm,PBST溶液清洗3次,每次5 min,体积分数为1%的HCl孵育30 min,PBST溶液清洗3次,每次5 min,体积分数为3%的过氧化氢孵育20 min,PBST溶液清洗后4 ℃避光过夜孵育Piezo1蛋白一抗(V抗体∶V抗体稀释液=1∶100)孵育时间>12 h,PBST溶液清洗3次,每次5 min,生物素标记的二抗(V抗体∶V抗体稀释液=1∶500)孵育30 min,避光.PBST溶液清洗后HRP-亲和素孵育30 min,PBST溶液清洗3次,每次5 min,DAB染色10 min后光学显微镜下观察.各取 5 个视野,应用 Image-Pro Plus 6.0 软件测定阳性表达产物的积分吸光度值和阳性面积值,分析Piezo1蛋白的相对表达量.
1.2.2 RAFLS的分离与培养
采用组织块法对RA滑膜组织进行培养,利用眼科剪对关节镜下获得的滑膜组织块修剪成1 mm3的组织,利用体积分数为5%的胶原酶处理4 h,体积分数为2.5%的胰蛋白酶处理30 min,经细胞筛分离后,加入混有体积分数20%胎牛血清的DMEM培养基,置入37 ℃体积分数5% 的CO2培养箱中进行培养,3 d换液一次,细胞融合率达80%以上时,进行细胞传代.取P3代细胞进行后续实验.
1.2.3 流式细胞仪鉴定RAFLS
P3代RAFLS细胞融合率为90%时,利用胰蛋白酶将其消化,添加培养基进行重悬,先进行细胞计数,5×106个细胞分别移至3个流式管,常温离心机2 000 r/min离心5 min,去掉上清液,PBS清洗3次,常温离心机2 000 r/min离心5 min,再次去掉上清液,其中2个流式管分别加入兔抗人CD90、CD68(V抗体∶V抗体稀释液=1∶200),剩余1管不加任何抗体,作为阴性对照.避光条件下4 ℃下孵育20~30 min,用 PBS 液清洗两次,2 000 r/min 离心 5 min,弃上清液,0.5 mL PBS 重悬,流式细胞仪检测 RAFLS 细胞表面标记物 CD90、CD68 的表达情况,以表面标记物阳性百分比(%)来表示.实验重复3次.
1.2.4 免疫组织化学染色检测RAFLS的波形蛋白表达
将已消毒的20 mm盖玻片置于90 mm培养皿中,将P3代RAFLS细胞调整为2×104/mL的细胞悬液,接种1 mL于培养皿中进行细胞爬片.PBS清洗3次,1 min/次,冰丙酮固定15 min.空气干燥 5 min,PBS清洗3次,2 min/次.体积分数为0.5%的Triton X-100孵育20 min,PBS清洗3次,2 min/次.体积分数为3%的过氧化氢孵育 15 min.封闭血清孵育20 min.波形蛋白一抗孵育(V抗体∶V抗体稀释液=1∶200),4 ℃湿盒中过夜,PBS清洗3次,5 min/次.HRP二抗工作液避光孵育30 min.PBS清洗3次,5 min/次.DAB显色(避光,镜下观察至棕色)约3~10 min,蒸馏水洗2次,1 min/次,树胶封片,光学显微镜下观察.
1.2.5 siRNA-Piezo1干扰载体的构建和慢病毒转染
siRNA-Piezo1基因干扰载体的构建和筛选由上海吉凯公司完成.首先通过Pubmed Genebank 查询人源Piezo1蛋白的基因序列以及ORF序列和3′-UTR序列.根据siRNA靶点设计原理,构建siRNA-Piezo1的干扰序列.选取上海吉凯公司提供的hU6-MCS-CMV-EGFP慢病毒载体作为酶切对象,加入siRNA-Piezo1干扰序列后,转染RAFLS细胞,进行克隆测定,然后抽提质粒,包装慢病毒以备用.
慢病毒转染前24 h,将靶细胞接种到96孔板中,使每孔中细胞数量在(3~5)×103之间,然后每孔添加100 μL培养基,各种细胞的生长速度是不一致的,为了得到准确的实验结果,在细胞融合率为40%~60%时予以病毒感染,因为慢病毒具有较长的表达时间,所以在转染时细胞应该呈现出较为稀疏的状态.利用RT-PCR检测Piezo1mRNA的表达量,以验证干扰效果.
1.2.6 体外细胞牵张应力模型的建立
取P3代RAFLS细胞,均匀接种于FlexCell公司的膜性6孔板中,待细胞融合率>60%时,加载机械牵张应力.根据预实验结果,设置周期为6次/s,幅度为20%,强度为50 Hz.时间梯度为24和48 h.
1.2.7 实验分组
根据预实验结果,将细胞分成空白对照组(不加载牵张应力,不添加干预试剂);siRNA-Piezo1组(细胞成功转染siRNA-Piezo1);siRNA-Piezo1+PD98059组(细胞成功转染siRNA-Piezo1后,添加ERK1/2的抑制剂PD98059进行干预);24 h应力组(加载24 h 牵张应力,不添加干预试剂),siRNA-Piezo1+24 h应力组(细胞成功转染siRNA-Piezo1后,加载牵张应力干预24 h);siRNA-Piezo1+PD98059+24 h应力组(细胞成功转染siRNA-Piezo1后,添加ERK1/2的抑制剂PD98059进行干预,加载牵张应力干预24 h);48 h应力组(加载48 h 牵张应力,不添加干预试剂);siRNA-Piezo1+48 h应力组(细胞成功转染siRNA-Piezo1后,加载牵张应力干预48 h);siRNA-Piezo1+PD98059+48 h应力组(细胞成功转染siRNA-Piezo1后,添加ERK1/2的抑制剂PD98059进行干预,加载牵张应力干预48 h).
1.2.8 CCK-8检测细胞增殖
收集各组细胞制成密度为1.1×106/mL的细胞悬液,接种于96孔板中,100 μL/孔,在37 ℃培养箱中培养5 h,然后每孔加入100 μL CCK-8试剂,避光37 ℃培养箱中孵育10 min,酶标仪测定吸光度D(450 nm).细胞增殖率=[D(450 nm)干预-D(450 nm)空白]/[D(450 nm)对照-D(450 nm)空白]×100%.
1.2.9 ELISA试剂盒检测关节液和细胞上清液IL-1β、IL-6和TNF-α的表达水平
根据ELISA试剂盒说明书的要求,以膝关节的关节液和滑膜细胞的上清液为研究对象,采用酶标仪吸光度法进行检测.将样本放置于ELISA试剂盒自带去酶96孔板,按照质量浓度梯度加入IL-1β、IL-6和TNF-α的ELISA检测试剂,酶标仪测定的吸光度D(450 nm).在Excel中对D(450 nm)数据进行直线回归分析,利用竞争法反曲线进行处理.以1/D(450 nm)为X轴,标准品浓度为Y轴,作标准曲线.得到方程y=2.640 9x2+6.129 7x-9.802 1.再将测得各个样品孔的D(450 nm)值代入公式计算出目的因子的质量浓度.
1.2.10 RT-PCR法检测Piezo1和ERK1/2的mRNA相对表达
利用胰蛋白酶收集各组细胞,经PBS溶液清洗3次,常温离心机1 500 r/min离心5 min,取沉淀,加入1 mL Trizol 溶剂,提取细胞总RNA,保证RNA纯度为1.8~2.1,然后利用TAKARA逆转录试剂盒的要求,采用20 μL反应体系逆转录为cDNA,-80 ℃保存,采用TAKARA荧光定量PCR试剂盒的要求,采用FTC-2000 RT-PCR系统和20 μL反应体系对样本DNA进行分析,具体反应体系如下:加入4 μL cDNA(10倍稀释),0.4 μL 正向引物,0.4 μL 反向引物,10 μL SYBR Green Master Mix,0.2 μL 50×ROX Reference Dye 2和5 μL ddH2O,从而组成20 μL反应体系.溶解曲线确定Tm值为53.7 ℃,统计并记录各组样本的CT值,采用2-ΔΔCT法对Piezo1和ERK1/2mRNA的相对表达水平.具体引物序列见表1.

表1 引物序列
1.3 统计学方法

2 结果
2.1 RA患者和正常对照者滑膜组织的Piezo1免疫组织化学染色结果
免疫组化的结果显示,RA患者滑膜组织中Piezo1蛋白的表达量要明显高于正常对照者,比较具有统计学差异(P<0.05,图1).
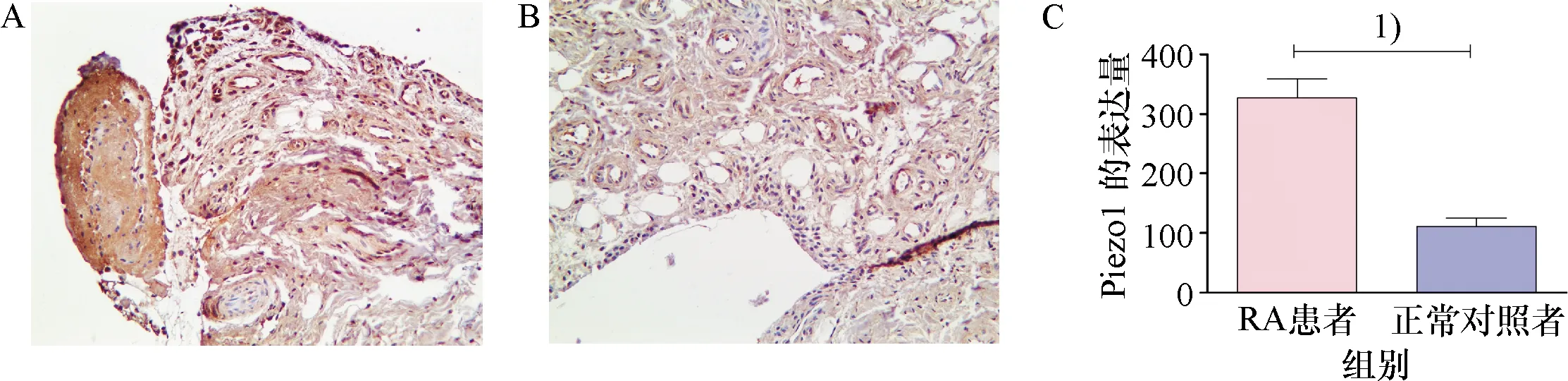
A: RA患者滑膜组织中Piezo1蛋白的表达;B: 正常对照者滑膜组织中Piezo1蛋白的表达;C: RA患者和正常对照组中Piezo 1表达量的比较结果.1)与正常对照者相比较,P<0.05.
2.2 RA患者和正常对照者关节液中IL-1β、IL-6和TNF-α的表达结果
ELISA测定结果显示,RA患者膝关节关节液中IL-1β、IL-6和TNF-α的表达量要明显高于正常对照者,比较具有统计学差异(P<0.05,图2).
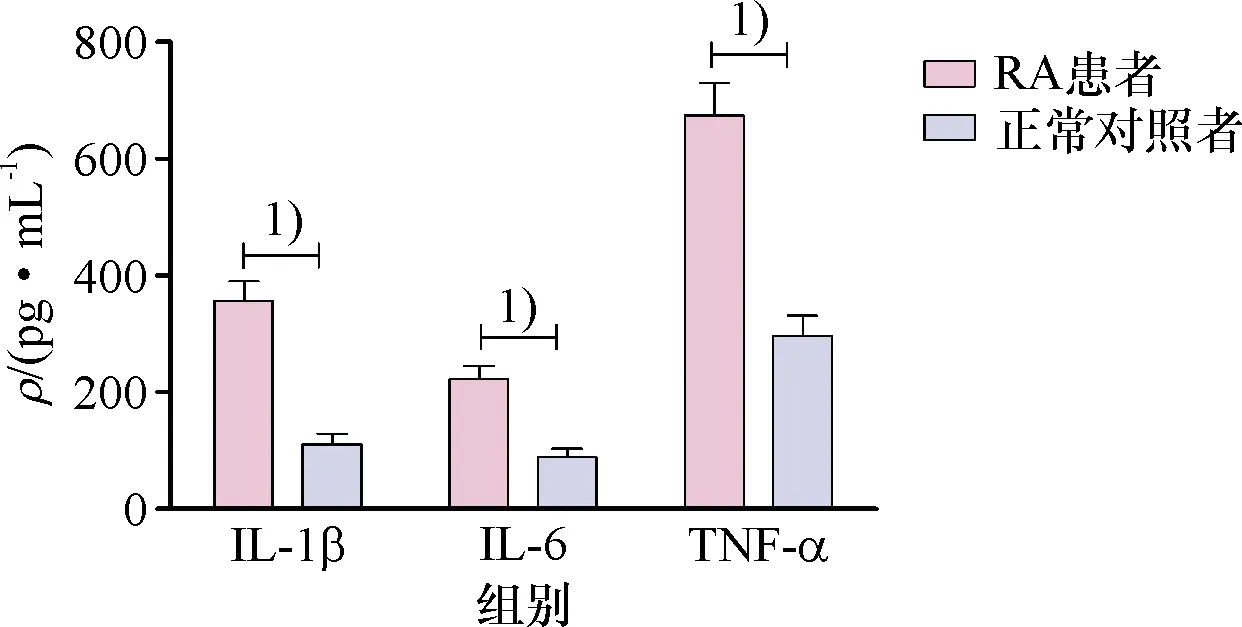
1)P<0.05.
2.3 RAFLS细胞的鉴定结果
显微镜下,提取原代细胞呈长梭形和多角形(图3A);免疫组化染色显示P3代细胞波形蛋白染色阳性(图3B);流式细胞仪结果显示,P3代细胞CD68阳性率为0.51%,CD90阳性率为94.38%(图3C、D).波形蛋白表达呈阳性,并且细胞表面CD90蛋白表达量高,CD68蛋白表达量低,符合RAFLS细胞特征,可以用作下一步实验.
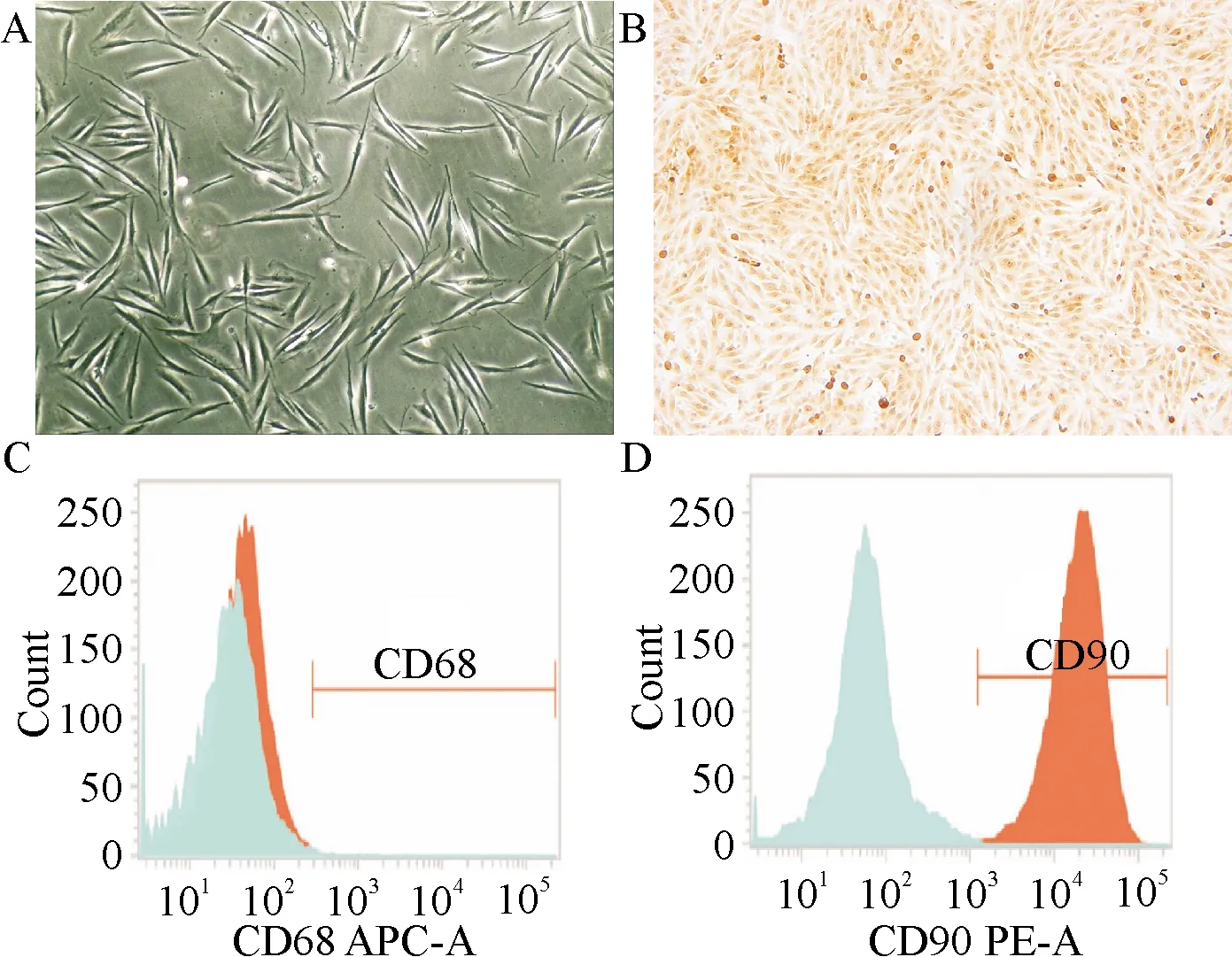
A:原代滑膜细胞(×200);B:波形蛋白免疫组化染色(×200);C:P3代细胞CD68阳性率;D.P3代细胞 CD68阳性率.
2.4 siRNA-Piezo1干扰序列转染RAFLS细胞的结果
荧光显微镜下观察,慢病毒转染RAFLS细胞的效率大于90%,RT-PCR结果显示,siRNA-Piezo1干扰序列转染RAFLS细胞后,Piezo1mRNA的表达量明显降低(P<0.05,图4).
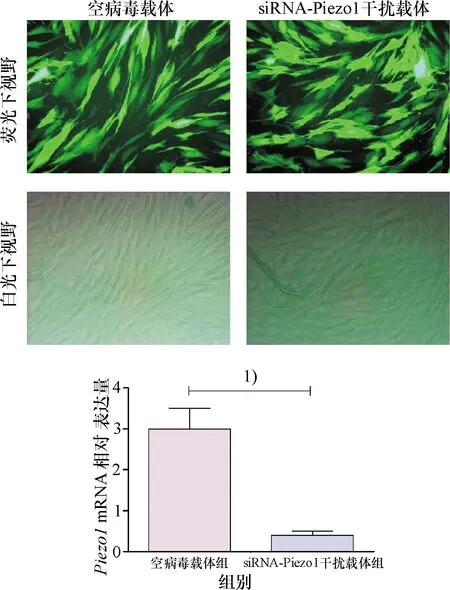
1)P<0.05.
2.5 牵张应力模型下RAFLS细胞的状态
光学显微镜下结果显示,机械牵张应力加载24 h后,RAFLS细胞分布较为密集,而机械牵张应力加载 48 h后,细胞密集程度更高,数量更多(图5 A、D和G);另外,siRNA-Piezo1和PD98059干预后,RAFLS细胞数较为稀疏(图5 B-I).
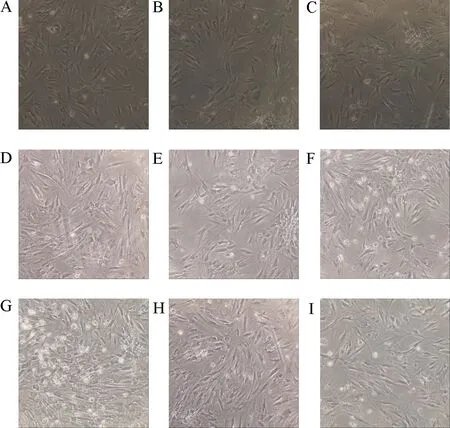
A:空白对照组;B:siRNA-Piezo1组;C:siRNA-Piezo1+PD98059组;D:24 h应力组;E:siRNA-Piezo1+24 h应力组;F:siRNA-Piezo1+PD98059+24 h应力组;G:48 h应力组;H:siRNA-Piezo1+48 h应力组;I:siRNA-Piezo1+PD98059+48 h应力组.
2.6 siRNA-Piezo1和PD98059干预对RAFLS细胞增殖的影响
CCK-8测定结果显示,24 h应力组和48 h应力组RAFLS细胞的增殖率均明显高于空白对照组(P<0.05),siRNA-Piezo1+24 h应力组和siRNA-Piezo1+48 h应力组RAFLS细胞的增殖率分别明显低于24 h应力组和48 h应力组(P<0.05),siRNA-Piezo1+PD98059+24 h应力组和siRNA-Piezo1+PD98059+48 h应力组RAFLS细胞的增殖率分别明显低于24 h应力组和48 h应力组(P<0.05)及siRNA-Piezo1+24 h应力组和siRNA-Piezo1+48 h应力组(P<0.05)(图6).

A: 不同牵张应力对RAFLS细胞增殖的影响;B:不同干扰抑制作用对RAFLS细胞增殖的影响;C:不同干扰抑制作用对24 h牵张应力下RAFLS细胞增殖的影响;D:不同干扰抑制作用对48 h牵张应力下RAFLS细胞增殖的影响.1)与空白对照组比较,P<0.05;2):与24 h牵张应力组比较,P<0.05;3)与siRNA-Piezo1组比较,P<0.05;4)与牵张应力组比较,P<0.05;5)与siRNA-Piezo1+牵张应力组比较,P<0.05.
2.7 siRNA-Piezo1和PD98059干预对IL-1β、IL-6和TNF-α的影响
ELISA测定结果显示,24 h应力组和48 h应力组细胞上清液的IL-1β、IL-6和TNF-α的表达量要明显高于空白对照组(P<0.05).siRNA-Piezo1+24 h应力组细胞上清液的IL-1β、IL-6和TNF-α的表达量要明显低于24 h应力组(P<0.05).siRNA-Piezo1+PD98059+24 h应力组细胞上清液的IL-1β、IL-6和TNF-α的表达量要明显低于siRNA-Piezo1+24 h应力组(P<0.05).siRNA-Piezo1+48 h应力组细胞上清液的IL-1β、IL-6和TNF-α的表达量要明显低于48 h应力组(P<0.05).siRNA-Piezo1+PD98059+48 h应力组细胞上清液的IL-1β、IL-6和TNF-α的表达量要明显低于siRNA-Piezo1+48 h应力组(P<0.05)(图7).
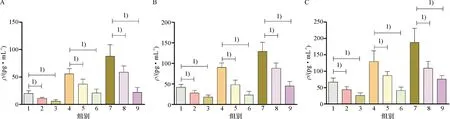
A:各组细胞上清液的IL-1β的表达;B:各组细胞上清液的IL-6的表达;C:各组细胞上清液的TNF-α的表达.
2.8 siRNA-Piezo1和PD98059干预对Piezo1和ERK1/2相对表达量的影响
RT-PCR测定结果显示,24 h应力组和48 h应力组细胞Piezo1和ERK1/2的mRNA的相对表达量要明显高于空白对照组(P<0.05).siRNA-Piezo1+24 h应力组和siRNA-Piezo1+48 h应力组细胞Piezo1和ERK1/2的mRNA的相对表达量要明显低于24 h应力组和48 h应力组(P<0.05).siRNA-Piezo1+PD98059+24 h应力组和siRNA-Piezo1+PD98059+48 h应力组细胞Piezo1的mRNA的相对表达量与siRNA-Piezo1+24 h应力组和siRNA-Piezo1+48 h应力组无明显差异(P>0.05),但是siRNA-Piezo1+PD98059+24 h应力组和siRNA-Piezo1+PD98059+48 h应力组细胞ERK1/2的mRNA的相对表达量要明显低于siRNA-Piezo1+24 h应力组和siRNA-Piezo1+48 h应力组(P<0.05)(图8).
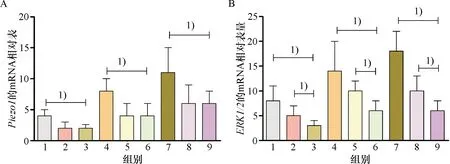
A:各组RAFLS细胞的Piezo1 mRNA相对表达量;B:各组RAFLS细胞的ERK1/2 mRNA相对表达量.
3 讨论
RA是临床上的常见病和多发病,主要与机体的免疫反应和关节腔滑膜组织炎症反应密切相关.RA的病理特点包括滑膜细胞的增生和炎症细胞的集聚、炎性因子的分泌[11-12].本研究主要聚焦于RA患者膝关节腔滑膜细胞的增殖特点和炎性因子的释放,并且以新型机械应力激活蛋白通道Piezo1为研究的切入点,探究其介导的力学信号在滑膜细胞增殖和炎性因子(IL-1β、IL-6和TNF-α)释放的表达特点,并且以ERK1/2信号通路为切入点进一步研究其机制,以期为RA的治疗和预防提供新的思路和方法.
既往研究表明,Piezo1蛋白的表达与OA患者膝关节软骨细胞的凋亡密切相关,在牵张应力作用下,OA软骨细胞中Piezo1蛋白的表达量明显增加,而且可以通过ERK5信号通路介导软骨细胞的过度凋亡,进而促进OA的进展[13].也有研究表明,Piezo1蛋白的激活可以促进骨肉瘤细胞的侵袭和增殖,利用Piezo1蛋白抑制剂GsMTx4抑制Piezo1蛋白的表达后,可以抑制骨肉瘤细胞的增殖,抑制细胞的侵袭[14].与之前的研究结果相同,本研究发现在机械牵张应力作用下,滑膜细胞中Piezo1mRNA表达水平明显增加,而且随着加载时间的延长,Piezo1的mRNA表达水平也相应提高.而且CCK-8实验结果表明,随着牵张应力加载时间的延长,滑膜细胞的增殖率明显增加.这些结果说明,Piezo1蛋白的表达量与滑膜细胞的增殖密切相关.另外,本研究还通过siRNA技术抑制了Piezo1的表达,结果表明,siRNA-Piezo1可以抑制滑膜细胞的增殖,因此,Piezo1可以介导力学信号刺激下滑膜细胞的增殖,对其具有促进作用.并且siRNA-Piezo1可以通过抑制Piezo1的表达,而达到抑制滑膜细胞增殖的效果.
RA患者关节病变除了与滑膜细胞增殖有关,还与炎性因子的过度表达密不可分.Jahid等[15]的结果表明,RA患者血清中IL-1β的表达明显增高.本研究利用ELISA试剂盒检测细胞上清液中炎性因子IL-1β、IL-6和TNF-α的表达,结果表明,牵张应力刺激可以促进炎性因子IL-1β、IL-6和TNF-α的表达,而利用siRNA抑制Piezo1的表达,联合PD98059小分子物质抑制ERK1/2的表达,可以抑制上清液中炎性因子IL-1β、IL-6和TNF-α的表达,并且效果要优于单纯一种方案.可见牵张应力可以促进RA滑膜细胞炎性因子表达量的增加,并且可以被siRNA-Piezo1和PD98059小分子物质所抑制.
另外,本研究还通过构建体外滑膜细胞牵张应力细胞模型,对Piezo1介导滑膜细胞增殖、促进炎性因子释放的机制进行了更深层次的探索.既往研究中,ERK1/2蛋白是一种以脯氨酸为导向的外源性丝氨酸/苏氨酸激酶,促进MAPK信号通路关键蛋白丝氨酸、苏氨酸双位点的磷酸化水平,从而使得生物学信号向下传导.有研究表明,ERK1/2与血管内皮细胞、心肌细胞等细胞增殖密切相关,可以调控细胞周期,促进细胞的增殖[16-17].在此基础上,本研究以ERK 1/2为切入点,对Piezo1蛋白介导的力学信号传导机制进行探索.RT-PCR结果表明,siRNA抑制Piezo1的表达可以抑制EKR1/2的表达,但是反过来,通过PD98059小分子物质抑制ERK1/2的表达不能抑制Piezo1的表达,这些结果说明ERK1/2蛋白可能是Piezo1蛋白的下游信号分子,可以传递力学信号.
综上所述,力学信号可以促进滑膜细胞的增殖和炎性因子的释放,并且siRNA-Piezo1可能通过ERK1/2信号通路阻断力学信号的传导而发挥抑制滑膜细胞增殖和炎性因子的释放的作用.
