甲苯咪唑在异育银鲫体内代谢及肝毒性研究
2020-09-23苏美珍张祎桐吕利群
苏美珍,张祎桐,王 浩,吕利群
( 1.上海海洋大学,国家水生动物病原库,上海 201306; 2.上海海洋大学,农业农村部淡水水产种质资源重点实验室,上海 201306; 3.上海海洋大学,水产科学国家级实验教学示范中心,上海 201306 )
甲苯咪唑(MBZ)属于苯并咪唑类药物,又名甲苯达唑、二苯酮咪胺酯、安乐土,其化学名为(5-苯甲酰基-1H-苯并咪唑-2-基)氨基甲酸甲酯,是一种广谱性驱虫药物,可用于防治蛔虫、丝虫、钩虫、蛲虫(Enterobiusvermicularis)、鞭虫(Trichuristrichura)、粪类圆线虫(Strongyloidesstercoralis)等肠道寄生虫的疾病[1-3]。
近年来,随着集约化水产养殖的迅速发展,也带来了鱼类寄生虫感染病,造成了严重经济损失,逐渐引起人们的重视[4]。甲苯咪唑作为代替传统的治疗寄生虫疾病的药物,其副作用和残留量较大。口灌的甲苯咪唑主要黏附在肠道部位,吸收后分布在血液、肾脏、肝脏等部位,主要分布在肝胰脏[5]。口服甲苯咪唑也会损伤鱼类的生理功能。20多年的临床试验发现,口服甲苯咪唑会带来一系列的不良反应[6-8]。需氧生物在氧化还原中会产生大量的活性氧,而活性氧是自由基的重要组成部分,少量的自由基是必需,但是,自由基过量就会对生物机体造成氧化损伤。生物在生长过程中,体内形成了一套完整清理机体内过多的自由基的抗氧化系统[9]。其中超氧化物歧化酶是抗氧化酶系统重要成分之一,是一种能反映机体清除自由基能力的酶[10]。过氧化氢酶也是一种抗氧化剂酶,对于防止产生有害的阴离子,在减轻氧化损伤中起到重要的作用。谷胱甘肽过氧化物酶是一种氧自由基捕获剂。超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化氢酶属于抗氧化剂酶,都是描述药物综合毒理学效应的酶类。机体损伤时会破坏抗氧化酶的活性,改变抗氧化酶基因的表达[11]。碱性磷酸酶在生物体解毒过程中起重要的作用;谷丙转氨酶、谷草转氨酶是催化氨基酸与酮酸间氨基转移的一类酶。谷丙转氨酶和谷草转氨酶主要存在于心肌细胞和肝脏细胞中,血清中含量很少。但机体发生损伤时,细胞内的谷丙转氨酶和谷草转氨酶会从细胞中逸出到血液,血清中的谷丙转氨酶和谷草转氨酶活性就会增加[12]。碱性磷酸酶、谷丙转氨酶和谷草转氨酶与肝功能有关,易受环境的影响,即肝细胞受损时,就会触发这些酶的活性。
得益于鱼体内药代动力学研究方法的成熟,制定甲苯咪唑在异育银鲫各组织中的代谢曲线为其休药期的制定提供了依据。但是迄今未见甲苯咪唑在异育银鲫(Carassiusauratusgibelio)体内药物毒性的研究。我国异育银鲫的年产量接近2.5×106t,但疾病频发,养殖用药量大且用药安全风险高,出于合理用药、安全用药的需要,笔者比较了甲苯咪唑在异育银鲫血液、肝胰脏和肾脏的富集水平,研究其最高富集组织中药物的肝毒性,为甲苯咪唑的科学使用提供理论依据。
1 材料与方法
1.1 材料
体表健康的异育银鲫300尾,体质量(90±20) g,购于中国江苏省乌江县,暂养于实验室内水族箱,试验水温(20±2) ℃,正常供氧,试验前24 h停止投喂。
99%甲苯咪唑原粉,0.22 μm有机系滤头,1 mL一次性灭菌注射器,草酸钾,氯化钠,DEPC水[生工生物工程(上海)股份有限公司];99.5%甲苯咪唑标准品(含量 99.5%)(Ehrenstorfer Quality);甲醇(色谱级),甲酸(色谱级),乙腈,水(色谱级),三氯甲烷(中国上海国药化学试剂);CNW 9 mm棕色螺旋口自动进样瓶,250 μL尖底玻璃内插管,9 mm开孔拧盖(上海安谱实验科技股份有限公司);过氧化物歧化酶试剂盒,过氧化氢酶试剂盒,谷胱甘肽过氧化物酶试剂盒,碱性磷酸酶试剂盒,谷草转氨酶试剂盒,谷丙转氨酶试剂盒,总蛋白定量试剂盒(南京建成生物工程研究所);TRlzol(Invitrogen公司);PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit,TB GreenTMPremix Ex TaqTM Ⅱ(Tli RNaseH Plus)(Takara公司)。
UPLC/MS线性离子阱质谱仪(Waters公司);漩涡混匀器(上海本昂科学仪器有限公司);TDL8M台式大容量冷冻离心机(上海卢湘仪器有限公司);超纯水仪(成都浩纯仪器设备责任有限公司);超声波清洗机(上海分析超声仪有限公司);低温保藏箱(Haier公司);组织匀浆仪(Sigma公司);电子分析天平(上海海康仪器有限公司);多功能酶标仪(Promege公司);CFX96荧光定量PCR仪(Bio-Rad公司)。
1.2 甲苯咪唑标准溶液配制及其标准曲线的建立
准确称取甲苯咪唑10 mg,用88%甲酸溶解于100 mL棕色量瓶中,加入色谱级甲醇到刻度线后充分混匀,配置质量浓度为100 μg/mL的甲苯咪唑标准储备液。将配置好的甲苯咪唑标准储备液分别稀释为0.05、0.02、0.01、0.005、0.002、0.001 μg/mL,然后建立标准曲线。
1.3 色谱条件
样品分析仪为UPLC/MS线性离子阱质谱仪,色谱柱是Hypersil Gold,规格为100 mm×2.1 mm,1.9 μm,流速0.2 mL/min,进样量5 μL,柱温30 ℃,离子源ESI,正离子模式,锥孔电压30 V,扫描方式多离子监测,脱溶剂气温150 ℃,脱溶剂气流量600 L/h,离子对(定量离子对和定性离子对)m/z为264~296。洗脱程序见表1。
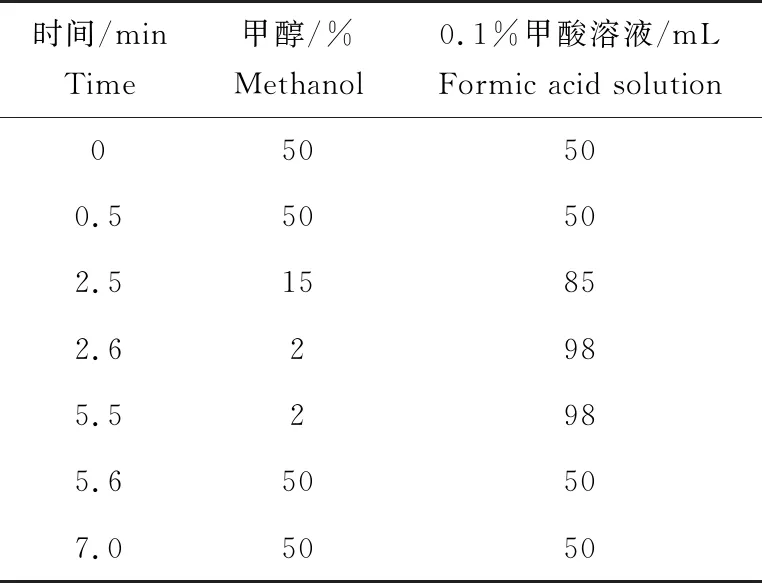
表1 梯度洗脱程序表
1.4 方法
由300尾健康异育银鲫中随机选取数尾。准确称取100 mg 甲苯咪唑,先用少许的甲酸溶解,再用蒸馏水定容,配制为4 mg/mL。按照20、10、5 mg/kg的药量用胃管灌胃给药。在给药后1、2、4、6、10、24、48、84 h自鱼尾静脉取血。在取出的血中立即加入2%的草酸钾抗凝剂(抗凝剂∶血浆=1∶10,体积比)混匀,然后以4000 r/min离心10 min;同时迅速取肝胰脏和肾脏样品。所有样品放置冰箱-80 ℃冷冻保存。每个时间点取3尾鱼,3个平行。
随机选取数尾健康异育银鲫,分为两组。第一组对照组口灌5%甲酸,第二组试验组口灌20 mg/kg甲苯咪唑。分别在给药后的0、24、48 h取肝脏处理测定超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化氢酶、谷丙转氨酶、谷草转氨酶、碱性磷酸酶活性和超氧化物歧化酶、过氧化氢酶基因的表达量情况。
甲苯咪唑药代样品处理方法参考文献[13]。将血浆、肝脏、肾脏样品在室温下自然解冻,取500 μL血液于2 mL离心管中加入750 μL甲醇,6000 r/min离心5 min,取上清液。重复2次,合并上清液于1200 r/min离心20 min,取上清液过0.22 μm有机系微孔滤膜,滤液待上机检测。准确称取0.2 g的肝胰脏和0.2 g的肾脏于15 mL离心管中,分别加入1 mL的甲醇,用组织匀浆机匀浆,6000 r/min离心10 min,取上清液。重复2次,合并上清液,分别加入1 mL正己烷,混匀,于12 000 r/min离心10 min,滤液过0.22 μm有机系微孔滤膜,滤液待上机检测。
鱼体超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化氢酶和碱性磷酸酶活力测定:分别取口灌20 mg/kg 甲苯咪唑后0、24、48 h的异育银鲫肝胰脏于预冷的0.86%氯化钠中漂洗,除去血液,滤纸擦干。准确称取0.2 g肝胰脏样品放入2 mL离心管中,加入0.86%氯化钠,用组织匀浆机匀浆(加入生理盐水的体积总量是样品质量的9倍)制作成10%的组织匀浆,之后于2000 r/min离心10 min。按照南京建成生物工程研究所试剂盒的说明书测定超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化氢酶和碱性磷酸酶的活性。
血液中谷草转氨酶、谷丙转氨酶活力测定:分别取口灌0、24、48 h后鱼的血浆,立即加入2%的草酸钾抗凝剂(抗凝剂∶血浆=1∶10,体积比)混匀,于1000 r/min离心5 min,取上清液。按照南京建成生物工程研究所试剂盒的说明书方法测定谷草转氨酶和谷丙转氨酶的活性。
肝胰脏中超氧化物歧化酶和过氧化氢酶基因表达量的测定:分别取口灌0、24、48 h鱼的肝胰脏,用Trizol法从肝胰脏中分离总RNA,用逆转录试剂盒合成cDNA。采用实时定量PCR来测定超氧化物歧化酶和过氧化氢酶基因表达量的变化。所用的引物由美国国立生物技术信息中心上查找异育银鲫的序列合成,引物序列见表2。采用TBgreen酶。Real time PCR程序:95 ℃预变性30 s,95 ℃变性5 s,55 ℃退火30 s,共37个循环。熔解曲线分析:95 ℃ 10 s,65 ℃ 5 s,温度由65 ℃升至95 ℃,此过程不断收集荧光信号,形成熔解曲线。测定口灌0、24、48 h异育银鲫超氧化物歧化酶和过氧化氢酶两种基因表达量的变化。
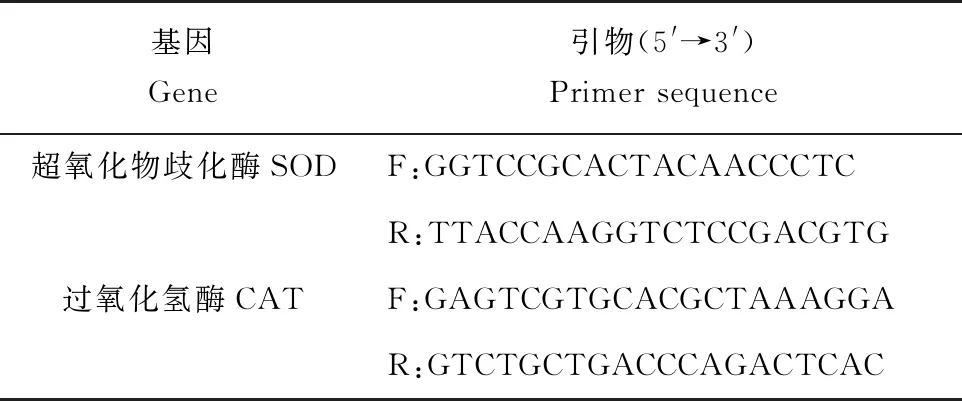
表2 试验中所用到的引物
1.5 回收率及精密度
回收率:取空白的血清500 μL加入1 mg/mL的甲苯咪唑溶液,取肝胰脏0.2 g,肾脏0.2 g分别加入少许甲醇进行组织匀浆,然后再分别加入1 mg/mL的甲苯咪唑溶液。之后分别稀释为1.0、0.5、0.1 μg/mL,按照甲苯咪唑样品预处理的方法处理,测定回收率。每个质量浓度3个平行,取其平均值为实际测定质量浓度。
回收率/%=Cr/C0×100%
式中,Cr为空白样品(血液或者肝肾脏)加入了一定量的甲苯咪唑后测定的试剂质量浓度,C0为加入一定量甲苯咪唑已知标准质量浓度。
精密度:同一样品1 d内不同时间测3次,连续测3 d,之后测定血液、肝胰脏、肾脏中甲苯咪唑的日内和日间平均变异系数,来判断该方法的精密度。
1.6 数据处理
图表用Excel 2010制作,使用DAS 3.0药代动力学软件、Masslynx V 4.1软件和SPSS软件分析处理试验数据。
2 结 果
2.1 甲苯咪唑标准工作曲线
甲苯咪唑标准工作曲线为y=57 387.6x+112 015(r2=0.989903),在1~50 ng/mL内,甲苯咪唑的峰面积与其质量浓度呈较好的线性关系(图1)。
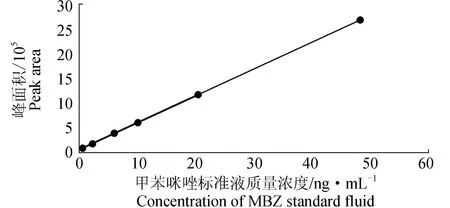
图1 甲苯咪唑标准工作曲线
2.2 回收率与精密度
由表3可知,在含有甲苯咪唑标准品1.0、0.5、0.1 μg/mL的组织样品中,异育银鲫血液、肝胰脏和肾脏样品中的回收率分别为79.91%~83.68%、78.23%~89.46%和87.26%~95.94%;其日内变异系数分别为1.16%~8.22%、0.51%~2.83%和1.81%~13.59%;日间变异系数为1.04%~2.29%、1.98%~7.32%和1.81%~2.96%。表明此方法处理样品组织,可以得到较高的回收率,重复性良好。

表3 异育银鲫血液、肝胰脏和肾脏中甲苯咪唑的回收率和变异系数
2.3 甲苯咪唑在异育银鲫体内药代动力学规律
分别口灌20、10、5 mg/kg 甲苯咪唑后,异育银鲫血液、肝胰脏、肾脏中的药时曲线见图2~图4。3种质量浓度甲苯咪唑分别在血液、肝胰脏和肾脏中的药时曲线变化基本一致,均呈现先升后降的变化趋势。
由图2可见,口灌20、10、5 mg/kg的甲苯咪唑24 h时,异育银鲫肾脏中甲苯咪唑含量分别为6.1163、1.1026、0.2005 μg/g;24 h后异育银鲫肾脏中甲苯咪唑含量则开始迅速下降。口灌不同剂量后,甲苯咪唑在异育银鲫组织中含量分布为肝胰脏>肾脏>血液。
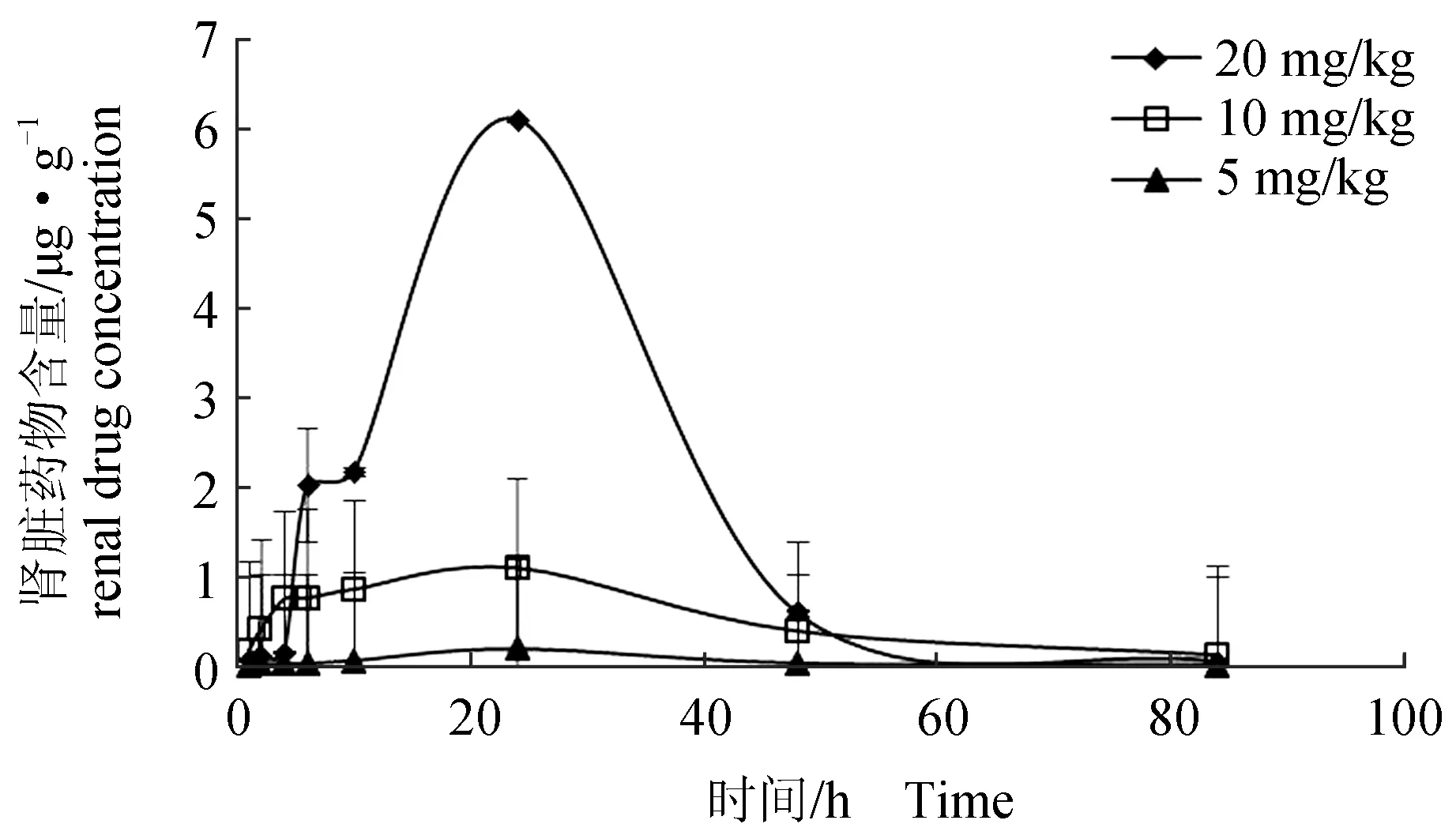
图2 不同剂量下异育银鲫肾脏中甲苯咪唑的药—时曲线
由图3可见,口灌质量浓度为20、10、5 mg/kg的甲苯咪唑24 h时,异育银鲫血液中甲苯咪唑含量达最大值,分别为0.1837、0.0540、0.0067 μg/mL,0~24 h异育银鲫血液中甲苯咪唑含量呈上升趋势,达到最高峰后甲苯咪唑含量则开始下降,在84 h时甲苯咪唑在异育银鲫血液中几乎被代谢完全。

图3 不同剂量下异育银鲫血液中甲苯咪唑的药—时曲线
由图4可见,口灌20、10、5 mg/kg的甲苯咪唑后,肝胰脏中甲苯咪唑含量呈先升后降的趋势,在24 h时甲苯咪唑含量达最高值,分别为8.2248、3.3963、0.5744 μg/g;24 h后肝胰脏中的甲苯咪唑则被逐渐代谢掉,到84 h时,肝胰脏中的甲苯咪唑含量几乎被代谢完全。
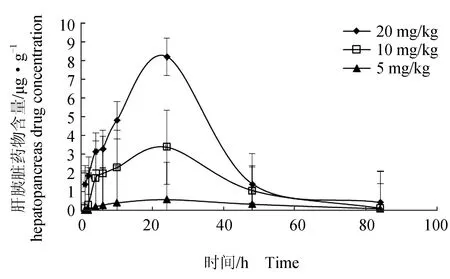
图4 不同剂量下异育银鲫肝胰脏中甲苯咪唑的药—时曲线
用DAS 3.0药代动力学软件分析药代数据后所得的药代动力学参数见表4。口灌20、10、5 mg/kg甲苯咪唑后,异育银鲫血液中甲苯咪唑峰质量浓度分别为0.1837、0.0540、0.0067 μg/mL,达峰时间均为24 h,药时曲线下面积(0~t)和药时曲线下面积(0~∞)分别为6.497 mg/(L·h)和11.815 mg/(L·h)、1.622 mg/(L·h)和1.648 mg/(L·h)、0.274 mg/(L·h)和0.355 mg/(L·h),消除半衰期分别为51.788、16.312、43.841 h。肝胰脏中甲苯咪唑峰含量分别为8.2248、3.3963 μg/g和0.5744 μg/g,达峰时间均为24 h,药时曲线下面积(0~t)和药时曲线下面积(0~∞)分别为271.527 mg/(L·h)和284.857 mg/(L·h)、129.337 mg/(L·h)和131.734 mg/(L·h)、27.994 mg/(L·h)和32.123 mg/(L·h),消除半衰期分别为21.237、12.575、25.02 h。肾脏中甲苯咪唑峰含量分别为6.1163、1.1026、0.2005 μg/g,达峰时间均为24 h,药时曲线下面积(0~t)和药时曲线下面积(0~∞)分别为161.803 mg/(L·h)和162.531 mg/(L·h)、45.705 mg/(L·h)和45.933 mg/(L·h)、7.396 mg/(L·h)和8.117 mg/(L·h),消除半衰期分别为9.192、9.326 h和34.914 h。
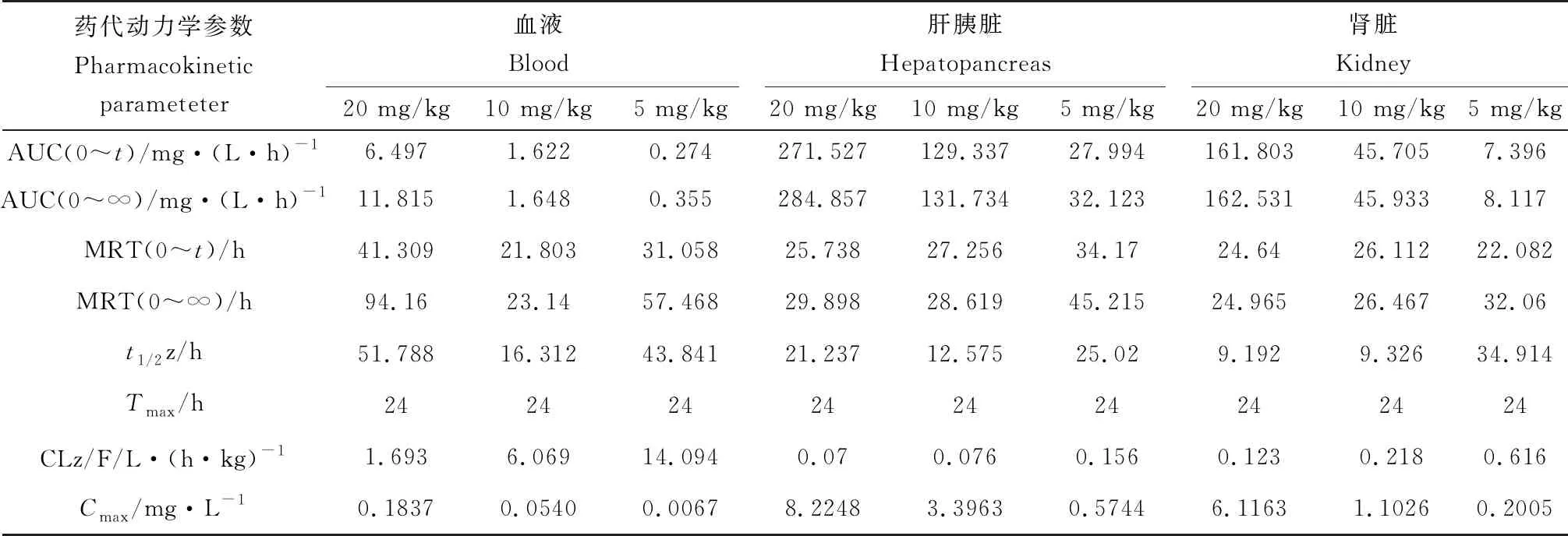
表4 口灌不同剂量甲苯咪唑在异育银鲫血液、肝胰脏和肾脏中的药代动力学参数
2.4 甲苯咪唑对异育银鲫肝胰脏相关酶活性影响
2.4.1 甲苯咪唑对异育银鲫肝胰脏中谷胱甘肽过氧化氢酶、碱性磷酸酶、过氧化氢酶、超氧化物歧化酶活性的影响
异育银鲫口灌20 mg/kg甲苯咪唑后,肝胰脏中谷胱甘肽过氧化氢酶活性呈时间依赖性下降(图5a)。肝胰脏中的碱性磷酸酶活性呈先升后降的趋势(图5b)。在24 h时碱性磷酸酶活性远高于0 h时,此时对照组甲酸对肝胰脏中碱性磷酸酶活性的影响也较大;48 h时肝胰脏中碱性磷酸酶活性高于0 h,低于24 h。肝胰脏中过氧化氢酶的活性呈先升后降的变化趋势,给药24 h时,过氧化氢酶在肝脏中的活性值最高;48 h时较0 h时有所升高,较24 h下降(图5c)。给药后肝胰脏中超氧化物歧化酶活性先升后降,给药24 h,肝胰脏中超氧化物歧化酶活性达最高值;48 h肝胰脏中超氧化物歧化酶活性较0 h时有所上升,较24 h时有所下降(图5d)。
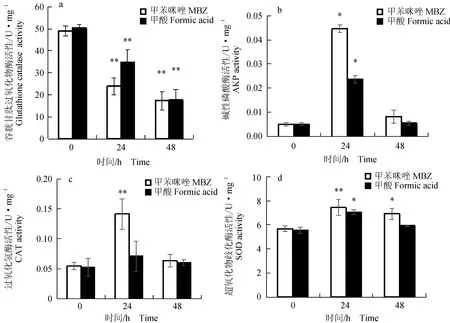
图5 口灌20 mg/kg甲苯咪唑异育银鲫肝胰脏中谷胱甘肽过氧化物酶、碱性磷酸酶、过氧化物酶和超氧化物歧化酶活性的变化
2.4.2 口灌甲苯咪唑后异育银鲫血液中谷草转氨酶、谷丙转氨酶活性的变化
异育银鲫口灌20 mg/kg甲苯咪唑后,血液中谷草转氨酶、谷丙转氨酶活性先升后降,给药24 h时,血液中的谷草转氨酶、谷丙转氨酶活性最高,给药48 h时,血液中谷草转氨酶、谷丙转氨酶活性较24 h下降,较0 h上升(图6)。对照组口灌甲酸后,对血液中谷草转氨酶、谷丙转氨酶活性影响不大。
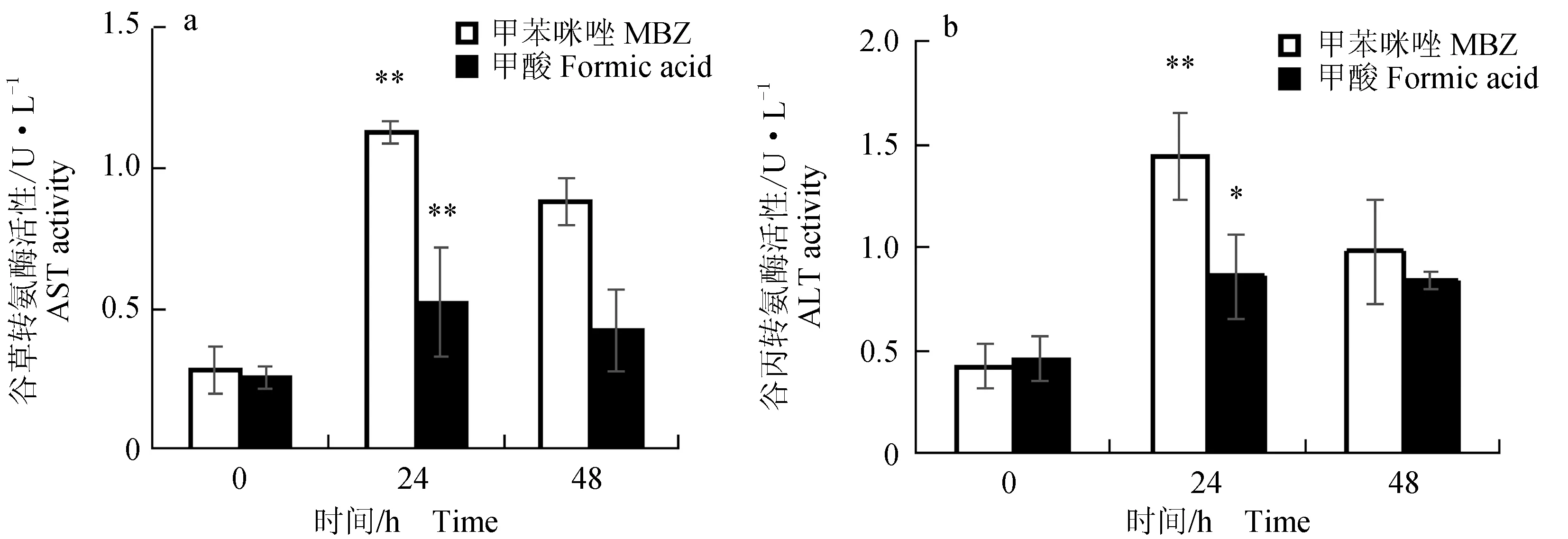
图6 口灌20 mg/kg 甲苯咪唑异育银鲫肝胰脏中谷草转氨酶和谷丙转氨酶活性变化
2.5 甲苯咪唑对异育银鲫氧化应激超氧化物歧化酶、过氧化氢酶基因表达的影响
口灌20 mg/kg甲苯咪唑后,肝胰脏中超氧化物歧化酶基因的mRNA水平减少,24 h时超氧化物歧化酶基因的mRNA水平最低,甲苯咪唑处理组和甲酸对照组都使超氧化物歧化酶基因表达下调(图7a)。给药后,甲苯咪唑处理组和甲酸对照组都使肝胰脏中的过氧化氢酶基因表达下调;同样,在24 h时,过氧化氢酶基因的mRNA水平达最小值(图7b)。
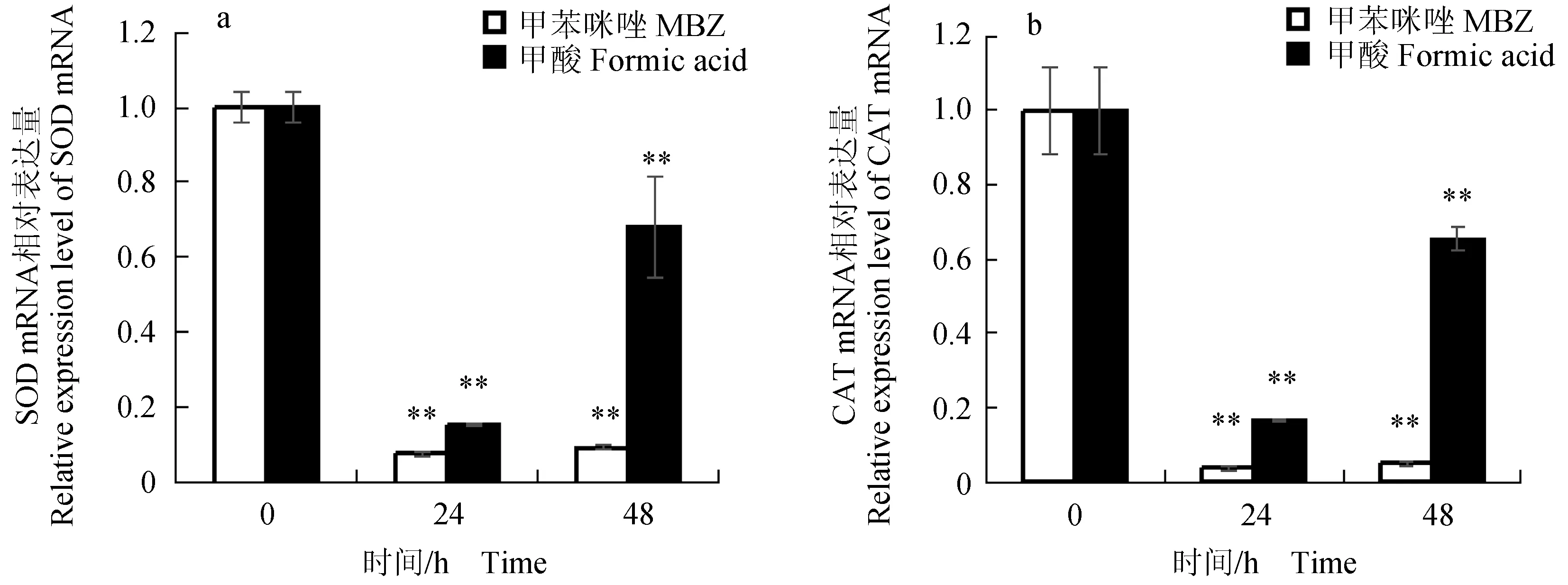
图7 口灌20 mg/kg甲苯咪唑后异育银鲫肝胰脏中超氧化物歧化酶和过氧化氢酶基因mRNA相对表达量变化
3 讨 论
3.1 甲苯咪唑在异育银鲫体内的吸收与分布特征
滥用水产药物可使鱼类产生耐药性或药物残留在鱼体和人体内,很有可能危及人类的健康。所以研究药物在鱼体内的代谢及其对鱼类的损伤迫在眉睫。不同时间甲苯咪唑在异育银鲫血液、肝胰脏和肾脏中的分布情况为:在0~24 h之间在体内的含量逐步升高,24 h时达到最高峰,24 h后开始下降。这说明口灌24 h内,甲苯咪唑在异育银鲫体内被吸收,24 h后异育银鲫体内的甲苯咪唑不断发生代谢。口灌20 mg/kg甲苯咪唑24 h时,血液、肝胰脏和肾脏中的甲苯咪唑含量分别为0.1837、8.2248、6.1163 μg/g,84 h时分别为0.0013、0.4317、0.0623 μg/g。可以看出,在84 h时甲苯咪唑在异育银鲫体内已基本代谢完。这一代谢规律与文献[14-15]的论述类似:甲苯咪唑在团头鲂(Megalobramaamblycephala)体内主要代谢物及其变化规律,在给药24 h,体内的甲苯咪唑含量也不断增高,在24 h含量达到峰值;在复方甲苯咪唑在异育银鲫体内的药物动力学研究中发现,前期复方甲苯咪唑在体内快速吸收达到峰值后,药物开始在体内代谢;在96 h时复方甲苯咪唑在异育银鲫体内几乎被代谢完全。
本试验中,给药24 h时,鱼体各组织中甲苯咪唑达到峰值的顺序为:肝胰脏>肾脏>血液,肝脏中的甲苯咪唑吸收最快,分布最多,而血液中甲苯咪唑的含量低于肝胰脏和肾脏。这可能是因为肝胰脏是主要的解毒器官,相比其他组织吸收更快;其次可能是因为甲苯咪唑溶解度低,在肠壁和肝脏中存在着首过效应[13],所以大部分药物主要存在于肝胰脏或者肾脏中,所以推测甲苯咪唑的吸收和分布情况可能与药物的理化性质和鱼体组织器官有关[16]。此次对甲苯咪唑在异育银鲫体内的药代研究也给有关部门制定甲苯咪唑最高残留量以及休药期提供了参考。
3.2 甲苯咪唑对异育银鲫的肝毒性分析
正常情况下,动物体内的氧化—抗氧化系统呈稳定状态,但当外界有毒物质进入机体后,破坏动物体内的氧化—抗氧化系统,产生过多的自由基,机体内有关酶性和非酶性抗氧化系统就会清除过多的自由基[17]。超氧化物歧化酶和过氧化氢酶是生物体内重要的抗氧化物酶,是抵御氧化应激的第一道防线。超氧化物歧化酶是保护酶系统的重要组成部分[18],它的作用原理是催化超氧化物自由基成为过氧化氢,再在过氧化氢酶的作用下将过氧化氢还原为水。由图5c、d可知,超氧化物歧化酶和过氧化氢酶的活性呈先升后降的变化趋势,在24 h时,超氧化物歧化酶、过氧化氢酶活性达最高值。这可能是由于肝脏是机体内的主要解毒器官,甲苯咪唑含量也最高,所以产生的活性氧较多所致。此时的超氧化物歧化酶和过氧化氢酶发挥抗氧化应激作用,清除体内过多的自由基。在48 h时机体内的超氧化物歧化酶和过氧化氢酶活性相对于24 h而言酶活性被抑制,这可能与过量的抗氧化应激反应有关[19]。过氧化氢酶的活性降低也可能是因为超氧化物歧化酶活性降低导致的过氧自由基过多[20]。有研究报道,过多的超氧阴离子可以抑制过氧化氢酶的活性[21]。
谷胱甘肽过氧化物酶也是机体内重要的抗氧化剂,能清除机体中的过氧化氢和细胞膜中脂质过氧化产物,起到保护细胞膜结构、功能完整、增强机体免疫和抗病的作用[22-23]。由图5a可知,谷胱甘肽过氧化物酶的活性呈下降趋势。这可能是因为谷胱甘肽过氧化物酶在解毒的过程中活性受到了抑制。由图7a、b可见,口灌20 mg/kg甲苯咪唑后,超氧化物歧化酶基因的mRNA水平呈先下降后上升的趋势,这可能是因为肝脏中的谷胱甘肽过氧化物酶和过氧化氢酶活性增加。Jin等[24]将小鼠长期暴露于Pb中,小鼠的谷胱甘肽过氧化物酶发生剂量依赖性降低,与本试验的结果类似。碱性磷酸酶是机体在代谢或抗氧化过程中关键酶,是磷代谢重要酶类之一,主要存在于骨骼、肝脏等地方,与生物体的成长密切相连[25-26]。由图5b可知,肝胰脏中碱性磷酸酶的活性呈先升后降的变化趋势。在24 h时碱性磷酸酶活性达最高值,在48 h时碱性磷酸酶活性相较24 h时下降,这提示了肝胰脏中的碱性磷酸酶活性受甲苯咪唑的含量和给药的时间影响。先升后降的趋势是动物对毒物的反应形式,即抛物线形式;抛物线顶点是动物对毒物的最大反应值[27]。在24 h时,异育银鲫肝胰脏中的甲苯咪唑含量最高,这使得24 h碱性磷酸酶的活性相较于0、48 h而言最高。
谷丙转氨酶、谷草转氨酶是动物体内重要的氨基酸转氨酶,其活性变化也反映肝细胞受损的情况。谷丙转氨酶主要存在于细胞浆中,谷草转氨酶则主要存在于线粒体中[28-29],在血清中的含量很少,当肝脏受损时,细胞浆中的谷丙转氨酶、谷草转氨酶就会释放到血液中,血清中的谷丙转氨酶、谷草转氨酶活性增加[12]。由图6a、6b可知,血清中谷丙转氨酶、谷草转氨酶的变化趋势是先升后降。在24 h时血清中谷丙转氨酶、谷草转氨酶活性最高,这可能是因为在24 h时,肝脏中的甲苯咪唑含量最高,肝细胞受损比较严重,细胞浆中的谷丙转氨酶、谷草转氨酶释放到血液中,使血清中谷丙转氨酶、谷草转氨酶的活性升高。这与卢敬让等[30]的研究结果类似。在48 h时谷丙转氨酶、谷草转氨酶的活性相较24 h时下降,较0 h时上升。这可能是因为48 h时肝胰脏中的甲苯咪唑被代谢掉,毒性相较24 h时降低了,所以此时血清中谷丙转氨酶、谷草转氨酶活性低于24 h时,但要高于0 h时。本试验结果提示,不应长期使用甲苯咪唑防控寄生虫,需要在药物使用后进行药物保肝处理;在肝胆综合征和鲫疱疹病毒并发期应慎用甲苯咪唑。
