复方中草药对弧菌感染下虹鳟免疫相关基因表达的影响
2020-09-23陈万光左小玉
蔡 冰,陈万光,王 凡,左小玉
( 洛阳师范学院 生命科学学院,河南 洛阳 471934 )
虹鳟(Oncorhynchusmykiss)为鲑科的冷水性代表鱼类,因其肉质鲜美而受到广大消费者的青睐,使其成为目前养殖最广泛的淡水鱼类之一[1]。随着养殖规模的扩大,养殖密度、饲料用量和水环境质量等原因导致虹鳟病害频发。弧菌(Vibrio)是水产养殖中重要的致病菌,具有流传广和发病率高等特点,而弧菌病对虹鳟养殖业的健康发展影响巨大[2]。
目前,对病原微生物的防控多使用抗生素和化学合成药物,但这些药物长期不合理的应用会使病原菌产生耐药性并导致水产品中药物残留量超标,造成环境的污染并最终威胁人类健康[3-4]。中草药作为天然药物,历史悠久,富含各种活性物质以及微量元素,具有毒副作用小、不易产生耐药性等优势[5]。因此,中草药在鱼类养殖上的应用不仅能够预防治疗疾病,还能够保证水产品的质量安全。复方中草药能够有效结合各种不同的单一中草药药效,从而使预防和治疗发挥到最大效果[6]。研究表明,复方中草药添加剂能够增强水产动物的免疫力和抗病力[4-5,7-11]。
红枣、山药和黄芪是我国常见食用兼药用的中药药材。研究表明,大枣提取液对细胞及体液免疫均具有很强的促进效果,可增强免疫功能[12];山药提取物能够调控虹鳟免疫系统中的趋化因子信号途径、白细胞经内皮细胞迁移通路和血小板活化通路[13];黄芪提取物对鲤鱼(Cyprinuscarpio)肝脏损伤具有一定的保护作用且对常见病原菌具有很强的抑菌效果[14-15]。
副溶血弧菌(V.parahemolyticus)容易引起细菌性食物中毒,主要分布于沿岸海水和水产品中,近年来,其在淡水鱼体内和养殖水体中被广泛地检测出[16]。笔者对投喂复方中草药添加剂(红枣提取物+山药提取物+黄芪提取物)的虹鳟在副溶血弧菌感染下的抗氧化基因的表达影响进行探索,以期解释复方中草药对虹鳟在病原菌刺激下的抗氧化免疫反应的分子机制,并为在虹鳟养殖中的复方中草药添加提供参考。
1 材料与方法
1.1 研究对象
虹鳟幼鱼购自四川省眉山市东坡区天贵水产养殖场,体长7.6~8.9 cm,于洛阳师范学院冷水鱼养殖工程研究中心循环系统的圆柱形水族箱(直径1 m)中暂养14 d;每日定时投喂虹鳟幼体基础饲料2次;暂养期间,水温11~15 ℃,pH 7.0±0.2,溶解氧>8.0 mg/L。取规格一致、游动敏捷和健康良好的虹鳟幼体分组进行试验。
1.2 试验试剂
红枣提取物(20∶1型)、黄芪提取物(20∶1型)和山药提取物(20∶1型)(陕西森弗天然制品有限公司),副溶血弧菌(中国微生物菌种保藏中心),总RNA提取试剂盒(上海飞捷生物技术有限公司),RNA反转录试剂盒(东洋纺生物科技有限公司),Gold View Ⅰ型核酸染色剂(北京索莱宝科技有限公司),2×Taq MasterMix(北京康为世纪生物科技有限公司),Bestar qPCR Mastermix(德国DBI公司),基因引物(华大基因公司)。
1.3 试验饲料的制备
根据肉食性鱼类的营养需求并参考相关虹鳟基础饲料配方[17],设计本试验虹鳟基础饲料的配方:膨化豆粕35%、鱼粉40%、糊化淀粉14.7%、鱼油4%、大豆油4%、氯化胆碱0.3%、磷酸二氢钙1%和预混料1%。先将20∶1的红枣、黄芪和山药提取物按照1∶1∶1比例配合成复合物,然后以质量分数分别为0.3%、0.6%和1.2%添加到基础饲料中制成复合中草药饲料,以复方中草药零添加的基础饲料为对照组。基础饲料及各添加剂组的饲料配方见表1。
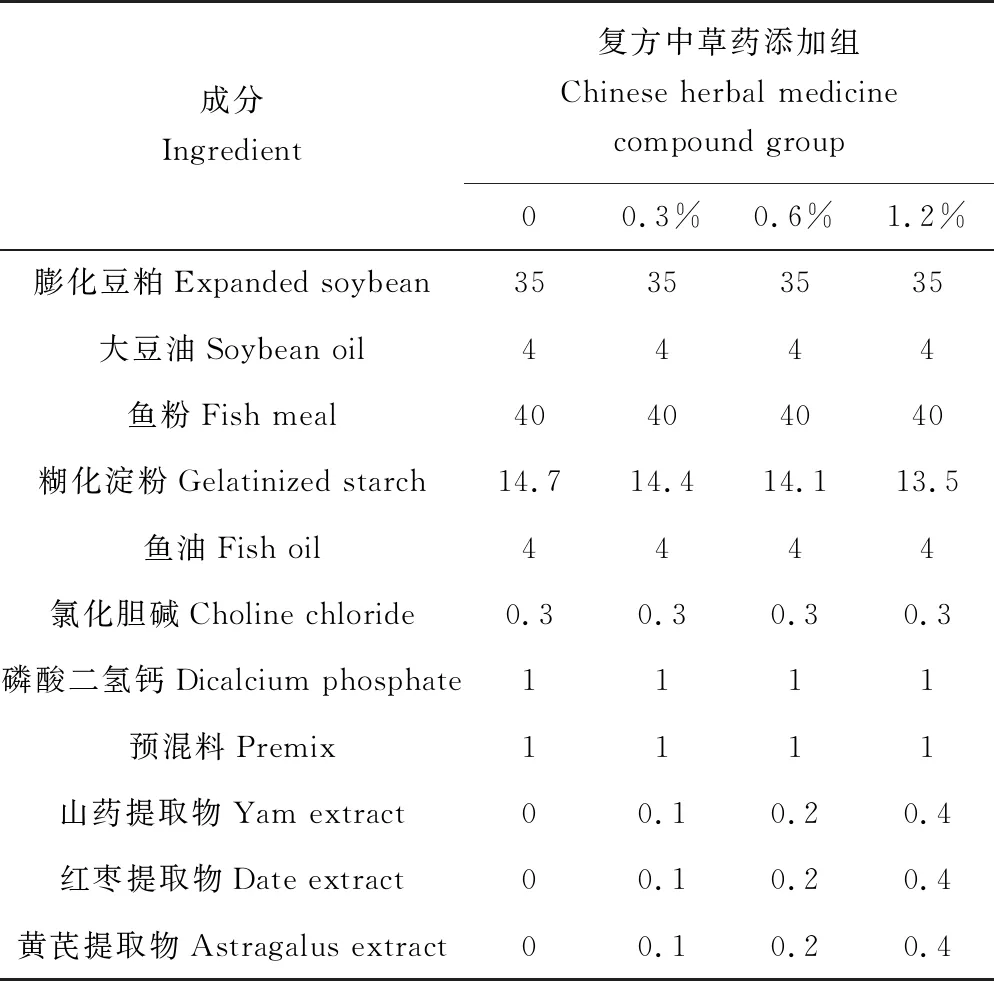
表1 虹鳟饲料配方 %
1.4 试验饲料的投喂
试验设计分为对照组和3个添加组,其中对照组投喂基础饲料组(即复合中草药提取物添加量为0),试验添加组分别投喂含复合中草药提取物0.3%、0.6%和1.2%的基础饲料。每组随机挑选暂养后的虹鳟幼鱼30尾进行投喂试验,其他条件同暂养期间。
1.5 细菌攻毒试验与取样
饲料投喂56 d后,随机选取各组的虹鳟幼鱼10尾,每尾注射0.2 mL副溶血弧菌(2.74×107cfu/mL)进行攻毒试验;弧菌攻毒4 d后,对虹鳟幼鱼进行解剖,每组取出6尾虹鳟幼鱼的中肠组织,然后迅速转移至冰箱中-80 ℃低温保存,用于后期抗氧化相关基因表达的检测。
1.6 抗氧化相关基因表达的检测
1.6.1 引物序列
内参基因EF-1 Alpha以及目的基因GST、HSP90BB、CAT、GPx1和SOD基因的引物序列来源于参考文献[18](表2)。

表2 PCR所用基因的特异性引物及其序列
1.6.2 RNA提取与反转录
按照总RNA极速抽提试剂盒提供的方法,提取每尾虹鳟幼体的中肠组织样品,并对RNA进行质量分析。对质量好、含量适宜和纯度高的RNA样本进行反转录反应。
1.6.3 半定量PCR
半定量PCR是对各目的基因在对照组和添加剂组的虹鳟中肠的表达量是否存在差异的定性分析。为鉴定引物特异性是否符合半定量试验的要求,在进行正式半定量反应之前,用普通PCR来分析引物的特异性。
将反转录得到的cDNA加入特异性良好的目的基因和内参基因的上下游引物、2×Tap MasterMix及无菌水制备成25 μL反应体系。PCR反应条件为:94 ℃ 2 min,94 ℃ 30 s,59 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 2 min。PCR扩增完成后进行琼脂糖凝胶电泳观察并保存各基因表达结果。
1.6.4 实时荧光定量PCR
为了验证半定量PCR的定性分析结果,并对各目的基因在对照组和添加剂组的虹鳟中肠中的表达量进行定量分析,进行实时荧光定量PCR试验。为鉴定引物特异性是否符合实时荧光定量试验的要求,在进行正式实时荧光定量反应之前,用实时荧光定量PCR仪来分析引物的特异性。
将反转录得到的cDNA加入特异性良好的目的基因和内参基因的上下游引物、Bestar qPCR Mastermix及无菌水制备成20 μL反应体系。PCR反应条件为:95 ℃ 2 min,95 ℃ 10 s,55 ℃ 30 s,72 ℃ 30 s,40个循环;熔解曲线95 ℃ 1 min,55 ℃ 1 min,55~98 ℃ 86个循环。
1.6.5 数据分析
使用 SPSS 13.0软件,对实时荧光定量PCR的结果进行单因素方差分析,并用LSD方法比较复方中草药添加剂组与对照组之间的差异显著性(P<0.05差异显著;P<0.01差异极显著)。
2 结果与分析
2.1 RNA质量和含量、内参基因及目的基因特异性和有效性的检测
提取的RNA 光密度(OD)值在1.8~2.0,通过凝胶电泳检测发现28S∶18S约为2∶1。RNA的质量浓度为168.61~551.06 ng/μL。试验结果表明,RNA的质量和质量浓度整体符合反转录的要求。
琼脂糖凝胶电泳分析结果表明,目的基因和内参基因引物电泳条带单一明亮,且不拖尾(图1)。实时荧光定量PCR对各基因的熔解曲线显示,熔解峰单一(图2)。试验结果表明,EF-1 Alpha、GST、HSP90BB、CAT、GPx1和SOD基因的引物特异性良好,符合半定量PCR和实时荧光定量PCR试验的要求。

图1 虹鳟肠中内参EF-1 Alpha及目的基因的琼脂糖凝胶电泳检测
图2 内参EF-1 Alpha及目的基因的熔解曲线检测
2.2 弧菌对添加中草药饲料后的虹鳟肠道抗氧化相关基因表达定性分析
半定量PCR结果见图3,通过分析添加各质量分数的复方中草药添加组的抗氧化基因(GST、HSP90BB、GPx1、CAT)和内参基因(EF-1 Alpha)的表达水平结果发现,GST与CAT基因的表达水平在0.3%和0.6%添加组有上调趋势;HSP90BB基因的表达水平在0.3%和1.2%添加组有上调趋势;GPx1基因的表达水平在0.3%添加组有上调趋势;SOD基因的表达水平在0.3%、0.6%和1.2%添加组均出现明显下调。

图3 不同添加组虹鳟肠道抗氧化基因的定性表达情况
2.3 弧菌对添加中草药饲料后抗氧化相关基因表达定量分析
与对照组相比,GST和CAT基因相对表达量在0.3%和0.6%添加组均出现显著上升趋势(图4),其中GST基因相对表达量分别上调30.5%和45.6%,CAT基因相对表达量分别上调302.10%和162.55%,而1.2%添加组与对照组相比差异不显著;HSP90BB基因相对表达量在0.3%和1.2%添加组出现显著上升趋势,分别上调214.74%和60.75%,而0.6%添加组与对照组相比无显著差异;GPx1基因相对表达量在0.3%添加组出现显著上升趋势,上调达107.55%,而0.6%和1.2%添加组与对照组相比差异不显著;SOD基因相对表达量在0.3%和0.6%添加组却出现显著下调趋势,分别下调47.7%和59.6%,1.2%添加组与对照组相比差异不显著。
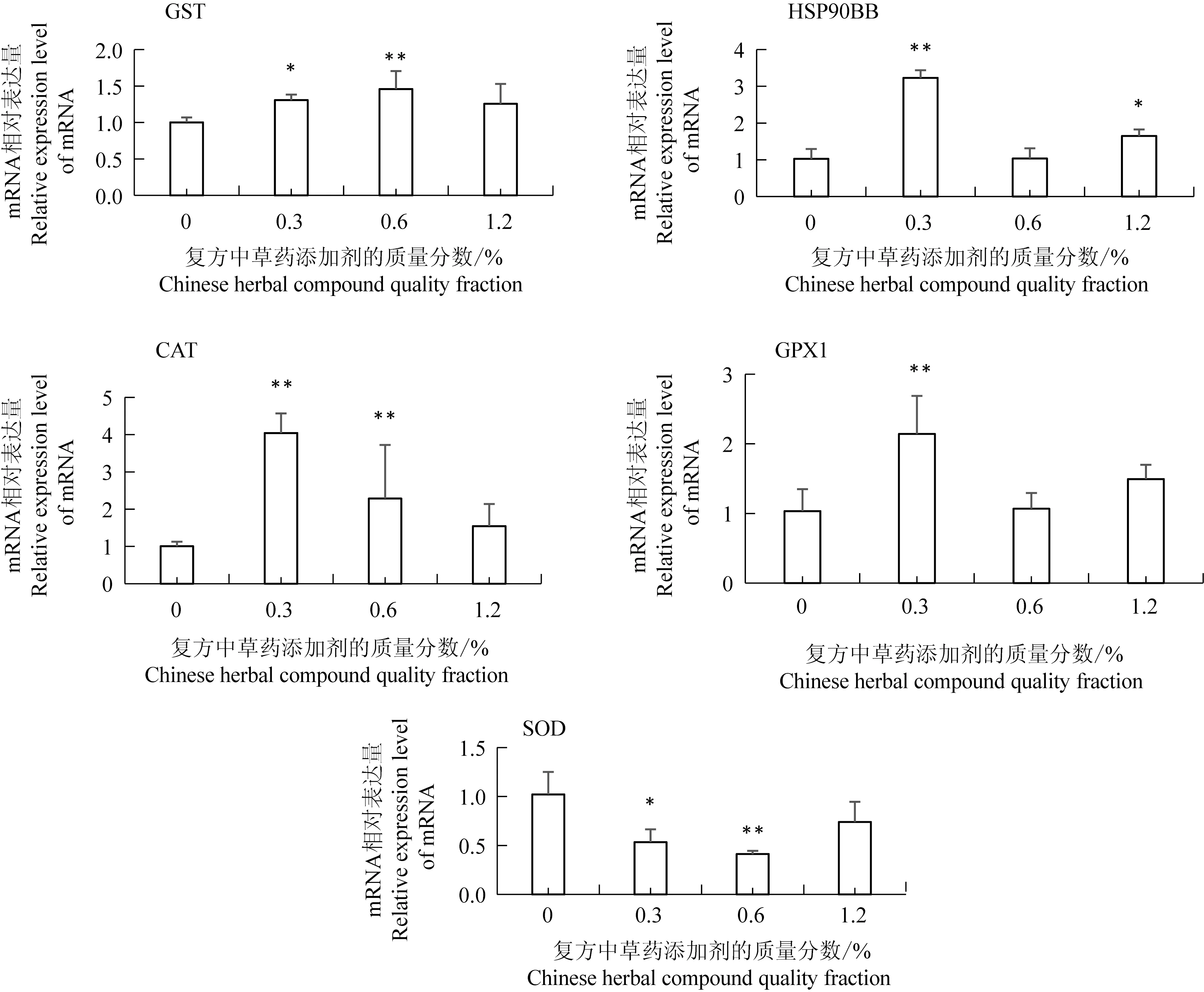
图4 不同质量分数添加剂组虹鳟中肠基因mRNA的表达
3 讨 论
动物体内抗氧化能力是机体非特异性免疫的重要组成部分,与多种疾病的发生密切相关[5]。抗氧化酶和热应激蛋白属于重要的非特异性免疫指标。基因表达水平一般是通过该基因转录的mRNA的多少来衡量的,编码应激相关蛋白和抗氧化酶基因的差异转录水平已被用于检测外来物质的生物学效应[19-20]。肠道是鱼类最大的免疫器官,中肠又称主肠,因此,笔者对投喂复方中草药添加剂(红枣提取物+山药提取物+黄芪提取物)的虹鳟在副溶血弧菌感染下的抗氧化基因mRNA影响进行探索。
3.1 复方中草药对虹鳟在副溶血弧菌感染下的抗氧化酶mRNA影响
活性氧是有机体内最常见的自由基,而机体抗氧化系统作为一种完整而复杂的自由基清除系统,能够保护自身免受氧化损伤[5,8]。SOD基因表达产物为超氧化物歧化酶,是机体清除自由基的重要抗氧化酶,能够催化超氧化物阴离子自由基并且歧化为过氧化氢与氧气,保护细胞免受氧自由基氧化损伤[5,8,11]。CAT基因表达产物为过氧化氢酶,该酶是动植物体内广泛存在的抗氧化酶,主要作用是将过氧化氢催化分解为水和氧气,使其转变为无毒性产物[8]。谷胱甘肽系统是生物体内的重要抗氧化系统,在机体非特异性免疫过程中发挥重要作用[21-22]。GPx基因表达产物为谷胱甘肽过氧化物酶,通过还原性谷胱甘肽催化还原过氧化物和有机过氧化物,从而保护细胞和其他如DNA、蛋白质及脂质体等敏感生物分子免受氧自由基损伤[5]。GPx1是GPx家族成员之一,能清除过氧化氢和脂肪酸过氧化氢[23]。谷胱甘肽-S-转移酶(GST基因表达产物)是生物体内重要的解毒酶,可以清除细胞内因宿主的免疫效应而产生的自由基和过氧化物等产物[24]。

3.2 复方中草药对虹鳟在副溶血弧菌感染下的热应激蛋白mRNA影响
HSPs基因表达产物是热应激蛋白,是一类在应激状态下帮助其他蛋白正确折叠的一类进化上高度保守的蛋白家族[29-30]。其中HSP90BB是HSPs家族的重要成员之一,可通过抑制氧自由基的关键酶产生来减少氧自由基的产生,尤其是在免疫反应时HSP90基因表达更为强烈[31]。本研究发现,与对照组相比,投喂添加复方中草药饲料的虹鳟幼体在感染副溶血弧菌4 d后,0.3%和1.2%添加组HSP90基因mRNA转录水平显著增加,进而可能致使HSP90蛋白水平提高。这表明,投喂0.3%和1.2%复方中草药的虹鳟幼体可能通过提高HSP90蛋白水平来抑制自由基的关键酶产生,进而减少氧自由基的产生,从而增强虹鳟抗氧化能力。这与林天势等[32]的研究病原菌感染大黄鱼(Larimichthyscrocea)后热应激蛋白表达水平的结果相一致。
4 结 论
投喂复方中草药饲料添加剂(红枣+山药+黄芪)后的虹鳟在受到副溶血弧菌感染时,CAT、GPx1、GST和HSP90BB的mRNA转录水平显著增加,从而可能致使抗氧化相关能力提高,其中0.3%添加组的效果较好。这一结果有助于复方中草药添加剂的饲料在虹鳟水产养殖生产中进行推广应用。
