鲟源嗜麦芽窄食单胞菌的分离鉴定及药敏特性分析
2020-09-23商宝娣李小义李正友张效平
商宝娣,陶 莎,杨 星,李小义,李正友,张效平,孔 杰
( 1.贵州省农业科学院 水产研究所,贵州 贵阳 550025; 2.贵州省特种水产工程技术中心,贵州 贵阳 550025; 3.贵州大学,贵州 贵阳 550025 )
鲟形目鱼类是现存世界上最古老的鱼类之一,具有“活化石”之称。鲟鱼因其肉质鲜美、营养丰富,具有较高的食用价值,同时也具有一定的药用价值。特别是用其卵加工而成的鱼子酱,更是驰名中外的高档食品,素有“黑色黄金”之称。因鲟具有易驯养、生长快及个体大等特点,自1992年我国第一个鲟规模化养殖场成立以来,经过20多年的发展,我国成为世界第一大鲟鱼养殖国。贵州省地处云贵高原,冷水资源非常丰富,包括地下溶洞水、溪流水、水库底层水等,适宜开展鲟鱼等冷水性鱼类的养殖。自1999年贵州省水产研究所引进鲟鱼进行养殖后,经过20年的发展,目前贵州省各个地州市都将鲟鱼养殖作为重点工作来推广,养殖规模和产量不断提高,经济效益和社会效益十分显著[1]。其中杂交鲟[达氏鳇(Husodauricus)♀×史氏鲟(Acipenserschrenckii)♂]是贵州省最重要的冷水鱼养殖种类。
在鲟鱼养殖产业规模化、设施化不断提高的同时,鲟鱼病害的暴发也越来越频繁和严重,造成重大经济损失,严重影响了鲟鱼养殖业的健康可持续发展。细菌病则是其中最重要的病害。目前已经报道的鲟致病菌主要有恶臭假单胞菌(Pseudomonasputida)[2]、嗜水气单胞菌(Aeromonashydrophila)[3]、维氏气单胞菌(A.veronii)[4]、类志贺邻单胞菌(Plesimonasshigelloides)[5]、海豚链球菌(Streptococcusiniae)[6,7]、产碱假单胞菌(P.alcaligenes)[8]、鲁氏耶尔森菌(Yersiniaruckeri)[9-10]、弗氏柠檬酸杆菌(Citrobacterfreundii)[11]、琼氏不动杆菌(Acinetobacterjunii)[12]、分枝杆菌(Mycobacterium)[13]、迟钝爱德华菌(Edwardsiellatarda)[14]等。在贵州地区,因疾病造成的鲟鱼死亡事件也越来越多,解决这一问题的关键是对造成死亡的疾病进行有效鉴定及提出有效防控手段[15]。
2017年9—10月,在贵州省绥阳县某养殖场养殖的杂交鲟陆续出现死亡,持续时间长达1月余,发病死亡鱼体质量为0.5~2.0 kg,发病水温为22~25 ℃,累计死亡约20%。笔者选取发病杂交鲟的肝脏进行病原菌分离,通过培养获得1株优势细菌,对优势菌进行人工回归感染来验证这株菌的致病性,结合细菌的形态特征、生理生化特征、16S rDNA序列及gyrB序列等数据对菌种类型进行准确鉴定,并通过K-B法测试了其对常用抗生素的敏感性,为生产实践中此病的有效防治提供科学指导和理论支撑。
1 材料与方法
1.1 材料
具有典型症状的杂交鲟取自贵州省绥阳县某养殖场,体质量(1.2±0.6) kg,用于病原菌分离。人工回归感染试验所用杂交鲟购于贵州省水产研究所惠水试验基地,规格统一、体型体色正常、活力较好,平均体质量(1.5±0.2) kg,试验前22 ℃水温暂养7 d。
主要试剂:普通营养琼脂、普通营养肉汤、水解酪蛋白琼脂、革兰氏染色液、细菌微量生化鉴定管及药敏试纸(杭州微生物试剂有限公司);DNA聚合酶、细菌DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒[宝生物工程(大连)有限公司];PCR所用特异性引物由生工生物工程(上海)股份有限公司合成。
主要仪器:正置显微镜、凝胶成像系统、核酸蛋白检测仪、PCR基因扩增仪、生化培养箱、全自动高压灭菌锅、电子天平等。
1.2 现场诊断
及时走访现场调研,了解病害发生情况;现场观察病鱼的体型体色、摄食情况、行为特点等。选择具有典型特征的濒死杂交鲟进行现场检查,按照先体表后体内的顺序,先检查病鱼头部、鳃、鳍条、体表等部位,记录破损、出血、溃疡等病变情况及有无寄生虫等寄生,观察腹部肿大及肛门红肿情况;解剖后观察肌肉、肝、肾、胆囊、鳔、肠等组织器官的病变反应。
1.3 实验室诊断
1.3.1 病原菌分离
取濒死并具有典型症状的病鱼,超净工作台中取肝组织划线于胰蛋白胨大豆琼脂(TSA)培养基上,置于28 ℃恒温培养箱中培养。培养24 h后挑取平板上形态、规格及颜色等特征基本一致的菌落再次划线于胰蛋白胨大豆琼脂培养基进行纯化培养,此次共分离获得纯培养菌株1株,编号为SXG-1。将SXG-1菌株于胰蛋白胨大豆肉汤(TSB)培养基中28 ℃培养24 h后,与50%甘油混合均匀,于超低温冰箱-80 ℃保存待用。
1.3.2 人工回归感染试验
将分离株SXG-1接种于胰蛋白胨大豆肉汤培养基,置于28 ℃条件下恒温培养24 h,按照试验要求参照麦氏比浊法将菌悬液密度分别调整为5.0×1010、5.0×109、5.0×108、5.0×107、5.0×106cfu/mL。取暂养7 d的感染用杂交鲟,分为5个试验组及1个对照组,每组设置3个平行,每个平行放置10尾杂交鲟。采用腹腔注射法对健康杂交鲟进行人工感染,试验组每尾杂交鲟注射SXG-1菌悬液0.2 mL,对照组注射同等量灭菌磷酸缓冲盐溶液。试验期间保持充足溶解氧及22 ℃恒定水温。自注射后每24 h观察一次,记录杂交鲟的行为状况和死亡数量。对刚死亡及濒临死亡的病鱼进行解剖,观察病变情况,同时进行细菌再分离鉴定。人工感染试验周期为10 d。通过SPSS 21.0计算半数致死密度(LC50)。
1.3.3 形态学观察及生理生化鉴定
将SXG-1菌株接种于胰蛋白胨大豆琼脂培养基平板,28 ℃恒温培养24 h,观察菌落形态、规格、颜色等特征。将菌株进行革兰氏染色,观察菌落特征。
利用细菌微量生化鉴定管参照《常见细菌系统鉴定手册》[16]中的方法,对菌株SXG-1的各项生化指标进行测定。
1.3.4 16S rDNA、gyrB基因序列分析及系统发育树构建
将SXG-1菌株接种于胰蛋白胨大豆肉汤培养基,28 ℃恒温培养24 h后收集菌体。利用细菌DNA提取试剂盒提取病原菌DNA。以提取的病原菌DNA为模板,分别使用细菌16S rDNA通用引物27F(5′-AGAGTTTGATCCTGGCTCA-3′)和1492R(5′-GGCTACCTTGTTACGACTT-3′)、gyrB通用引物3F(5′-TCGGGCGGCCTGCACGGCGTCGGCGTCAG-3′)和14R(5′-TTGTCCGGGTTGTACT-CGTC-3′)进行PCR扩增。利用琼脂糖凝胶DNA回收试剂盒回收纯化DNA扩增产物,将回收后的片段克隆到PMD18-T载体上(Takara),转化大肠杆菌(Escherichiacoli)DH5α感受态细胞,挑取阳性克隆提取质粒后由生工生物工程(上海)有限公司进行测序。
将测序获得的基因序列在GenBank数据库中进行Blast比对分析,从中选取同源性较高的菌株序列采用Clustal X 1.83软件进行多重比对分析,通过MEGA 4 软件中的邻位相连法构建系统发育树,1000次Bootstrap检验各分支的置信度。
1.3.5 药物敏感试验
采取纸片扩散法(K-B法)对45种抗生素的敏感性进行测定。将菌株SXG-1的菌液密度调整为5.0×106cfu/mL,并取150 μL均匀涂布于MH琼脂平板,然后将45种抗生素药敏纸片分别贴于MH琼脂平板上,每个平板贴5片。28 ℃恒温培养24 h后,分别测量各种抗生素抑菌圈直径大小(mm),根据杭州微生物试剂有限公司药敏纸片抑菌圈标准判定致病菌株对药物的敏感程度。
2 结 果
2.1 患病杂交鲟临床表现及宏观病理变化
病鱼行动迟缓,体色发黑,摄食下降甚至不摄食,腹部有出血点,鳍条出血,肛门红肿;解剖后发现有少量腹水,肝脏充血出血,质地不易碎;肠道内有少量食物,充血,内有透明液体;肾脏颜色变浅。发病持续时间为1月余,累计死亡率达20%。
2.2 人工回归感染试验
人工回归感染试验累积死亡率结果见图1。结果表明,杂交鲟在注射5.0×1010、5.0×109、5.0×108cfu/mL菌悬液均在感染第2 d开始出现死亡,接下来的4 d杂交鲟死亡数量较多;5.0×107、5.0×106cfu/mL 2个试验组均是在第4 d开始出现死亡;5个试验组的累计死亡率均随着攻毒时间的延长而增加。由表1可见,注射菌液密度达到5.0×108cfu/mL时,累积死亡率为50.0%,当密度为5.0×1010cfu/mL时,杂交鲟在第7 d的死亡率已达到100%。对照组杂交鲟在试验期间未出现死亡。经SPSS 21.0软件计算,菌株SXG-1的半数致死密度为3.9×108cfu/mL。

表1 菌株SXG-1的人工感染试验结果

图1 SXG-1人工感染杂交鲟的累积死亡率与感染时间关系曲线
人工感染菌株SXG-1后,濒死杂交鲟的主要症状与自然发病症状基本一致。从人工感染发病的杂交鲟中分离到的菌株与SXG-1特征一致,综上,菌株SXG-1为此次患病杂交鲟的致病菌。
2.3 病原菌形态及生理生化特征
菌株SXG-1在胰蛋白胨大豆琼脂培养基上28 ℃培养24 h,形成圆形、淡黄色、半透明菌落,菌落表面湿润,中央隆起,边缘整齐;在绵羊血平板培养基上不溶血,产淡绿色色素。经革兰氏染色,1000倍油镜下镜检,结果显示,菌株SXG-1为革兰氏阴性菌,短杆棒状,两端钝圆。
菌株SXG-1的主要生理生化特征为O/F试验为氧化产酸,克氏双糖铁反应同非发酵菌,氧化酶阴性,泰能耐药,动力阳性(取蛋白胨水观察),七叶苷、DNA酶、赖氨酸脱羧酶、液化明胶阳性(表2)。根据该菌的形态学特征和生理生化特性初步鉴定为嗜麦芽窄食单胞菌(Stenotrophomonasmaltophilia),但由于其在糖的利用上与嗜麦芽窄食单胞菌模式株存在差异(表2),故结合16S rDNA和gyrB持家基因序列分析进行准确鉴定。

表2 SXG-1的生理生化特征
2.4 16S rDNA、gyrB基因序列测定及系统发育树构建
测序获得的菌株SXG-1 16S rDNA基因序列全长1506 bp(登录号:MN709089),在GenBank 中进行Blast同源性比对,结果显示,所测序列与嗜麦芽窄食单胞菌MTCC 434T(登录号:JALV01000036) 16S rDNA核苷酸序列同源性最高,为99.66%;与StenotrophomonaspavaniiDSM 25135T (登录号:LDJN01000038)和PseudomonasgeniculataATCC 19374T (登录号:AB021404)16S rDNA核苷酸序列同源性分别为99.59%和99.44%。选择20个同源性较高的细菌16S rDNA序列构建系统发育树(图2),结果显示,菌株SXG-1与嗜麦芽窄食单胞菌聚为一个分支。

图2 SXG-1基于16S rDNA基因序列构建的系统进化树
测序获得的菌株SXG-1 gyrB基因序列全长1130 bp(登录号:MN709090),在GenBank 中进行Blast同源性比对,结果显示,所测序列与嗜麦芽窄食单胞菌ISMMS2(登录号:CP011305.1),嗜麦芽窄食单胞菌ISMMS2R(登录号:CP011306.1)gyrB基因核苷酸序列同源性最高,为99.82%。挑选相似度90%以上的多个不同菌株基因序列构建系统发育树(图3),结果显示,菌株SXG-1与嗜麦芽窄食单胞菌聚为一个分支。因此,综合常规生理生化和16S rDNA、gyrB基因序列分析结果表明,菌株SXG-1为嗜麦芽窄食单胞菌。

图3 SXG-1基于gyrB基因序列构建的系统进化树
2.5 药敏试验
通过K-B法对45种供试抗生素药物敏感性进行了研究,结果表明,嗜麦芽窄食单胞菌SXG-1对氧氟沙星、恩诺沙星、氟苯尼考、环丙沙星4种药物敏感,对阿奇霉素、四环素、多西环素、多黏菌素B、氯霉素5种药物中度敏感,对其他36种药物耐药(表3)。
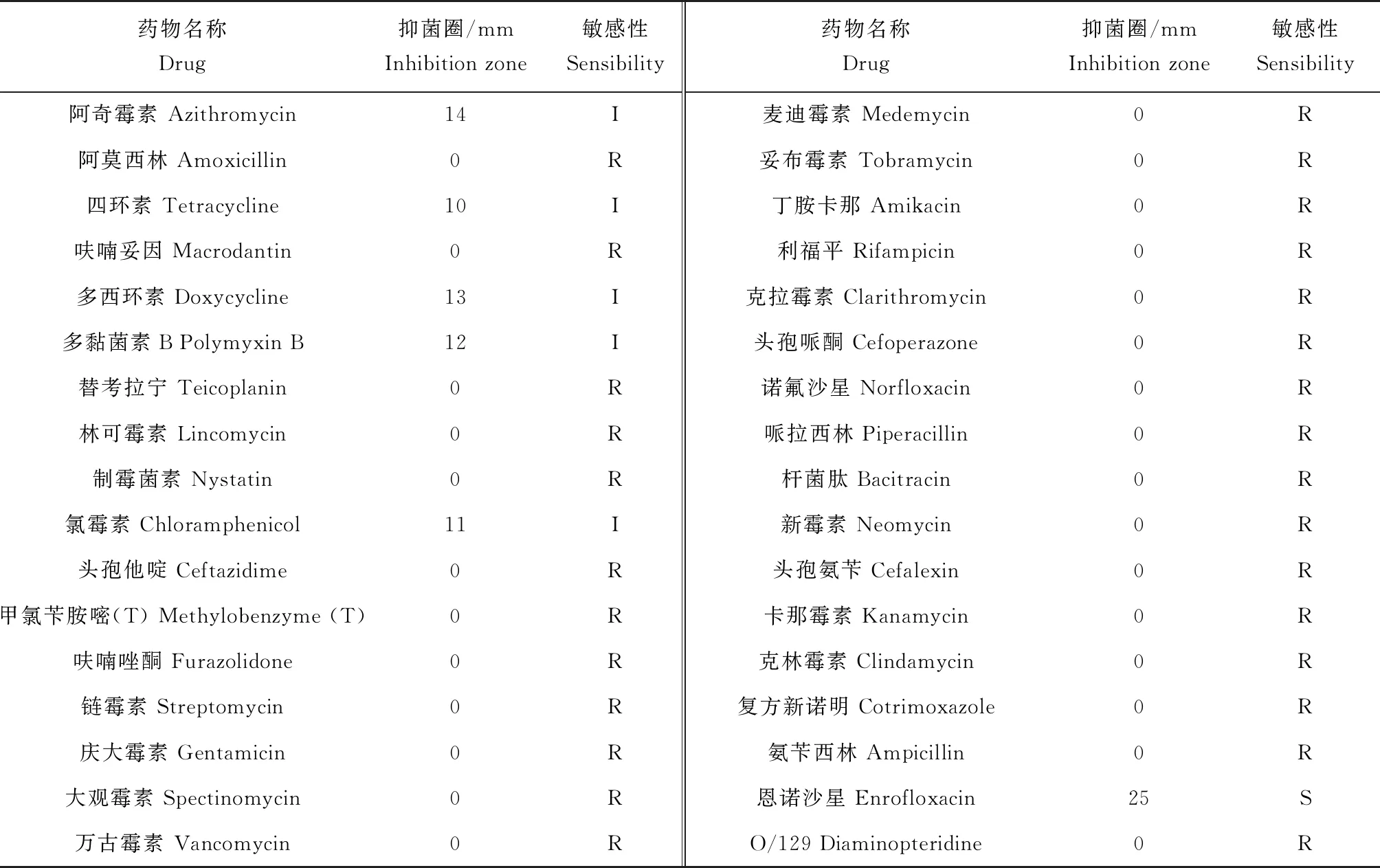
表3 嗜麦芽窄食单胞菌SXG-1的药敏试验结果
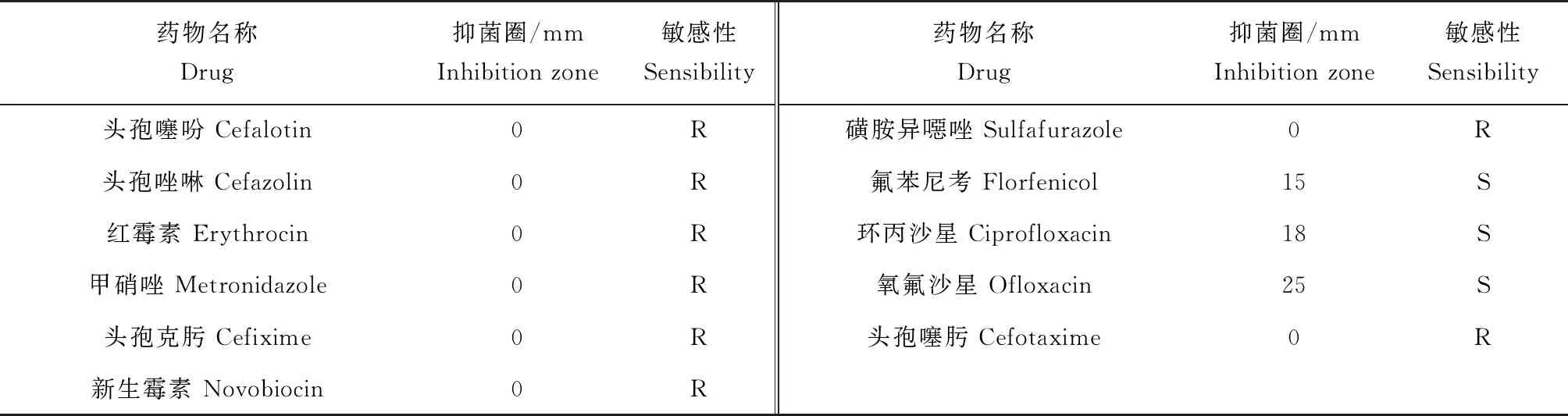
(续表3)
3 讨 论
3.1 嗜麦芽窄食单胞菌的分离鉴定
1943年首次从人类胸腔积液中分离获得该菌,命名为布鲁克杆菌(Bacteriumbookeri);1961年该菌重新被命名为嗜麦芽假单胞菌(Pseudomonasmaltophilia);1983年更名为嗜麦芽黄单胞菌(Xanthomonasmaltophilia);1993年改为现名,即嗜麦芽窄食单胞菌[13]。
嗜麦芽窄食单胞菌广泛存在于土壤、水、植物、动物和食物等自然界中,在医院环境中也普遍存在,是一种人类重要的条件致病菌和医院感染的重要病原菌,可引起人类的呼吸道感染、败血症、肺炎、结膜炎、脑炎等,在人类医学上已引起高度重视[18]。除了对人类具有致病作用以外,还对山羊[19]和猪[20]等陆生哺乳动物具有致病性。鱼类等水生动物也是其重要的天然贮存宿主,国内外学者相继自锦鲤(Cyprinuscarpiokoi)[21]、大黄鱼(Pseudosciaenacrocea)[22]、异育银鲫(Carassiusauratusgibelio)[23]、大口黑鲈(Micropterussalmoides)[24]等宿主体内分离到该菌,同时也有报道指出该菌也对卵形鲳鲹(Trachinotusovatus)[25]、黄缘闭壳龟(Cistoclemmysflavomarginata)[26]、中华绒螯蟹(Eriocheirsinensis)[27]、斑点叉尾(Ictalunespunctatus)[28]、黄喉拟水龟(Mauremysmutica)[29]和齐尔白鲑(Coregonusnasus)[30]等水产养殖动物造成严重经济损失。本试验首次自患病杂交鲟体内分离到致病菌株SXG-1,通过革兰氏染色、细菌微量生化鉴定管等对细菌的形态学、生理生化特性进行了研究,结果表明,菌株SXG-1的特征与单胞菌属一致;16S rDNA基因序列进化树分析结果表明,虽然该菌与嗜麦芽寡养单胞菌聚为一支,但与S.pavaniiDSM 25135T和P.geniculataATCC 19374T 16S rDNA核苷酸序列同源性也很高。促旋酶B亚单位基因(gyrB基因)全长约1.2~1.4 kb,以单拷贝形式普遍存在于细菌基因组上,其进化率和变异率均高于16S rDNA[31]。目前gyrB基因在菌种鉴定及系统进化分析方面得到了广泛应用。结合16S rDNA序列、gyrB序列及系统发育树分析,准确确定分离病原菌为嗜麦芽窄食单胞菌。
此次感染嗜麦芽窄食单胞菌未造成杂交鲟暴发性大规模死亡,发病症状与死亡情况与感染齐尔白鲑[30]症状相似,与感染卵形鲳鲹[25]和斑点叉尾[28]引起的急性流行性大规模死亡不同。杂交鲟和齐尔白鲑都属于冷水性鱼类,是否为嗜麦芽窄食单胞菌引起的冷水性鱼类发病出现相同症状有待进一步证实。嗜麦芽窄食单胞菌作为致病菌感染杂交鲟在国内尚属首次报道,表明嗜麦芽寡养单胞菌的感染范围在扩大,其危害性进一步增强,需引起冷水鱼养殖产业的重视。
3.2 药物敏感试验
在水产养殖中,抗生素的使用仍是防控细菌病最常用、最有效的方法。嗜麦芽窄食单胞菌是一种具有多重耐药性的细菌,耐药机制复杂,目前已知对β-内酰胺类、头孢菌素、大环内酯类、氨基糖苷类和碳青霉烯类具有很强的耐药性[32]。本试验测定了嗜麦芽窄食单胞菌SXG-1对45种抗生素药物的敏感性,结果表明,该菌具有很强的耐药性,仅对氧氟沙星、恩诺沙星、氟苯尼考、环丙沙星4种药物敏感,对阿莫西林、哌拉西林、克拉霉素、妥布霉素、庆大霉素等36种药物耐药。本次药敏结果与周永灿等[25]的试验结果有些不同,可能是由于地域、环境和宿主不同等因素引起,也可能是由于分离株不同的药物接触史或耐药基因间的传播造成的,菌株间耐药性的差异给细菌病的治疗带来极大困难。而在4种敏感药物中,只有恩诺沙星和氟苯尼考可用于水产养殖病害防控中,具体的有效含量、使用方式等还需要进一步研究。本次试验结果对于指导该病的药物防控具有重要意义。
4 结 论
本研究通过形态学、生理生化特性测定与分子生物学相结合的方法,首次从患病杂交鲟体内分离到致病菌株嗜麦芽寡养单胞菌SXG-1。通过药物敏感试验,初步筛选出恩诺沙星和氟苯尼考可用于鲟鱼此病的防控。
