Galectin-1与胃癌细胞阿帕替尼敏感性的关系及调控机制研究
2020-09-22冷娇刘雪梅张匠毛英刘黎
冷娇,刘雪梅,张匠,毛英,刘黎
(遂宁市中心医院 肿瘤科,四川 遂宁 629000)
随着精准医学的发展,越来越多的生物学分子被发现并用于临床恶性肿瘤的诊断和治疗。甲磺酸阿帕替尼(Apatinib)是一种高度特异性靶向抑制血管的内皮生长因子受体2(vascular endothelial growth factor receptor 2, VEGFR-2)酪氨酸激酶活性的小分子抗血管生成剂[1]。LIN 等[2]学者证实,阿帕替尼可靶向抑制血管内皮生长因子(vascular endothelial growth factor, VEGF)/VEGFR-2 信号通路,从而抑制胃癌细胞的增殖,并促使其凋亡。虽然阿帕替尼在临床上有理想的应用前景,但是目前仍然缺乏预测或筛选优势人群的生物标志物。半乳糖凝集素1(Galectin-1)是最早发现的Gal 家族成员,在胃癌[3]、乳腺癌[4]、甲状腺癌[5]等肿瘤相关成纤维细胞(CAFs)中呈异常高表达,并且可能与上皮间质转化有关。SANO 等[6]学者也发现,Galectin-1 可以通过识别β-半乳糖苷而与内皮细胞表面VEGFR-2 结合,进而不依赖于VEGF 的作用激活下游信号通路,影响抗VEGF/VEGFR-2 药物治疗的敏感性。因此本研究拟通过制备Galectin-1 低表达SGC7901 胃癌细胞模型,分析其对上皮间质转化分子机制和阿帕替尼敏感性的影响,现报道如下。
1 材料与方法
1.1 材料
1.1.1 细胞人胃癌细胞株SGC-7901 购自上海复旦IBS 细胞资源中心(FuDan IBS Cell Center, FDCC),37℃恒温水浴迅速融化,1 000 r/min 离心3 min,弃上清,加入1 ml RPMI 1640 培养液重悬,转移至细胞培养瓶。使用含10%特级胎牛血清、100 u/ml 青-链双抗的RPMI 1640 完全培养基进行培养,设置条件: 37℃、稳定5%二氧化碳,95%相对饱和湿度。
1.1.2 主要试剂和仪器甲磺酸阿帕替尼购自江苏恒瑞医药股份有限公司,使用前用生理盐水倍比稀释至实验浓度。RPMI 1640 细胞培养基、特级胎牛血清、青-链双抗购自美国Gibco 公司,甲基噻唑基四唑(MTT)、嘌呤霉素、Trizol 试剂、聚凝胺(Polybrene)购自美国Sigma 公司,SuperScript First-Strand Synthesis System 试剂盒购自美国Invitrogen 公司;实时荧光定量聚合酶链反应(qRT-PCR)试剂盒购自美国Applied Biosystems 公司,鼠抗人上皮型E-cadherin 抗体、鼠抗人Twsit1 抗体、兔抗人Vimentin 抗体、兔抗人Snail 抗体和兔抗人ZEB 抗体购自美国Santa Cruz 公司。委托上海吉玛公司设计2条干扰Galectin-1 siRNA 序列,1 号正向引物: 5'-AT CGGGATCCGGGCCTTGGAACTGATGAAtt-3',反向引物: 5'-GACTCTATCGGAATTCTTCATCAGGCCCtt-3',长度435 ~452 bp;2 号正向引物: 5'-ATCGGGAT CCGGCCATAATGGTTAAGGTtt-3',反向引物: 5'-GA CTCTATCGGAATTCACCTTTATATGGCTCtt-3', 长度375~391 bp。阴性无序序列正向引物: 5'-GGAC TCTTCAGTTTGTAGTAGGGGCAACtt-3',反向引物: 5'-TGGGAGGTCTTCGAGTTCGGACTGCCCCtt-3', 长度322 ~363 bp。IX73 荧光倒置显微镜购自日本奥林巴斯光学公司,T100 PCR 仪购自美国Bio-Rad 公司,通用基础电泳仪购自美国Bio-Rad 公司。
1.2 细胞转染及分组
构建pSiren 包裹的Galectin-1 干扰pSiren-shRNA逆转录病毒载体。取对数期生长的SGC-7901 细胞接种在6 孔板中,分为空白对照组(正常培养,不做任何特殊处理)、阴性siRNA 组(转染阴性无序序列)、Gal1-siRNA1 组(转 染Gal1-siRNA1 序 列)、Gal1-siRNA2 组(转染Gal1-siRNA2 序列),加入Polybrene转染试剂,同时加入适量pSiren-shRNA 逆转录病毒载体悬液,继续培养24 h 后,更换新鲜培养液,置于荧光倒置显微镜下观察荧光染色,以判断感染率。瞬时转染成功后用1μg/ml 嘌呤霉素筛选2 ~3 周,将耐嘌呤霉素的稳转细胞用于后续实验。采用qRTPCR 和Western blotting 验证细胞转染效果。筛选有效干扰Galectin-1 表达的siRNA 序列进行后续研究。
1.3 MTT 法
取SGC-7901 细胞按1×103个/孔单层接种至96 孔板中,每组设置8 个平行孔,每孔加入100μl 梯度浓度增加的阿帕替尼,浓度设置分别为5、25、125和625μmol/L,培养48 h 后,检测吸光度(Absorbance,A)值。MTT 检测方法: 每孔加入20μl MTT 试剂,静置4 h 后轻轻丢弃上清,加入200 ml 二甲基亚砜溶解结晶紫,用酶标仪检测吸收波长490 nm 处的A 值。计算细胞增殖抑制率: 增殖抑制率(%)=1-A受试组/A对照组×100%。
1.4 细胞增殖活力测定
细胞接种方法同1.3,加入20μmol/L 阿帕替尼,继续培养48 h,MTT 检测方法参照1.3。
1.5 Annexin V/PI 双染法
收集25μmol/L 阿帕替尼作用48 h 后的细胞,用PBS 和无血清RPMI 1640 培养液反复洗涤后,加入1×Binding Buffer 重悬,调整细胞浓度约1×106个/ml,加入5μl Annexin V-FITC 和5μl PI,用300 目筛网过滤,上机检测细胞凋亡情况。
1.6 DAPI 染色
取SGC-7901 细胞按1×105个/孔单层接种至12 孔板中,加入25μmol/L 阿帕替尼作用48 h,弃上清,加入4%多聚甲醛固定,每孔加入5 ml DAPI 染色液,避光孵育5 min,荧光显微镜下拍照计数。
1.7 RNA 提取和qRT-PCR
加入Trizol 试剂提取细胞总RNA。采用Nanodrop 2000 核酸测定仪检测RNA 浓度和纯度,用SuperScript First-Strand Synthesis System 试剂盒逆转录生成cDNA,逆转录反应条件: 42.0℃、60 min,70.0℃、5 min,40.0℃、2 min。取2μg cDNA 模板、正反向引物各1μl、2×Taq Master Mix 12.5μl,加入适量去离子水,配制25μl PCR 反应体系,按照SYBR DDPeen PCR master Mix 说明书进行qRT-PCR。PCR 反应条件: 95℃预变性2 min,95℃变性30 s,60℃(Galectin-1 mRNA)或54.5℃(GAPDH mRNA)退火30 s,72℃延伸25 s,共计40 个循环,72℃继续延伸10 min。Galectin-1 mRNA 正向引物: 5’-GTATTCGCACTGGATACGACC GACCG-3’,反向引物: 5’-TGCTTTGCTCATGACATG TCTACAGCCCA-3’,引物长度100 bp;GAPDH 正向引 物: 5’-CAGCAATTACCAACGAATGCCGA-3’;反向引物: 5’-GATCTGCGTACCCACACCATGGA-3’,引物长度182 bp。从软件中读取到达阈值的循环数Ct值。以2-ΔΔCt表示目的基因mRNA 相对表达量。
1.8 Western blotting
加入RIPA 和PMSF 混合细胞裂解液,提取总蛋白,采用BCA 试剂盒检测蛋白浓度。将蛋白样品与上样Marker 混合煮沸,进行SDS-PAGE 凝胶电泳。将蛋白条带湿转至PVDF 膜上;5%脱脂奶粉封闭60 min,加入E-cadherin 抗体(1 ∶100 稀释)、Twsit1 抗体(1 ∶100 稀释)、Vimentin 抗体(1 ∶50稀释)、Snail 抗体(1 ∶200 稀释)和ZEB 抗体(1 ∶200稀释)孵育,二抗孵育1 h。采用ECL 化学发光试剂显影,FluorChem FC3 分析系统对蛋白条带进行定量分析。
1.9 统计学方法
数据分析采用SPSS 17.0 统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量的方差分析,进一步两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 细胞转染效果
经慢病毒转染后,SGC-7901 细胞出现GFP 绿色荧光则表示转染成功。当病毒滴度为1×108PFU/ml时,细胞转染效率为77.34%。空白对照组、阴性siRNA 组、Gal1-siRNA1 组、Gal1-siRNA2 组SGC-7901 细胞Galectin-1 mRNA 相对表达量分别为(1.00±0.05)、(0.97±0.10)、(0.30±0.07)和(0.85±0.10),经方差分析,差异有统计学意义(F=110.281,P=0.000)。空白对照组、阴性siRNA 组、Gal1-siRNA1 组、Gal1-siRNA2 组Cal-1 蛋白相对表达量分别为(0.68±0.12)、(0.63±0.10)、(0.21±0.07)和(0.56±0.08),经方差分析,差异有统计学意义(F=44.744,P=0.000)。Gal1-siRNA1 组和Gal1-siRNA2 组SGC-7901 细胞Galectin-1 mRNA 和蛋白相对表达量低于空白对照组和阴性siRNA 组(P<0.05),其中Gal1-siRNA1 组细胞相对表达量最低(P<0.05),用于后续实验。见图1~5。
图1 白光和荧光视野下SGC-7901 细胞状态 (×100)

图2 SGC-7901 细胞转染效率
2.2 药物敏感性
同一药物浓度前提下,空白对照组、阴性siRNA组和Gal1-siRNA1 组细胞增殖抑制率比较,经方差分析,差异有统计学意义(P<0.05),Gal1-siRNA1 组同一药物浓度下各细胞增殖抑制率均高于空白对照组和阴性siRNA 组(P<0.05)。见表1。

图3 各组SGC-7901 细胞Galectin-1 mRNA 和蛋白相对表达量比较 (±s)

图4 qRT-PCR 扩增曲线和熔解曲线
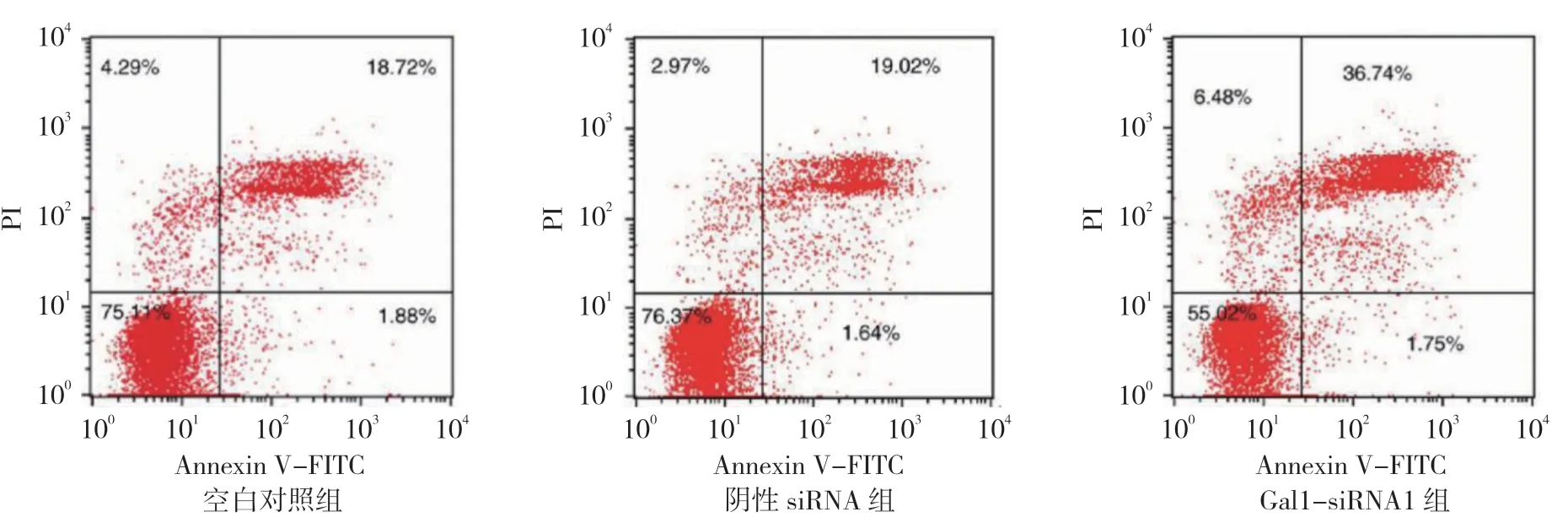
图5 流式细胞图
表1 各组不同药物浓度下细胞增殖抑制率比较 (%,±s)

表1 各组不同药物浓度下细胞增殖抑制率比较 (%,±s)
注: †与Gal1-siRNA1 组比较,P <0.05。
组别 5μmol/L 25μmol/L 125μmol/L 625μmol/L空白对照组 10.48±2.11† 17.64±3.28† 48.32±3.43† 69.87±3.81†阴性siRNA 组 11.25±2.23† 18.10±3.72† 50.24±3.29† 70.58±3.76†Gal1-siRNA1 组 14.77±2.19 27.56±3.25 73.84±3.56 78.91±4.10 F 值 8.828 21.398 137.472 13.338 P 值 0.002 0.000 0.000 0.000
空白对照组、阴性siRNA 组和Gal1-siRNA1 组细胞经25μmol/L 阿帕替尼处理24、48、72 和96 h的增殖活性比较,采用重复测量设计的方差分析,结果: ①不同时间点A490nm值有差别(F=181.746,P=0.000);②3 组细胞A490nm值有差别(F=220.835,P=0.000),与空白对照组和阴性siRNA 组相比,Gal1-siRNA1 组细胞A490nm值较低,增殖抑制活性较好;③3 组细胞A490nm值变化趋势有差别(F=7.158,P=0.000)。见表2。
表2 各组不同时间点细胞A490nm 值比较 (±s)

表2 各组不同时间点细胞A490nm 值比较 (±s)
注: †与Gal1-siRNA1 组比较,P <0.05。
组别 24 h 48 h 72 h 96 h空白对照组 0.25±0.04† 0.41±0.04† 0.63±0.07† 0.87±0.09†阴性siRNA 组 0.25±0.03† 0.42±0.05† 0.64±0.08† 0.89±0.10†Gal1-siRNA1 组 0.20±0.03 0.36±0.04 0.52±0.07 0.65±0.07
2.3 细胞凋亡活性
加入25μmol/L 阿帕替尼处理48 h 后,经Annexin V/PI 双染法,空白对照组、阴性siRNA 组、Gal1-siRNA1 组细胞凋亡率分别为(18.97±2.96)%、(19.36±3.25)%和(36.48±3.10)%,经方差分析,差异有统计学意义(F=82.926,P=0.000),Gal1-siRNA1 组细胞凋亡率高于其他组(P<0.05)(见图5)。经DAPI 染色,空白对照组、阴性siRNA 组、Gal1-siRNA1 组细胞凋亡率分别为(22.34±5.57)%、(23.85±6.46)%和(40.16±6.55)%,经方差分析,差异有统计学意义(F=7.598,P=0.023),Gal1-siRNA1 组细胞凋亡率高于空白对照组、阴性siRNA 组(P<0.05)(见图6)。

图6 25μmol/L 阿帕替尼对SGC-7901 细胞凋亡的影响 (DAPI 染色×100)
2.4 沉默Galectin-1 mRNA 表达对上皮间质转化通路相关蛋白的影响
空白对照组、阴性siRNA 组和Gal1-siRNA1 组细胞E-cadherin、Snail、Vimentin 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,与空白对照组和阴性siRNA组比较,Gal1-siRNA1 组细胞E-cadherin 蛋白相对表达量升高(P<0.05),而Snail 和Vimentin 蛋白相对表达量降低(P<0.05)。空白对照组、阴性siRNA 组和Gal1-siRNA1 组细胞Twist 和ZEB 蛋白相对表达量比较,经方差分析,差异无统计学意义(P>0.05)。见表3和图7。
表3 各组细胞E-cadherin、Snail、Twist、Vimentin、ZEB 蛋白相对表达量比较 (±s)

表3 各组细胞E-cadherin、Snail、Twist、Vimentin、ZEB 蛋白相对表达量比较 (±s)
注: †与Gal1-siRNA1 组比较,P <0.05。
组别 E-cadherin Snail Twist Vimentin ZEB空白对照组 0.68±0.10† 0.42±0.07† 0.43±0.09 0.67±0.08† 0.52±0.11阴性siRNA 组 0.69±0.11† 0.43±0.06† 0.43±0.10 0.66±0.10† 0.53±0.12 Gal1-siRNA1 组 1.03±0.15 0.29±0.05 0.41±0.08 0.43±0.06 0.50±0.12 F 值 21.361 13.308 0.131 22.123 0.137 P 值 0.000 0.000 0.878 0.000 0.873

图7 E-cadherin、Snail、Twist、Vimentin和ZEB 蛋白的表达
3 讨论
甲磺酸阿帕替尼是我国第1 个自主研发的1.1 类小分子抗肿瘤新药,也是第1 个被证实用于晚期胃癌患者安全有效的抗血管生成靶向制剂[7]。通过与VEGF 竞争并特异性结合VEGFR-2,抑制VEGFR-2羧基末端和酪氨酸激酶区域发生自动磷酸化,进而抑制肿瘤血管生成及细胞的增殖、侵袭、迁移等恶性生物学行为。2016年由李进教授[8]牵头一项多中心、随机、双盲Ⅲ期临床试验(NCT01512745)证实甲磺酸阿帕替尼可用于二线治疗失败的晚期胃癌患者和胃食管结合部腺癌患者,不仅能够有效地控制病情进展和癌性腹水,而且常见的不良反应基本可控,从而大大提高患者的生活质量并延长生存时间。另外戴广海的研究团队[9]通过一项多中心Ⅱ期临床研究(NCT02596256)也证实,在晚期胃癌患者的二线治疗中,阿帕替尼联合多西他赛较多西他赛单药治疗可延长患者无进展生存时间,提高疾病控制率,但是3 级以上毒性反应发生率高于多西他赛单药治疗组。近几年,多个研究机构陆续开展了阿帕替尼用于晚期胃癌一线治疗的Ⅰ期临床研究,包括NCT03255811、NCT02537171 等,但是研究结果尚未公布。
虽然阿帕替尼用于晚期胃癌的临床疗效已被普遍证实,但是其抗癌机制尚不明确。近几年,随着阿帕替尼在临床的使用时间延长,肿瘤细胞敏感性降低的问题逐渐引起相关专家的关注。HUANG 等[10]发现高表达VEGFR-2 的胃癌细胞对阿帕替尼敏感性更高,并且证实其可能的作用机制与阻断肿瘤细胞中VEGFR-2/PLCγ1/ERK1/2 信号通路的激活,以及减少VEGF 自分泌,进而抑制胃癌细胞的复制和增殖活力有关。CHEN 等[11]还发现,Galectin-1 在胃癌组织中呈高表达,并且与VEGF 的含量密切相关,因而笔者推测Galectin-1 与VEGF 在促肿瘤血管生成过程中具有协同作用。本研究委托上海吉玛公司设计了2 条干扰Galectin-1 表达的siRNA 序列,并转染至SGC-7901 细胞中,通过反复摸索,证实最佳转染条件为病毒滴度为1×108PFU/ml 时,细胞转染率为77.34%。而且分别经qRT-PCR 和Western blotting 验证,Gal1-siRNA1 的干扰效果最高,Galectin-1 mRNA 和蛋白表达降低最明显,继而建立了稳转细胞株以进行后续实验。
本实验进一步通过MTT 法检测不同浓度阿帕替尼作用于空白对照组、阴性siRNA 组、Gal1-siRNA1组,Gal1-siRNA1 组细胞的增殖抑制率低于空白对照组和阴性siRNA 组,说明下调Galectin-1 表达与提高胃癌细胞对阿帕替尼的敏感性有关。然后采用同一药物浓度作用于各组细胞,Gal1-siRNA1 组细胞的增殖活性同样低于空白对照组和阴性siRNA 组,说明阿帕替尼对SCG-7901 细胞的抑制作用不仅具有剂量-效应关系,也具有时间-效应关系。在此基础上,本实验进一步采用流式细胞术DAPI 染色法验证了阿帕替尼对各组细胞凋亡活力的影响。结果也证实阿帕替尼对Gal1-siRNA1 组细胞凋亡活力的影响也大大增加,说明下调Galectin-1 表达可通过促进SGC-7901 细胞的凋亡,增加阿帕替尼的敏感性。
化疗药物敏感性降低往往是治疗失败的主要原因。越来越多的研究表明,上皮间质转化是胃癌细胞对化疗药物产生耐药性的主要原因[12]。E-cadherin 是维持上皮细胞极性最主要的细胞黏附分子[13],而Vimentin 是细胞间充质表型的重要标志[14]。Snail、Twist、ZEB 都是属于影响上皮间质转化进程的转录因子[15]。本研究中,与空白对照组和阴性siRNA 组比较,Gal1-siRNA1 组细胞E-cadherin 蛋白相对表达量升高,而Vimentin 蛋白和E-cadherin 的转录抑制因子Snail 蛋白相对表达量降低,说明下调Galectin-1 表达后,SGC-7901 细胞上皮间质转化进程受到明显抑制,因此笔者推测上皮间质转化可能是Galectin-1 影响阿帕替尼敏感性的作用机制之一,但是具体的作用机制和调控网络尚需进一步研究。
综上所述,本实验通过siRNA 干扰SGC-7901 细胞中Galectin-1 mRNA 和蛋白的表达后,在一定程度上增加了细胞对阿帕替尼的敏感性,其作用机制可能为通过上调E-cadherin 黏附因子的表达,抑制Vimentin 蛋白和Snail 转录因子的表达,最终抑制上皮间质转化进程。
