非编码RNA GlmY对伤寒沙门菌生物膜形成的影响
2020-09-21李雪赵昕靳梦彤唐浩张盈黄新祥
李雪,赵昕,靳梦彤,唐浩,张盈,黄新祥
(1. 江苏大学医学院,江苏 镇江 212013; 2. 南京市第一医院核医学科,江苏 南京 210006)
伤寒沙门菌(Salmonellaentericaserovar Typhi,S. Typhi)是一种以人类为唯一宿主的肠道致病菌,主要通过受污染的食物或水经消化道入侵人体,突破免疫防御引起全身性感染(伤寒)[1- 2]。S. Typhi可黏附在某些非生物固体甚至人体胆石表面,形成大量高度组织化、系统化的细菌群落——生物膜,该膜结构的形成能够使细菌抵抗环境压力和抗生素,并逃避宿主免疫系统的攻击,增强其在宿主体外的传播持久性及体内定植[3]。生物膜的形成受到庞大而复杂的调控网络控制,包括许多转录和转录后调控因子,例如双组分调节体系,σ因子和非编码RNA等[4- 5]。
RNA不具有编码功能,广泛存在于各种微生物及动植物。多种细菌中均已鉴定出多种具有调控作用的非编码RNA(ncRNA)[6],它们大多通过与对侧或远端靶mRNA形成完全或不完全碱基配对的方式来发挥作用[7-8]。本课题组前期利用RNA-seq技术对生物膜及浮游状态的S. Typhi进行转录组分析,发现ncRNA GlmY在生物膜中的表达水平明显高于浮游菌(尚未发表)。GlmY可与ncRNA GlmZ 协同作用来调节胞内葡萄糖胺-6-磷酸的含量[9],但其在细菌生物膜形成中的作用尚未可知,因此本研究拟探讨GlmY对S. Typhi生物膜形成的影响及其作用机制。
1 材料与方法
1.1 菌株和质粒
伤寒沙门菌野生株S. Typhi GIFU10007、E.coliλ372和自杀质粒pGMB151由日本岐阜大学医学院微生物学教研室馈赠;E.coliDH5α、glmY缺陷株、回补株、空质粒对照株由本实验室制备或保存;pBAD/myc-HisA为美国Promega公司产品。
1.2 主要试剂与仪器
胰蛋白胨、酵母提取物、琼脂粉(德国Oxoid公司);限制性核酸内切酶BamH Ⅰ,T4DNA连接酶(大连TaKaRa公司);Trizol、氯仿(美国Sigma公司);超保真DNA聚合酶、逆转录试剂、SYBR荧光定量试剂盒(南京诺唯赞生物科技有限公司);96孔圆底细胞培养板(美国Corning公司)。凝胶成像仪(美国Gene Genius Bio Imaging System);核酸紫外检测仪(德国Eppendorf公司);PCR仪(美国Applied Biosystems®2720);cfx96荧光定量PCR仪,电转化仪均为美国Bio-Rad公司产品。设计各种引物,具体见表1,下划线为酶切位点/接头序列。引物由苏州泓讯生物科技有限公司合成。
1.3 glmY缺陷株构建
S. TyphiglmY缺陷株依照参考文献方法构建[10],分别设计glmY上下游特异性引物P1A/P1B、P2A/P2B,以S. Typhi 野生株DNA为模板,用重叠PCR获得重组片段,并插入自杀质粒 pGMB151BamH Ⅰ位点,将重组质粒电转导入S. Typhi野生株,经5%蔗糖板传代培养筛选,获得稳定重组的glmY缺陷株。

表1 引物序列
1.4 细菌生物膜形成检测
细菌生物膜形成实验参考文献[11],分别将野生株和glmY缺陷株接种于20 mL胰蛋白胨大豆肉汤(TSB)培养基培养至D(600 nm)=0.4。离心收集菌体,用TSB重悬并转种入96孔U型底细胞培养板,30℃静置培养96 h。实验行3次生物学重复。
1.5 细菌总RNA提取及qRT-PCR检测
细菌总RNA提取及qRT-PCR依照参考文献[11],分别挑取待测菌株的单菌落以“1.4”中方法培养至D(600 nm)=0.4,离心收集菌体,Trizol法提取总RNA并消化基因组DNA。取2 μg总RNA用特异性或随机引物进行逆转录。将野生株基因组DNA梯度稀释(至少5个梯度)制作各待测基因qRT-PCR的标准曲线,同时,将逆转录产物适当稀释后作为模板,用qRT-PCR检测待测基因和内参基因16 S mRNA水平。实验行3次生物学重复。
1.6 统计学分析

2 结果
2.1 成功制备glmY缺陷变异株
为制备glmY缺陷变异株,采用自杀质粒同源重组的方法来敲除目的基因。以S. Typhi野生株基因组DNA为模板,经PCR扩增获得glmY上、下游同源片段F1(423 bp)、F2(435 bp),如图1A。利用重叠PCR获得F1+F2定向连接产物作为重组DNA片段(图1B),连接自杀质粒,热击导入E.coliλ372感受态细胞。提取经PCR及序列分析验证后的阳性克隆重组质粒,电击转入S. Typhi野生株中,用蔗糖诱导重组,PCR 扩增glmY筛选菌株,最后获得传代稳定的glmY缺失变异株(图1C)。

M: DL2000 DNA标准参照物;A:PCR扩增同源片段;1,同源片段F1;2,同源片段F2;B:重叠PCR扩增同源片段;1,阴性对照;2,F1+F2定向连接产物;C:PCR筛选重组菌株;S,阳性对照;L,阴性对照;1~8,稳定变异株的PCR扩增结果
2.2 GlmY可增强伤寒沙门菌生物膜形成能力
结晶紫染色结果如图2所示,与野生株相比,缺陷株的生物膜染色形成明显降低(t=25.57,P<0.01),表明GlmY缺失可减弱S. Typhi野生株的生物膜形成能力。
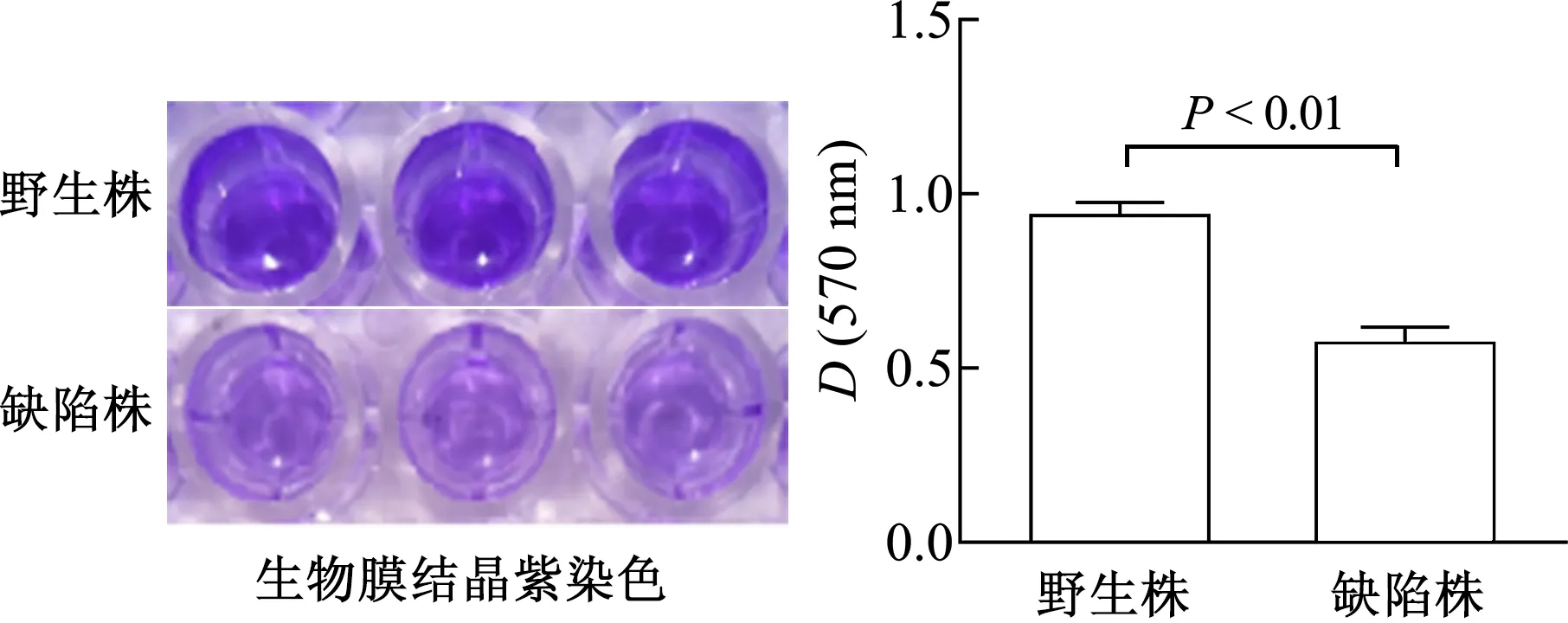
图2 S. Typhi生物膜形成分析
2.3 GlmY影响生物膜相关基因表达水平
为进一步探究GlmY通过何种调控途径来影响生物膜形成,本研究选取11个生物膜形成要素的相关基因(菌毛:csgD、csgA、fimA;胞外多糖:yihP、rfaD、wcaA;鞭毛:flhD、fliA、fljB;纤维素:bcsA;表面蛋白:bapA),并用qRT-PCR检测野生株和缺陷株中上述基因的mRNA水平。如图3所示,与野生株相比,缺陷株中csgD和csgA的mRNA水平明显下降(P<0.01或<0.05),同时缺陷株中胞外多糖相关基因yihP、rfaD、wcaA及纤维素相关基因bcsA的mRNA表达均有不同程度的上调(P均<0.05或<0.01),其余相关基因mRNA表达差异无统计学意义(P均>0.05)。

图3 野生株与glmY缺陷株生物膜形成相关基因mRNA相对表达水平
3 讨论
为探究在S. Typhi生物膜形成中具有调控作用的ncRNA,本课题组前期利用Solexa高通量测序技术对不同状态下的S. Typhi进行转录组分析,发现生物膜状态下的S. Typhi ncRNA GlmY表达水平较高。研究发现,ncRNA GlmY可协同ncRNA GlmZ促进GlmS翻译[9,12]。glmS基因编码的谷氨酰胺合酶为细菌合成细胞壁主要成分N-乙酰氨基葡萄糖6-磷酸所必需。本研究在成功构建glmY缺陷株基础上进行生物膜形成试验,发现glmY缺陷株生物膜形成能力明显低于野生株。同时,发现GlmY缺失可下调卷曲菌毛合成相关基因csgD和csgA的mRNA水平,但上调胞外多糖和纤维素合成相关基因的mRNA水平,推测GlmY对卷曲菌毛、胞外多糖及纤维素的合成均有调控作用,但以前者的作用为主。由此揭示GlmY有可能通过促进S. Typhi的卷曲菌毛合成进而调节生物膜形成。
已知卷曲菌毛是S. Typhi生物膜的主要蛋白成分[13],CsgD作为卷曲菌毛合成中的关键转录调节因子,不仅负责调控csgBA操纵子(编码主结构蛋白CsgA和成核蛋白质CsgB)和csgDEFG操纵子(编码纤维组装和分泌所需的蛋白质)的表达[14-15],同时csgD转录本还是生物膜调控网络的信号枢纽,受到许多小的ncRNA调控。如OmrA,OmrB,McaS,RprA,GcvB等这些已知的小RNA均可通过与csgDmRNA直接结合或间接作用来促进或者抑制csgD表达[16-18]。本研究虽然发现GlmY可下调csgD和csgA的mRNA水平,但并未确定二者是否为GlmY的新靶标。此外,GlmY缺失后,有部分与生物膜形成相关的基因的mRNA表达呈上升趋势,其作用及机制有待进一步研究。
