鲍曼不动杆菌OmpA经ROS/NLRP3信号通路调控THP-1细胞自噬和凋亡
2020-09-21戴晓玥吴亮夏雯阴晴邹治情周亚玲何蕾丁龙坤席月张有江许化溪
戴晓玥,吴亮,夏雯,阴晴,邹治情,周亚玲,何蕾,丁龙坤,席月,张有江,许化溪
(1. 江苏大学医学院,江苏 镇江 212013; 2. 江苏大学附属医院检验科,江苏 镇江 212001; 3. 扬州市广陵区疾病预防控中心,江苏 扬州 225001)
鲍曼不动杆菌(Acinetobacterbaumannii)是引起呼吸机相关性肺炎(ventilator-associated pneumonia, VAP)的主要病原菌[1],患者上呼吸道黏膜表面定植的鲍曼不动杆菌是VAP的重要来源[2]。目前已知的鲍曼不动杆菌毒力因子包括外膜蛋白(outer membrane protein, Omp),磷脂酶D和外膜囊泡等,其中OmpA是外膜蛋白中表达量最高的一种,参与鲍曼不动杆菌外膜囊泡组装以及细菌黏附和侵入等过程[3]。近来研究发现,OmpA也存在于鲍曼不动杆菌外膜囊泡中,通过外膜囊泡携带传递至远处发挥致病作用,同时破坏宿主细胞线粒体完整性,诱发细胞凋亡[4]或坏死[5],与鲍曼不动杆菌诱发的VAP严重程度密切相关。鲍曼不动杆菌野生株诱导人喉表皮样癌Hep-2细胞凋亡能力显著强于OmpA基因敲除株,且OmpA基因敲除株明显丧失对宿主肺泡上皮细胞的黏附能力[6]。研究发现[7],将OmpA基因转染HeLa细胞后可诱发细胞自噬。携带OmpA基因的慢病毒转染RAW 264.7细胞48 h后可引起细胞含NLR家族Pyrin域NOD样受体家族3(NLRP3)炎症小体激活和炎症因子表达上调[8]。此外,OmpA靶向作用于线粒体并诱导产生活性氧,诱发树突状细胞凋亡和坏死[6],但OmpA毒力蛋白的确切致病机制目前仍不清楚。因此,本研究采用原核表达技术制备重组OmpA蛋白[9],通过免疫新西兰兔制备多克隆抗体,建立鲍曼不动杆菌OmpA毒力蛋白的快速检测方法;同时研究OmpA对THP-1细胞自噬与凋亡的影响。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和细胞株 感受态细胞E.coliDH5α和BL21(DE3)为本实验室保存;质粒pTG19-T购自上海捷瑞生物科技公司;pET28a(+)购自德国Novagen公司;鲍曼不动杆菌标准菌株ATCC 19606由南京鼓楼医院检验科周万青博士惠赠;人单核THP-1细胞购自上海细胞库,由本实验室自行保种和培养。清洁级雄性新西兰兔,3只,6周龄,体质量2.5~3 kg,由江苏大学实验动物中心提供(合格证号:0001330),在江苏大学动物中心清洁级环境下饲养。
1.1.2 主要试剂及仪器 细菌培养箱(美国Thermo Fisher公司);PCR仪(美国ABI公司);LB培养基(英国Oxoid公司);氨苄西林(Amp)、X-gal、卡那霉素和IPTG、细菌基因组DNA提取试剂盒、凝胶回收试剂盒、质粒提取试剂盒和DNA 标准参照物均购自上海捷瑞生物科技公司;2×TaqMaster Mix、反转录试剂盒、荧光定量PCR试剂(SYBR Green染料法)、Annexin V FITC/PI凋亡检测试剂盒和总RNA提取试剂盒均购自南京诺唯赞公司;琼脂糖为西班牙进口产品分装;限制性内切酶BamH Ⅰ和Hind Ⅲ均为美国Thermo Fisher公司产品;T4DNA连接酶(大连TaKaRa公司);BCA蛋白定量试剂盒(北京康为世纪生物科技有限公司);引物由苏州泓迅生物科技公司合成;含镍的亲和树脂Ni-NTA(德国Qiagen公司);弗氏完全佐剂和不完全佐剂(美国Sigma公司);免疫印迹系统及凝胶成像系统(美国Bio-Rad公司);β-肌动蛋白、Beclin-1、微管相关蛋白1轻链3 B片段(LC3B)抗体均为美国ABclonal生物科技公司产品;其余生化试剂均为国产分析纯;基因测序由上海生工生物工程公司完成。
1.2 实验方法
1.2.1 鲍曼不动杆菌OmpA克隆 复苏鲍曼不动杆菌标准株ATCC 19606,挑单个菌落于35 ℃中振摇培养12~16 h(200 r/min);取200 μL菌液用于细菌基因组DNA抽提,操作过程严格按照试剂盒操作说明书进行。根据鲍曼不动杆菌OmpA开放阅读框序列(AY485227),使用Primer Premier 5.0软件设计PCR引物,正向(5′→3′):ACAGGATCCATGAAATTGAGTCGTATT(BamH Ⅰ),反向(5′→3′):ACAAGCTTTTATTGAGCTGCTGCA(Hind Ⅲ),扩增OmpA编码基因。PCR反应总体系为25 μL,其中2×PCR Mix 12.5 μL,各条引物(25 μmol/L)各0.5 μL,模板2 μL,双蒸水9.5 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 60 s,25个循环;72 ℃ 10 min。产物经15 g/L琼脂糖凝胶电泳,并切胶纯化后与pTG19-T载体连接,导入感受态细胞E.coilDH5α;将其涂布于含50 μg/mL Amp、20 μg/mL X-gal和10 μg/mL IPTG的LB琼脂平板,于37 ℃中培养12 h;蓝白斑筛选阳性克隆,并挑取阳性克隆经PCR法验证后送上海生工生物工程公司测序分析。
1.2.2 OmpA/pET-28a表达质粒的构建 将经测序确认无误的OmpA/pTG19-T质粒与原核表达载体pET-28a质粒经限制性内切酶BamH Ⅰ和Hind Ⅲ酶切,切胶回收OmpA目的片段和pET-28a载体大片段,在T4连接酶作用下16 ℃过夜连接;次日转化感受态细胞E.coilDH5α,挑取菌株经摇菌扩增后提取质粒,以BamH Ⅰ和Hind Ⅲ双酶切鉴定阳性克隆,继续转化感受态细胞E.coilBL21,用于后续重组OmpA表达纯化。
1.2.3 重组OmpA蛋白表达纯化 转化后的BL21菌株接种于含硫酸卡那霉素(50 μg/mL)的LB培养基,于37 ℃中200 r/min孵育12 h;次日取新鲜饱和菌液按1 ∶100比例接种新LB培养液并继续增菌至D(600 nm)=0.6;分别加入终浓度为1 mmol/L或0.4 mmol/L IPTG,并分别在25 ℃和30 ℃下诱导表达,诱导时间为2、4、6、8 h;然后行8 000 r/min离心,收集菌体并重悬于200 μL双蒸水中,经超声裂解后取上清液行SDS-PAGE,检测不同时间点重组OmpA表达量。在最佳诱导剂浓度和最佳诱导时间下大量增菌,离心收集细菌并重悬于结合缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,10 mmol/L 咪唑,pH=8.0),冰上超声裂解菌体;以16 000 r/min离心20 min;收集上清液并与Ni-NTA介质充分结合,用洗涤缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,20 mmol/L 咪唑,pH=8.0)冲洗Ni-NTA亲和层析柱至穿流液D(280 nm)<0.01;最后以洗脱缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,250 mmol/L 咪唑,pH=8.0)洗脱结合蛋白,纯化产物经SDS-PAGE后以考马斯亮蓝染色观察纯化结果。
1.2.4 OmpA多克隆抗体制备及抗体水平检测
1.2.4.1 OmpA多克隆抗体制备 纯化的重组OmpA蛋白与等量弗氏完全佐剂充分乳化,以背部皮内多点注射法免疫新西兰兔,免疫量为1 mg/只。每次免疫前采兔耳缘静脉血用于效价测定,首次免疫后分别于第3周和第5周行再次免疫以提高抗体效价,第2次和第3次免疫均使用弗氏不完全佐剂。采用ELISA法检测兔血清中抗OmpA-IgG血清滴度,以羊抗兔IgG-HRP(1 ∶5 000)为二抗,酶标仪检测D(450 nm)。当抗体效价大于1 ∶320 000时,经心脏采血并分离血清用于续研究。
1.2.4.2 蛋白质印迹法检测临床菌株OmpA表达 以自制兔多抗检测鲍曼不动杆菌标准菌株ATCC 19606和6株临床分离鲍曼不动杆菌。以兔血清为一抗,采用蛋白质印迹法检测鲍曼不动杆菌临床菌株OmpA表达。血平板上刮取1个菌落并与20 μL 2×SDS-PAGE上样缓冲液充分混匀,煮沸10 min;经12 000 r/min离心2 min;取上清液行SDS-PAGE。80 V 120 min;350 mA 90 min转印至PVDF膜;5%脱脂奶粉室温封闭1 h;自制抗血清(1 ∶4 000稀释)于4 ℃振摇过夜;TBST洗涤3次,每次15 min;加入羊抗兔IgG-HRP(1 ∶5 000)孵育1 h;TBST洗涤3次;用ECL化学发光显色试剂盒显影,照相记录结果。
1.2.4.3 鲍曼不动杆菌感染患者血清中OmpA抗体水平检测 取适量重组OmpA蛋白与上样缓冲液充分混匀,煮沸,行SDS-PAGE。选择4例行机械通气的VAP患者,根据患者临床症状和微生物培养结果确认为鲍曼不动杆菌感染。以患者血清为一抗,羊抗人IgG-HRP为二抗,采用蛋白质印迹法,检测患者插管前和VAP发生时(间隔时间大于14 d)血清中OmpA抗体(IgG型)水平,方法同“1.2.4.2”。
1.2.5 重组OmpA对THP-1细胞炎症、自噬及凋亡作用的影响
1.2.5.1 THP-1细胞与重组OmpA共孵育及分组
THP-1细胞按常规方法培养于含10%胎牛血清的RPMI 1640培养基中,37 ℃、5% CO2环境中稳定传代至第6代用于本研究。取对数生长期细胞接种于6孔板(1×106个/孔),37 ℃、5% CO2培养过夜;次日加入终浓度为100 μg/mL的佛波酯诱导成贴壁巨噬细胞状态;待细胞完全贴壁后分别加入终浓度为1 μg/mL和10 μg/mL的重组OmpA蛋白,同时设未加重组蛋白为阴性对照组,继续培养1 h、3 h和6 h,收集细胞用于后续检验。
1.2.5.2 蛋白质印迹法检测自噬相关蛋白LC-3和Beclin-1表达 弃细胞培养液,每孔加入100 μL RIPA裂解液于冰上裂解15 min;12 000 r/min离心10 min;收集上清液用于蛋白质印迹法检测,方法同“1.2.4.2”。一抗LC-3抗体、Beclin-1抗体、β-肌动蛋白抗体均1∶1 000稀释,4 ℃孵育过夜;二抗羊抗兔IgG-HRP 1 ∶1 000稀释,于室温孵育1 h;ECL化学发光试剂盒显色,Image J软件分析蛋白相对表达量。
1.2.5.3 流式细胞术检测细胞凋亡及活性氧产生水平 采用Annexin V-FITC/PI法检测THP-1细胞凋亡,DCFH-DA探针法检测THP-1细胞活性氧产生,操作方法严格参照试剂盒说明书进行。
1.2.5.4 qRT-PCR法检测NLRP3、Caspase-1和IL-1β等mRNA表达NLRP3、Caspase-1、IL-1β和GAPDH等mRNA引物序列见表1。采用Trizol法提取细胞总RNA,以Oligo(dT)为引物合成cDNA链。qRT-PCR法反应总体系20 μL,包括SYBR Green Master混合物10 μL,上下游引物各(10 μmol/L)0.4 μL,cDNA 2 μL。反应程序:95 ℃预变性1 min,95 ℃ 变性5 s,60 ℃ 退火30 s,反应共计40个循环。实验中样本mRNA的Ct值通过GAPDH的Ct值均一化,即ΔCt=Ct样本-Ct内参,样本基因mRNA相对丰度值以2-ΔΔCt值表示。
1.3 统计学分析

表1 引物序列
2 结果
2.1 OmpA编码基因的扩增
以ATCC 17606菌株DNA为模板,PCR扩增产物长度为1 071 bp,与预期大小一致。
2.2 OmpA/pET-28a载体酶切鉴定
OmpA/pET-28a载体经BamHⅠ和Hind Ⅲ酶切鉴定,载体的插入片段长度与目的基因片段大小一致。基因测序结果表明,插入片段基因序列与鲍曼不动杆菌OmpA基因(AY485227)序列一致,OmpA/pET-28a载体构建成功。
2.3 重组OmpA表达纯化
在不同的时间、温度和诱导浓度下,电泳结果显示,菌株在30 ℃和0.4 mmol/L IPTG条件下诱导8 h可获得最大重组OmpA蛋白产量。经Ni-NTA亲和层析法纯化后,纯化产物经SDS-PAGE可见38 000处有一条清晰条带,即为重组OmpA蛋白(图1)。BCA法测定浓度为3.25 mg/mL,SDS-PAGE结果表明重组OmpA蛋白分子质量与预测值相符。

M:蛋白分子标准参照物;A:1,未经IPTG诱导菌;2,经IPTG诱导菌;B:1,穿流液;2,洗脱液
2.4 临床菌株OmpA蛋白表达
各株菌中均可检出OmpA表达,而大肠埃希菌BL21株中无反应,表明自制多抗可以识别临床菌株OmpA蛋白。见图2。

1:大肠埃希菌BL21;2:鲍曼不动杆菌ATCC19606;3~8:6株临床菌株
2.5 患者血清中OmpA抗体表达
结果表明,4位VAP患者气管插管前后血清中均可以检出IgG型OmpA抗体,且VAP发生时患者血清中OmpA抗体水平显著高于气管插管前(P均<0.05)。见图3。
2.6 OmpA诱导THP-1细胞自噬
1,3,6 h时,10 μg/mL组LC3-Ⅱ和Beclin-1蛋白相对表达量较对照组显著增加(P<0.05),并且LC3-Ⅱ在6 h和Beclin-1在1、3 h相对表达量显著高于1 μg/mL组(P均<0.05)。由此可见,随着重组OmpA蛋白作用时间延长,10 μg/mL组LC3-Ⅱ和Beclin-1蛋白表达量逐渐升高,呈一定的时间依赖性。见图4。

1~4:患者编号;a:P<0.05,与插管前比较

a:P<0.01,与对照组比较;b:P<0.05,与同时间1 μg/mL组比较
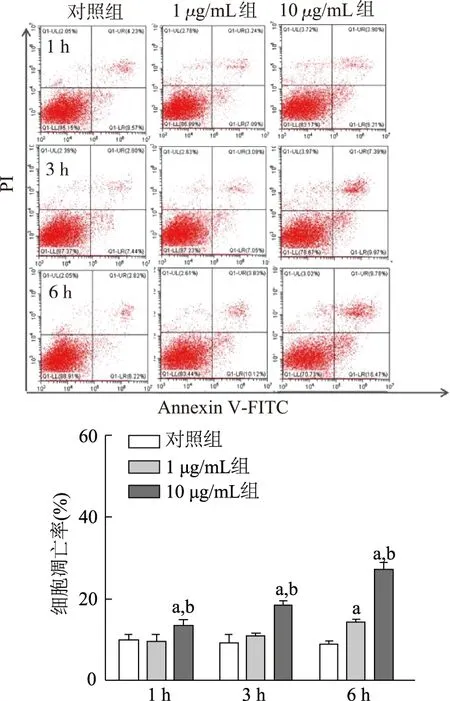
2.7 重组OmpA蛋白诱导THP-1细胞凋亡发生
1,3,6 h时,10 μg/mL组THP-1细胞凋亡率显著高于1 μg/mL组(P均<0.05)和对照组(P均<0.05),而1,3 h时,1 μg/mL组和对照组之间差异无统计学意义(P>0.05)。作用6 h时,1 μg/mL组细胞凋亡率显著高于对照组(P<0.05)。由此可见,重组OmpA蛋白10 μg/mL作用THP-1细胞后,细胞凋亡率呈一定的时间依赖性。见图5。
2.8 重组OmpA蛋白诱导NLRP3炎症小体活化
1 h时,1 μg/mL和10 μg/mL组IL-1βmRNA表达量较对照组显著升高(P均<0.01)。3 h时,10 μg/mL组NLRP3mRNA和Caspase-1mRNA表达量显著高于1 μg/mL组(P均<0.05)和对照组(P均<0.01),而1 μg/mL组和对照组间二者表达量差异无统计学意义(P>0.05)。
3 h时1 μg/mL和10 μg/mL组IL-1βmRNA表达量与自身对应1 h相比,明显降低(t=5.24, 10.92,P均<0.05)。6 h时,10 μg/mL组NLRP3mRNA和Caspase-1mRNA表达量较3 h时显著降低(t=5.59,10.79,P均<0.05),与对照组差异无统计学意义(P>0.05);而1 μg/mL组THP-1细胞NLRP3mRNA和Caspase-1mRNA表达量显著高于10 μg/mL组(t=8.91, 7.03,P均<0.05)和对照组(t=10.00, 8.00,P均<0.05)。见图6。
a:P<0.05,与对照组比较;b:P<0.05,与同时间1 μg/mL组比较

a:P<0.05,b:P<0.01,与对照组比较;c:P<0.05,与同时间1 μg/mL组比较
2.9 重组OmpA蛋白诱导THP-1细胞活性氧生成
1 h时,1 μg/mL组和10 μg/mL组活性氧含量均明显高于对照组(t=16.33,t=15.57,P均<0.01),且10 μg/mL组明显高于1 μg/mL组(t=4.39,P= 0.048);10 μg/mL组作用3 h时活性氧含量较1 h时明显下降(t=11.68,P= 0.007),6 h活性氧含量较3 h时变化无统计学意义。见图7。

a:P<0.05,b:P<0.01,与对照组比较;c:P<0.05,与同时间1 μg/mL组比较
3 讨论
Beclin-1(酵母ATG6同源物)是重要的自噬调控蛋白;此外,当自噬发生时胞质中LC3-Ⅰ经加工转变为LC3-Ⅱ并定位于自噬体膜。因此通过检测两种LC3蛋白表达量的比值(LC3-Ⅱ/LC3-Ⅰ)和Beclin-1蛋白表达量可评估细胞自噬发生[9-10]。Jin等[11]通过敲除鲍曼不动杆菌OmpA基因构建外膜囊泡不含OmpA的缺陷菌株,并发现该缺陷株诱导宿主细胞自噬和死亡能力较野生株明显减弱。本研究结果表明,鲍曼不动杆菌重组OmpA蛋白可以体外诱导THP-1细胞自噬和凋亡,且随重组蛋白浓度升高和作用时间延长而增强。由此推测,在感染早期,大量宿主免疫细胞的自噬和凋亡有助于控制感染扩散,并加速机体对病原体的清除。
免疫细胞释放的炎症因子是固有免疫的重要组成部分,而由NLRP3、Caspase-1和凋亡相关斑点样蛋白组成的NLRP3炎症小体的激活是启动免疫防御的关键[12],但NLRP3的过度激活又会导致宿主正常组织损伤[13]。我们前期研究发现,鲍曼不动杆菌可以激活宿主巨噬细胞NLRP3炎症小体的活化[14]。本研究中则进一步证实鲍曼不动杆菌的重要毒力蛋白OmpA可以导致NLRP3炎症小体活化和活性氧产生,且该能力似乎随着OmpA蛋白作用浓度升高而增强,在作用后期均下降。由此推测,在鲍曼不动杆菌感染初期,细菌OmpA刺激宿主巨噬细胞,激活NLRP3炎症小体并产生大量活性氧发挥杀伤病原体效果;随着感染持续活性氧等炎症因子会诱发巨噬细胞自噬发生以抑制炎症小体的激活,防止机体过度炎症反应以避免正常细胞和组织损伤。
机体可通过适度自噬下调炎症水平,其机制可能是通过清除受损的线粒体从而减少活性氧及线粒体DNA释放,以抑制炎症小体的活化,并且凋亡相关蛋白BCL家族成员能抑制NLRP1自身寡聚化,继而抑制Caspase-1活化及IL-1β成熟[15]。本研究结果显示,在高浓度OmpA或长时间作用下,THP-1细胞NLRP3炎症小体的激活被细胞自噬所抑制,其结果可能会阻碍病原体的识别和清除,有利于病原体持续在宿主体内存活和增殖,并引起严重感染症状。而自噬对炎症反应的抑制存在两面性,适度的自噬水平可以维持机体内环境稳定,防止重要器官因过度炎症反应而损伤[16]。
综上所述,OmpA是鲍曼不动杆菌的重要毒力蛋白,可以诱发宿主巨噬细胞自噬、凋亡,并可以激活NLRP3炎症小体。患者体内自噬水平和炎症水平与疾病的发生、发展和预后密切相关,通过调节患者体内自噬水平可以降低感染后炎症损伤。
