不明原因发热患者肺泡灌洗液病毒群落解析
2020-09-21李欣霖刘齐陈旭肖宇晴杨世兴张文陈建国
李欣霖,刘齐,陈旭,肖宇晴,杨世兴,张文,陈建国
(1. 江苏大学医学院, 江苏 镇江 212013; 2. 江苏大学附属人民医院检验科,江苏 镇江 212002)
不明原因发热是指持续发热3周以上,多次测得体温超过38℃,入院检查1周仍然没有明确原因的发热[1]。不明原因发热病因复杂多样,缺乏特异性的临床表现,同时容易受到治疗药物的影响,通过常规的检测手段很难确诊。能够导致不明原因发热的病因多达200多种,主要包括感染性疾病、结缔组织病、肿瘤性疾病等,其中以感染性疾病为主,而肺部感染又占有较大比例[2]。病毒作为肺部感染的重要病原体之一,是引起发热的重要原因[3]。目前对于病毒的检测,传统的分离培养、免疫学方法以及分子生物学方法发挥了重要的作用,但病毒分离培养效率较慢,分子生物学方法例如PCR技术只能检测出已知序列的病毒,对于新型病毒的检测具有较大局限性,而病毒宏基因组学利用高通量测序技术可以对样本中几乎所有核酸序列进行测定,不仅可以分析样品中病毒群落组成,还能够监测某些致病性病毒的变化情况,并能提前发现潜在的新型致病性病原体。本研究采用病毒宏基因组学技术对不明原因发热患者肺泡灌洗液中的病毒群落进行初步解析,探讨肺部病毒群落与不明原因发热之间的联系。
1 材料与方法
1.1 肺泡灌洗液样本的采集
收集2018年6月至2019年4月在江苏大学附属人民医院诊治的不明原因发热患者(平均年龄67岁)肺泡灌洗液样本共80份,其中58份样本用于文库构建,文库构建后继续收集22份肺泡灌洗液用于阳性样本筛选,并采集40份健康者咽拭子作为阴性对照。均使用一次性无菌用具采集后于-20 ℃冷冻运输至实验室。用1.5 mL无RNA酶的EP管从每份样本中吸取1 mL肺泡灌洗液,于-80 ℃冰箱中冻存备用。
1.2 病毒宏基因组文库构建及深度测序
1.2.1 高通量文库的构建[4-5]样本处理:从-80 ℃冰箱中取出样本置于冰上备用,振荡15 min,12 000×g离心10 min,吸取上清液200 μL至另一新1.5 mL无RNA酶 EP管中,保存待用。将58个样本共分为5个文库,1号、2号、3号文库分别由12个样本组成,各样本吸取41.7 μL混合制备成500 μL体系;4号、5号文库分别由11个样本组成,各样本吸取45.5 μL混合制备成500 μL体系。过膜除去微小颗粒物质。利用核酸消化酶(美国Life Technologic公司)去除各文库中无蛋白衣壳保护的游离核酸,使用MiniBEST 病毒核酸提取试剂盒(日本TaKaRa公司)提取样本中的病毒核酸,采用SuperScript Ⅳ逆转录试剂盒(美国Life Technologic公司)进行逆转录反应,将文库中的RNA逆转录为cDNA,然后使用Klenow酶(美国New England Biolabs公司)将单链DNA合成双链DNA,用于文库的构建。高通量测序文库的构建采用Nextera XT DNA 样品制备试剂盒(美国Illumina公司)。
1.2.2 文库的扩增、纯化与测序 利用二代测序接头引物试剂盒(美国Illumina公司)将合成后的DNA加上接头后进行扩增,接着采用QIAquick PCR产物纯化试剂盒(德国Qiagen公司)对扩增后的PCR产物进行纯化并采用Agencourt AMPure XP文库筛选试剂盒(美国Beckman公司)除去文库中小的DNA片段和引物二聚体,从而获得长度在300~800 bp的DNA文库,送至上海生工生物有限公司Illumina Miseq测序平台进行深度测序。
1.2.3 文库测序结果的生物信息学分析 通过Miseq平台对文库进行测序并对测序后的数据进行质量检测,保留质检合格的测序数据后借助Vendor软件将原始数据输出,利用Bowite 2软件除去原始数据中的真核及原核基因组序列后,再利用VecScreen软件剪切掉序列两端的引物和接头,将所得序列进行拼接,之后放入病毒蛋白组数据库中进行Blast X搜索,最后将核酸序列按照病毒分类,以网页的形式输出。
1.3 病毒基因组扩增及阳性样本筛选
1.3.1 肺泡灌洗液中病毒核酸的提取 阳性样本筛选包括用于文库构建的58份肺泡灌洗液及22份后期采集的灌洗液共80份,使用MiniBEST病毒核酸提取试剂盒提取病毒核酸。
1.3.2 PCR引物设计及扩增测序 用Geneious 11软件设计细环病毒及鼻病毒巢式引物,引物序列见表1。细环病毒 PCR外套反应条件:95 ℃预变性5 min;95 ℃ 30 s,50 ℃ 30 s,72 ℃ 40 s,共循环31次,扩增结束后72 ℃延伸5 min。内套反应退火温度为55℃,其余条件同外套反应。
鼻病毒PCR外套反应条件:94 ℃预变性2 min;94 ℃ 20 s,50 ℃ 20 s,72 ℃ 30 s,共循环35次,扩增结束后72 ℃延伸10 min。内套反应条件:94 ℃预变性2 min;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,共循环25次,扩增结束后72 ℃延伸10 min。
细环病毒和鼻病毒扩增均选用TaKaRa公司r-Taq酶体系,外套:r-Taq酶10 μL,DEPC水 8 μL,上、下游引物(10 μmol/L)各0.5 μL,样本 1 μL,共计20 μL体系。内套:r-Taq酶25 μL,DEPC水 22 μL,上、下游引物(10 μmol/L)各1 μL,样本1 μL,共计50 μL体系。最后用1%琼脂糖凝胶电泳检验各阳性样本,采用MiniBEST琼脂糖凝胶DNA提取试剂盒(日本TaKaRa公司)对切下的目的片段进行胶回收,并送Illumina MiSeq测序平台测序。

表1 巢式PCR引物序列
2 结果
2.1 肺泡灌洗液文库中病毒群落组成
高通量测序后的最终结果通过网页的形式输出,可以看到各个文库中包含的各种病毒,包括各个病毒的科、属、种以及每种病毒序列的最大重叠群碱基长度和序列条数。通过统计后可以得到各个文库中的病毒群落组成,结果发现1号文库的病毒种类及所包含的病毒序列明显少于其余文库,同时在5个文库中都存在的有圆环病毒科(Circoviridae)、人类内源性逆转录病毒科(Humanendogenousretrovirus,HERV)、藻去氧核糖核酸病毒科(Phycodnaviridae)、痘病毒科(Poxviridae)、未分类病毒科(None),而指环病毒科(Anelloviridae)、拟菌病毒科(Mimiviridae)、虹彩病毒科(Iridoviridae)、逆转录病毒科(Retroviridae)同时出现于多个文库中。指环病毒科存在于第2号、3号、4号、5号文库中,占有较大的比列,在2号、4号文库中的序列数分别为1 249条和753条,明显高于其他文库,且在4号文库中存在的最大重叠序列(Contig)长达2 199 bp。小RNA病毒科(Picornaviridae)仅存在于1号与4号文库中,并且序列数低,分别为2条和3条。
将各病毒科的序列条数进行统计后对各文库病毒群落进行比较(表2),与指环病毒科相关的序列数共2 207条(占总体45.0%),圆环病毒科65条(1.3%),藻去氧核糖核酸病毒科91条(1.9%),人类内源性逆转录病毒科68条(1.4%),逆转录病毒科14条(0.3%),痘病毒科1 376条(28.1%),帚状病毒科660条(13.5%),未分类病毒科336条(6.9%),小RNA病毒科5条(0.1%),其他病毒科78条(1.6%)。
将5个文库中的病毒群落组成统计整理后并以饼状图展示(图1),可以直观看出各个文库中每个病毒所占比例,同时整理后得到5个肺泡灌洗液文库中总体病毒群落组成:指环病毒科占19.4%,圆环病毒科占11.0%,藻去氧核糖核酸病毒科占11.0%,人类内源性逆转录病毒科占10.2%,痘病毒科占4.9%,逆转录病毒科占3.2%,帚状病毒科(Virgaviridae)占2.3%,小RNA病毒科占0.6%,未分类病毒科占24.7%,虹彩病毒科、拟菌病毒科等其他病毒科共占12.7%。

表2 肺泡灌洗液文库内病毒相关序列数比较

A:1号文库;B:2号文库;C:3号文库;D:4号文库;E:5号文库;F:1~5号文库总体病毒群落组成
2.2 细环病毒阳性样本筛选结果及系统进化分析
指环病毒科在肺泡灌洗液病毒群落中所占比例最大,其中与细环病毒相关序列数最多,通过拼接延长后获得的最大重叠序列为2 199 bp,故以该序列为模板设计PCR引物,在所有样本中进行细环病毒阳性样本的筛选,电泳结果见图2,其中阳性条带位于370 bp左右的位置,共有9份阳性样本,分别为26号、37号、38号、41号、46号、47号、72号、75号、76号。将阳性样本切胶纯化后测序,通过Blast N比对后均属于细环病毒,阳性率为11.3%。而阴性对照中共筛选出细环病毒阳性样本2份,阳性率为5.0%。
将各个文库指环病毒科中序列条数较多的病毒通过拼接延长之后,共获得4个细环病毒的开放阅读框1(ORF1)氨基酸序列,分别表示为HTTVL1(MN893308)、HTTVL2(MN893309)、HTTVL3(MN893310),它们分别存在于2号、3号、4号文库中;HTTVL4(MN893311)为4号文库中的细环病毒13型(torque teno virus 13),根据他们的ORF1氨基酸序列构建而成的系统发育树如图3所示。从发育树上可以看出,HTTVL1与来自美国肝炎患者的细
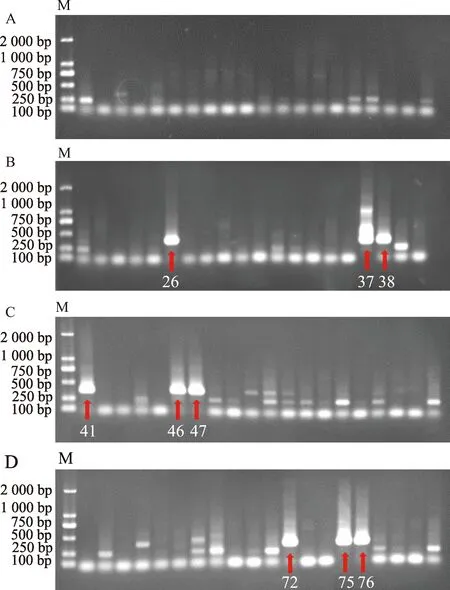
A:1~20号样本;B:21~40号样本;C:41~60号样本;D:61~80号样本。M:DNA标准参照物
环病毒(AB017610)聚集,同源性为90.2%;HTTVL2与来自美国艾滋病患者血浆的细环病毒(ANQ39345)聚集,同源性为89.3%;HTTVL3与属于未分类指环病毒中的细环病毒(AHN50432)聚集,且同源性为93.3%;HTTVL4与属于甲型细环病毒属(Alphatorquevirus)的细环病毒13型(YP009505717)聚集,同源性为86.1%。

图3 基于细环病毒开放阅读框1的系统发育树
2.3 鼻病毒阳性样本筛选结果
鼻病毒属于小RNA科病毒,虽然仅在1号、4号文库中存在,但鼻病毒是重要的呼吸道病毒。为了进一步研究其与发热的关系,根据鼻病毒VP4/VP2区域核苷酸序列设计巢式PCR引物进行鼻病毒阳性样本的筛选。电泳结果如图4,共有8份阳性样本,分别为41号、44号、46号、60号、70号、78号、79号、80号。将各阳性样本纯化后测序,再通过Blast N比对后得到41、44、60号属于鼻病毒B型(rhinovirus B),46、70、78、79号属于鼻病毒A型(rhinovirus A),80号未得到测序结果。
3 讨论
病毒宏基因组学就是将样品中所有的病毒与非病毒微生物分离后提取病毒核酸,运用高通量测序技术进行深度测序,然后将测序所得结果同数据库中病毒序列进行比对,并利用相关软件处理后得到研究样本中的病毒群落组成[6]。病毒宏基因组学技术避开了传统方法难以检测到变异度高的新型病毒的局限性,不仅可以分析各种环境中病毒群落的组成,还能够发现潜在新型病毒,为人类发掘新型病毒及诊断各种病毒性疾病提供了方法和技术支持。
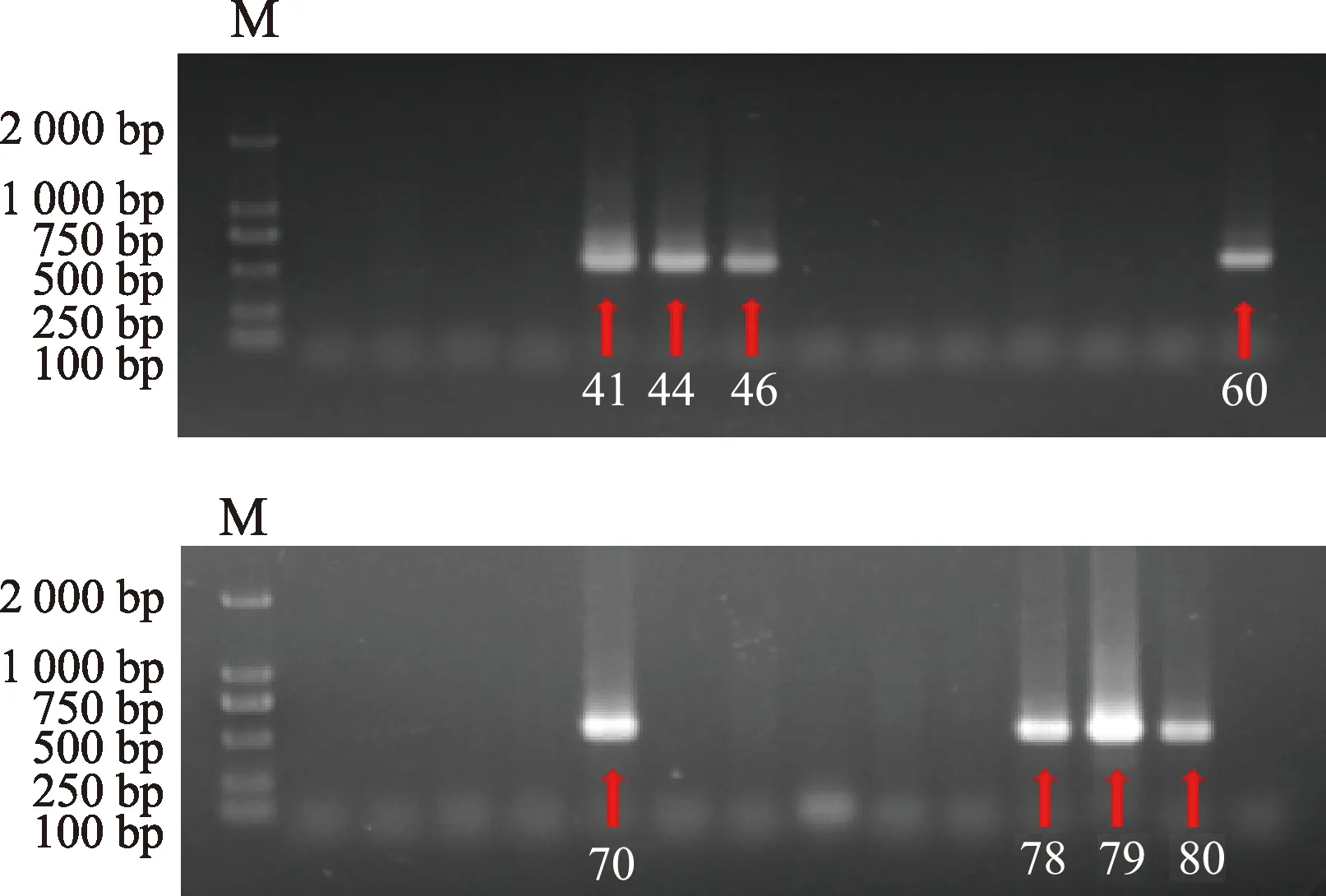
M:DNA标准参照物
指环病毒科病毒是一种无包膜、环状、单链DNA病毒,基因组长度为2.1~3.9 kb[7],基因组GC含量较高,一般含有3~4个开放阅读框,可细分为细环病毒(TTV),小细环病毒(torque teno mini virus, TTMV),中细环病毒(torque teno midi virus, TTMDV)等[8-9]。指环病毒可以在许多不同宿主中被检测到,包括人类、家畜、家禽等,虽然指环病毒在人类和动物中广泛流行并被怀疑与某些人类或动物的疾病相关,具有较高的遗传多样性,但其病原学作用尚未明确[10-12]。在指环病毒家族中,细环病毒和中细环病毒被认为与发热有关[13]。本研究通过对所构建的5个肺泡灌洗液文库进行深度测序,结果在各个文库中均未检测到常见的呼吸道病毒,例如呼吸道合胞病毒、巨细胞病毒、流感病毒等,而且1号文库病毒种类明显少于其他4个文库。这可能与文库中相应的病毒滴度过低,或者文库构建不佳有关。文库构建过程中的过滤及核酸的消化对DNA产量有着较大的影响,而增加测序深度可以在一定程度上减少文库对最终结果的影响。从病毒群落组成上看,除去未分类科病毒,文库中的病毒群落以指环病毒科病毒为主体,占整体文库的19.4%,其次为圆环病毒科、藻去氧核糖核酸病毒科、人类内源性逆转录病毒科、痘病毒科等。从各病毒序列数上看,指环病毒科序列数量在4个文库中较高,占总体序列数的45.0%;痘病毒科存在于所有文库中,是除指环病毒科之外序列数最多的病毒;5号文库中帚状病毒科序列数最多,为659条,2号文库中仅有1条,其他3个文库为0;小RNA病毒科仅存在于1号和4号文库,并且序列数很少。
综合分析后发现:指环病毒科病毒占总体文库的19.4%,同时存在于4个文库中,分布广泛。从病毒种类来看,样本中指环病毒所占比例明显高于其他病毒科,从高通量测序结果上看,共产生了2 207条与指环病毒科有关的序列,远远大于其他病毒科,并且通过拼接组装产生了4条较长的序列,具有进一步分析研究的意义。文库中痘病毒科病毒主要是牛痘病毒及猴痘病毒,分布于所有文库中并且具有较多的序列数量。痘病毒可以通过接触或呼吸道传播,感染后可能出现发热的症状,但是常伴有典型的皮肤症状[14],易于鉴别诊断。本研究中痘病毒序列数量较多,但是拼接后产生的最大重叠序列仅有200~300 bp,通过Blast X比对后均未产生有意义的结果。帚状病毒科病毒作为植物病毒,与其相关的序列数虽然较多,但是集中在5号文库中,考虑可能是由实验过程中的污染造成的。虽然圆环病毒科、藻去氧核糖核酸病毒科、逆转录病毒科也占有一定比例,但是与它们相关的序列数少,样本中病毒滴度低,同时逆转录病毒普遍存在于人类基因组中,一般情况下无致病性,所以认为这些病毒与不明原因发热的相关性并不高。小RNA病毒仅存在于1号和4号文库中,只占病毒总体的0.6%,并且其序列数较少,但小RNA病毒是病毒性肺炎的常见病原体之一[15],为了探究其与疾病之间的关系,故同样对其进行阳性样本筛选及分析。
本研究对5个肺泡灌洗液文库进行测序,结果表明指环病毒在2、3、4、5号文库中所占比例较高,对测序结果进行分析后通过Blast N比对后确定指环病毒科中以细环病毒为主,并且与其相关的序列数量及最大重叠序列均明显高于其他病毒科。对用于文库构建的58份样本进行阳性筛选后,共发现6份细环病毒阳性样本(10.3%),后期采集的22份肺泡灌洗液样本中筛选出阳性样本3份(13.6%)。虽然不同时间段感染的病毒群落可能不完全相同,但后期收集的样本仅用于流行病学分析,并且两次取样的阳性率是相似的,所以计算后80份样本中细环病毒的阳性率为11.3%。因健康者肺泡灌洗液样本较难获取,而咽拭子中微生物种类与肺泡灌洗液相似[16],故选取健康者咽拭子作为阴性对照,在40份咽拭子样本中共有2份阳性,阳性率明显低于肺泡灌洗液中细环病毒阳性率。既往有文献对瑞士71例不明原因感染的肺移植患者的肺泡灌洗液及血液进行病毒宏基因组学分析,发现在患者血液和肺泡灌洗液中同时存在大量的细环病毒,并且病毒载量随着患者免疫功能的下降而增多[17]。McElvania TeKippe等[13]报道在发热儿童的血液中检测到细环病毒,并且随着体温的升高细环病毒的检出率也会随之升高。对比既往相关文献结果可以发现不论在血液或者是肺泡灌洗液中,细环病毒是一种容易被检测到的病毒,并且病毒的载量会随着患者发热程度或是免疫情况的改变而发生变化。在本研究中细环病毒在不明原因发热患者中的阳性率(11.3%)高于阴性对照中的阳性率(5.0%),同时结合测序的结果,认为不明原因的发热与细环病毒存在一定的联系。虽然细环病毒可以导致呼吸道疾病[18],但并不认为是由于细环病毒感染呼吸道而引起的发热,可能是发热在一定程度上为细环病毒的复制提供了一个良好的环境。同时患者多为高龄人群,免疫系统功能减弱及炎症环境均可以促进细环病毒的感染、增殖[17,19]。据报道细环病毒可以作为免疫功能低下的标志[20],但细环病毒感染是否可以导致肺炎及其致病性还有待研究。因指环病毒序列差异很大,所以基于指环病毒全基因组来构建系统发育树是困难的[5]。指环病毒主要包含ORF1和ORF2,ORF1主要负责编码病毒复制相关蛋白(Rep),ORF2编码病毒衣壳蛋白(Cap)[21]。为了确定文库中所测得的细环病毒序列与其他指环病毒的关系,我们根据ORF1氨基酸序列,在基因库中进行Blast N比对得到具有代表性的指环病毒,一同进行系统发育分析。分析后发现本研究中检测到的4株细环病毒均属于同一进化分支,HTTVL1与细环病毒(AB017610)聚集,HTTVL2与细环病毒(ANQ39345)聚集,而HTTVL3的ORF1与细环病毒(AHN50432)的同源性最高,为93.3%,HTTVL4与细环病毒13型(YP009505717)聚集,它们分别来源于肝炎患者及艾滋病患者的血浆,并且测序所得的序列与基因库中已知病毒序列的同源性皆为90.0%左右,可以看出它们与来自人类血浆的细环病毒高度同源。
小RNA病毒科是一种单股正链RNA病毒,其RNA本身就具有感染性[22],是病毒性肺炎的常见病原体之一。该病毒科主要包括4个病毒属:鼻病毒属(rhinovirus)、肠道病毒属(enterovirus)、心病毒属(cardiovirus)和口疮病毒属(aphthovirus)[23]。本研究中鼻病毒仅存在于1号及4号文库中,在所有样本中阳性率为10%,但是文库中病毒滴度很低,仅有5个序列,故考虑鼻病毒与不明原因发热相关性不高。
综上所述,本次研究利用病毒宏基因组学技术对不明原因发热患者肺泡灌洗液样本中的病毒群落进行了解析,病毒群落中指环病毒科占比最高,其中细环病毒与不明原因发热存在一定关系。研究结果为不明原因发热患者的诊断治疗及进一步相关研究提供了依据。
