右美托咪定复合多巴胺对失血性休克大鼠肠道黏膜细胞形态及屏障功能的影响
2020-09-21鲁金钢唐玲玲杨慧玲
鲁金钢 唐玲玲 杨慧玲
肠道是血供丰富的器官,循环血容量不足时,也是最先受累的器官之一[1-2]。右美托咪定是一种高选择性α2受体兴奋剂,有研究发现右美托咪定可减轻肠道缺血再灌注损伤[3]。多巴胺是重要的肠道神经递质[4],以多巴胺为介质的脑肠轴对肠道有重要的保护和调节功能[5]。本实验以大鼠肠道黏膜细胞为对象,在失血性休克常规容量复苏的基础上,采用右美托咪定复合多巴胺作为辅助治疗,评估右美托咪定联合多巴胺对失血性休克大鼠肠道黏膜细胞形态及屏障功能的影响。
1 材料和方法
1.1 实验动物及仪器 30周健康 Waster大鼠72只,雌雄各半,重量246~376 g,购自浙江大学医学动物所,喂食含有少许动物肉的颗粒饲料,饮用消毒无菌水。MPA-150型生物信号分析系统(第二军医大学研制)及配套的电子计算机,架盘药物天平BP-n型(上海市医疗仪器八厂)。
1.2 实验分组及方法 采用随机数字表法分为对照组、容量复苏组及研究组,每组24只。对照组不予失血性休克处理;容量复苏组及研究组实验前12 h开始禁食,但不禁水,按体重予10%水合氯醛腹腔内注射麻醉。麻醉成功后将大鼠仰卧固定在手术用鼠板上,暴露右颈内静脉后置入特制的经肝素灌注的硬膜外导管至右心室,接肝素帽后丝线缝扎固定,硬膜外导管头端作为静脉通道,供放血、输液及给药用。暴露气管后,寻找左颈内动脉,将其与临近组织剥离,置入经肝素灌注的硬膜外导管,颈内动脉插管接经调零的MPA-150型生物信号分析系统的传感器,连续监测血压,包括收缩压、舒张压及平均动脉压。动物静置15 min后开始放血,放血至达失血性休克水平,即平均动脉压下降到40 mmHg,并维持60 min。在此基础上,容量复苏组以6%羟乙基溶粉(HES 200/0.5)与乳酸钠林格液1∶3的比例容量复苏,30 min输注完毕;研究组在容量复苏组输液基础上,给予右美托咪定1 μg/kg及多巴胺3 μg/kg。3组均在实验开始24 h时先采集动脉血做血气分析,然后开腹,剪取回肠约3 cm,固定于10%的甲醛溶液中备病理检查。实验结束前,用导尿管抽出膀胱内尿液,计算尿量。
1.3 肠黏膜组织形态学改变 剪取固定于10%甲醛溶液中的回肠1.5 cm,经脱水后石蜡包埋、切片,HE染色,中性树胶封片,然后光学显微镜下观察肠黏膜组织形态学改变。
1.4 细菌肠道外位移情况 采用普通琼脂倾注平板法,于实验开始24 h时,采集动脉血液1 ml及肝脏和肠系膜淋巴结适量,接种于普通琼脂倾注培养板,在37℃下培养48 h,若培养物中菌落数≥1 000为细菌培养阳性,即有细菌向肠道外组织位移。
1.5 其他观察指标 比较对照组、容量复苏组和研究组体重有无统计学差异。比较容量复苏组和研究组失血量,失血前及再灌注后血压,尿量,实验开始24 h时动脉血 pH、PaCO2、PaO2、动脉血氧饱和度(SaO2)、红细胞压积(Hct)、Hb及碱剩余(BE)有无统计学差异。
1.6 统计学处理 采用SPSS 18.0统计软件。符合正态分布的计量资料以表示,两组间比较采用两独立样本t检验;多组间比较采用单因素方差分析,两两比较采用LSD-t检验。不符合正态分布的计量资料以M(P25,P75)表示,多组间比较采用Kruskal-Wallis H检验。计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠体重、失血量、失血前及再灌注后血压、尿量比较 对照组、容量复苏组和研究组大鼠体重分别为(285.10±31.97)、(285.88±21.76)和(284.25±26.51)g,3组比较差异无统计学意义(P>0.05)。容量复苏组和研究组大鼠失血量、失血前及再灌注后血压比较差异均无统计学意义(均P>0.05);研究组大鼠尿量多于容量复苏组,差异有统计学意义(P<0.05),见表 1。
2.2 3组大鼠血气分析指标比较 3组大鼠pH、PaO2、SaO2和BE比较差异均无统计学意义(均P>0.05);对照组大鼠PaCO2水平高于容量复苏组和研究组,研究组大鼠PaCO2水平低于容量复苏组,差异均有统计学意义(均P<0.05);对照组大鼠Hct、Hb水平均高于容量复苏组和研究组,研究组大鼠Hct、Hb均高于容量复苏组,差异均有统计学意义(均P<0.05),见表2。
2.3 3组大鼠肠黏膜组织形态学改变比较 对照组大鼠肠绒毛结构完整,上皮层细胞排列整齐、紧密,间或有杯状细胞,黏膜间质少量中性粒细胞,细胞间少量淋巴浸润,腺体结构未见异常,固有层密集未见损伤。容量复苏组大鼠肠绒毛结构损伤,顶端下间隙增宽,肠绒毛结构严重破坏,组织淤血,肠绒毛顶部上皮细胞的坏死、脱落固有层充血水肿明显,并见较多淋巴细胞及中性粒细胞浸润,大量炎症细胞浸润等病理变化。研究组大鼠肠绒毛结构基本完整,绒毛顶端下间隙增宽,少量红细胞淤积,炎症细胞浸润,明显淤血,见图1。
2.4 容量复苏组和研究组大鼠细菌肠道外位移情况比较 研究组肠系膜淋巴结、血液及肝脏的细菌位移发生率均低于容量复苏组,差异均有统计学意义(均P<0.05),见表3。

表1 容量复苏组和研究组大鼠一般资料比较
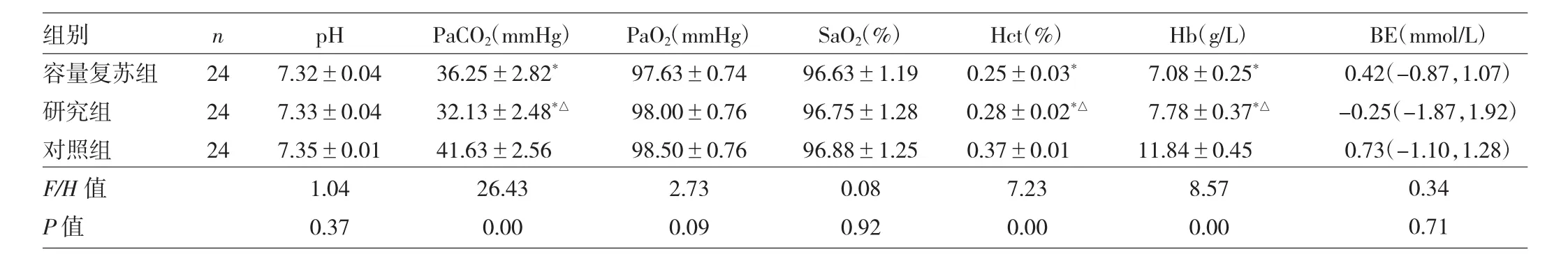
表2 3组大鼠血气分析指标比较

图1 3组大鼠肠黏膜组织形态学改变(a:对照组;b:容量复苏组;c:研究组;HE染色,×200)

表3 容量复苏组及研究组大鼠细菌肠道外位移发生率比较[例(%)]
3 讨论
失血性休克时,肠道是最先受累的器官;在失血性休克早期恢复血供后,肠道血循环又迟于全身血循环恢复;在肠道微循环恢复后,由于大量炎症因子被激活,又可发生缺血再灌注损伤[6-7]。由于肠道供血供氧减少,肠道黏膜细胞肿胀、变性、坏死,细胞间紧密部松弛、间隙增宽,细胞间通透性增加,导致肠道黏膜细胞及黏膜屏障功能受损。
本研究病理切片发现,容量复苏组及研究组大鼠肠道黏膜绒毛上皮细胞均有不同程度受损,说明失血性休克对大鼠肠道黏膜有明显损伤作用。同时本研究发现研究组大鼠肠道黏膜损伤轻于容量复苏组,说明在液体复苏的基础上,右美托咪定复合多巴胺对失血性休克大鼠肠道黏膜有明显保护作用。上述保护作用的机制有4方面,一是右美托咪定通过抗炎、抗氧化、抗应激及降低交感神经张力,降低了肠道黏膜细胞NO浓度;二是右美托咪定通过抑制细胞凋亡及中性粒细胞聚集,减轻了肠道缺血再灌注损伤;三是多巴胺通过扩张肠道上皮细胞微循环,改善肠道pH,减少了细胞的损伤;四是右美托咪定和多巴胺,两者在改善肠道细胞内环境,创造快速修复条件方面,发生了协同作用。
由于肠道屏障功能受损,导致肠道内的细菌及内毒素向肠外位移。肠道黏膜缺血的时间越长,细胞损害及萎缩凋亡程度越大,细菌及内毒素向肠外位移越多[8],肠系膜、肝脏、肾脏及脾脏是肠道内细菌肠道外位移的最常见器官[9-10]。研究组肠系膜淋巴结、血液及肝脏的细菌位移发生率均低于容量复苏组,说明在液体复苏的基础上,右美托咪定复合多巴胺能明显减少失血性休克大鼠肠道内细菌向肠道外位移,从另一个侧面证明了两者复合对肠道黏膜的保护效应。该保护作用的机制有三方面,首先是右美托咪定通过降低肠道细胞NO浓度,减少过亚硝酸根离子产生,在肠道黏膜损伤的起始阶段即发挥保护作用;其次是右美托咪定通过抑制炎症因子前列腺素E2、TNF-α及IL-6的释放[11-12],保护肠道黏膜细胞;第三,研究发现胃食管连接处、胃、小肠、结肠的上皮组织、固有层细胞和平滑肌层以及胃肠道血管壁存在多巴胺受体DA2,说明多巴胺对肠道细胞同样有着重要作保护作用[13]。
综上所述,本研究认为在常规容量复苏的基础上,右美托咪定复合多巴胺对失血性休克大鼠肠道黏膜上皮细胞及屏障功能有明显保护作用。
