芬戈莫德联合阿替普酶静脉溶栓治疗对缺血性脑卒中患者脑血流动力学、血清炎症因子及神经功能缺损的影响
2020-09-16崔凌
崔 凌
(郑州人民医院神经内科,河南 郑州 450000)
急性缺血性脑卒中(AIS)是中老年人常见的脑卒中类型,及时的血流恢复能够有效改善患者长期预后[1]。对于符合《中国急性缺血性脑卒中诊治指南》(2018年版)[2]的患者,在AIS发病的3~4.5 h内给予阿替普酶静脉治疗能够有效缓解其临床症状,减少病死率。然而,由于阿替普酶的应用时间窗较为狭窄(发病4.5 h内),加之阻塞的脑动脉再通后伴随的再灌注损伤,给临床应用带来了巨大障碍[3]。芬戈莫德是一类作用于鞘氨醇-1-磷酸(SIPR)的鞘氨醇类似物,在机体内磷酸化后和淋巴细胞SIP受体结合,更改淋巴细胞迁移路线,阻止其进入淋巴组织以外区域,从而避免其浸润中枢神经系统,实现免疫抑制[4]。本研究探讨芬戈莫德联合阿替普酶静脉溶栓治疗对缺血性脑卒中患者脑血流动力学、血清炎症因子及神经缺损功能的影响,现报道如下。
1 资料与方法
1.1 一般资料我院2018年2月至2019年2月收治的187例AIS患者,纳入标准:①符合牛津郡社区卒中项目(OCSP)部分前循环梗死、完全前循环梗死亚型标准[5]。②MRA或CTA显示大脑后动脉及颈内动脉狭窄率≥50%。③发病时间≤4.5 h。排除标准:①入组1个月内有手术创伤史。②其它类型脑血管异常或颅内出血。187例患者按照治疗方法不同分为A组(92例)和B组(95例)。A组男51例,女41例,年龄53~79岁[(62.48±3.61)岁]。B组男52例,女43例,年龄55~80岁[(62.66±3.58)岁]。两组患者性别、年龄等一般资料比较,差异无统计学意义(P> 0.05),本研究经医院伦理委员会批准通过。
1.2 研究方法A组接受阿替普酶静脉溶栓治疗。溶栓治疗前控制患者血压≤180/110 mmHg,若血压过高,则可先给予拉贝洛尔(江苏迪赛诺制药有限公司,批准文号H32026120,规格50 mg×30s)静脉泵注降压。给予阿替普酶(德国勃林格殷格翰公司,批准文号S20110051,规格50 mg/支)治疗,剂量为0.9 mg/kg,最大剂量≤90 mg,首先以总剂量10%静脉团注,剩余剂量以0.9%生理盐水100 ml稀释后静脉滴注,滴注时间为1 h。治疗过程中密切监测患者体温、心率、血压、呼吸、神智、瞳孔变化等生命体征情况。B组接受芬戈莫德联合阿替普酶静脉溶栓治疗。阿替普酶静脉溶栓治疗同A组,给予芬戈莫德(Gilenya,瑞士Novartis制药公司,规格0.5 mg/粒)0.5 mg,于溶栓前口服,每日1次,连续服用3天。治疗过程中密切监测患者体温、心率、血压、呼吸、神智、瞳孔变化等生命体征情况。
1.3 观察指标①脑血流动力学指标:分别于治疗前、治疗3 d后采用脑血管功能检测仪(上海神州高特医疗器械有限公司 GT-3000)对两组患者进行无创性脑血管血流动力学检测,探头频率为5.0 MHz,检查并记录两组平均流速(Vmean)、最大峰值流速(Vmax)、血管搏动指数(PI)、血管阻力指数(RI);②血清炎症因子:于治疗前、治疗3 d后采用酶联免疫吸附法(试剂盒由上海晶抗生物工程有限公司提供)检测两组白介素-6(IL-6)、IL-8、肿瘤坏死因子(TNF-α)水平,采用免疫比浊法(试剂盒由上海威奥生物科技有限公司提供)检测两组C反应蛋白(CRP)水平;③神经功能缺损及预后:于治疗前、治疗3 d后采用临床神经功能缺损(MESSS)量表评估两组患者神经功能缺损情况,轻型:0~15分,中型:16~30分,重型:31~45分。发病后3个月,采用改良Rankin量表(MRS)评估两组患者预后情况,自理:0~2分,依赖:3~5分;④不良反应:主要包括消化道出血、心绞痛、心悸、恶心呕吐、畏冷寒战、高热等。
1.4 统计学方法采用SPSS 19.0统计学软件分析数据。计数资料比较采用χ2检验或Fisher精确检验,计量资料比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组脑血流动力学指标比较治疗前,两组Vmean、Vmax、PI、RI水平差异无统计学意义(P> 0.05),治疗3 d后,两组Vmean、Vmax水平均显著提升,B组高于A组(P<0.05),PI、RI水平显著下降,且B组低于A组(P<0.05),见表1。
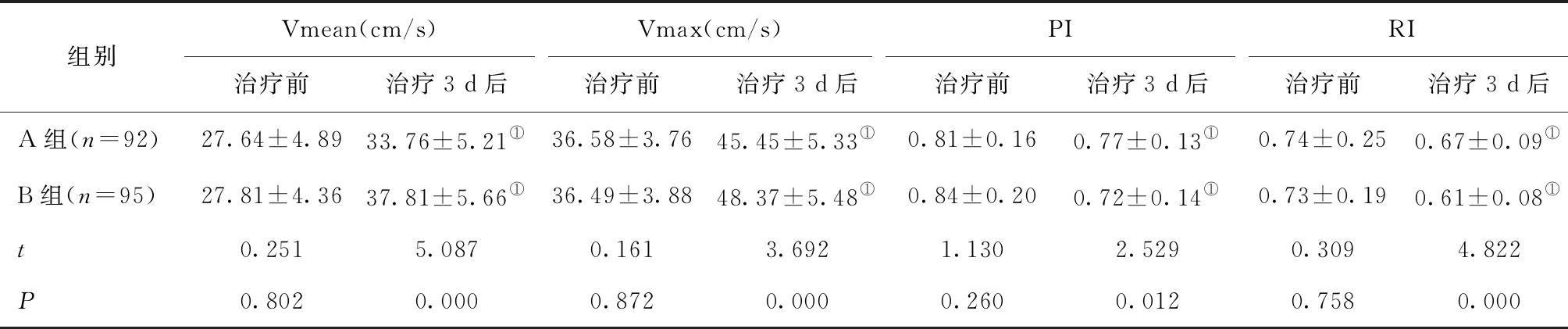
表1 两组脑血流动力学指标比较
2.2 两组血清炎症因子比较治疗前,两组IL-6、IL-8、TNF-α、CRP等指标水平差异无统计学意义(P> 0.05),治疗3 d后IL-6、IL-8、TNF-α、CRP水平均显著下降,且B组低于A组(P<0.05),见表2。

表2 两组血清炎症因子比较
2.3 两组神经功能缺损及预后情况比较治疗前,两组MESSS、MRS评分差异无统计学意义(P> 0.05),治疗3 d后,两组MESSS评分均明显降低,且B组低于A组(P<0.05);发病后3个月,两组MRS评分均降低,且B组低于A组(P<0.05),见表3。

表3 两组MESSS、MRS评分情况比较 (分)
2.4 两组不良反应比较两组消化道出血、心悸、恶心呕吐、畏冷寒战、高热等不良反应发生率比较,差异无统计学意义(P> 0.05),见表4。

表4 两组不良反应比较 [n(%)]
3 讨论
AIS的发病是由多种因素引起的脑血管闭塞或狭窄,导致脑血流速放缓,继而出现缺氧、缺血及坏死,最终导致AIS,因而改善脑血管血流动力学、提高缺血脑组织供血并降低神经元损伤是治疗AIS的关键[6]。阿替普酶是1996年以来唯一被FDA认证的用于AIS溶栓治疗的重组组织型纤维型蛋白酶原激活剂,通过赖氨酸残基和纤维蛋白结合,诱导纤维酶原转化为纤溶酶,降解纤维蛋白,实现血栓溶解,应用该药物进行溶栓治疗成为各国AIS治疗指南推荐的方法[7,8]。然而狭窄的治疗时间窗、较低的大血管再通率及较高的出血风险极大限制了阿替普酶的应用范围,其溶栓治疗率普遍不足10%[9]。芬戈莫德是由经典中草药冬虫夏草中提取的有效成分-多球壳菌素(ISP-1)经改变其侧链及除去手性中心后合成的鞘氨醇-1-磷酸(SIPR)受体调节剂,对于天然免疫和适应性免疫系统、神经系统具有调节作用[10]。
本研究采用芬戈莫德联合阿替普酶静脉溶栓治疗,将单一阿替普酶静脉溶栓治疗设为对照,比较两组脑血流动力学指标,结果显示,B组Vmean、Vmax水平显著较A组提高,PI、RI水平较A组显著降低。PI反应的是脑动脉弹性及顺应性,AIS患者由于管壁狭窄、硬化、血管内膜受损等原因会造成脑动脉弹性及顺应性降低,PI升高[11];RI反应的是血管的舒张及阻力情况,患者由于脑动脉出现长期病理性改变,血管弹性降低,阻力增大[12]。本研究结果说明联合治疗组能够更好地加大患者脑动脉血流灌注,增加血管弹性,减少阻力,促进脑血流动力学的改善。AIS患者血栓形成后脑组织由于缺血缺氧及脑水肿等原因会刺激氧化应激反应的扩大,引发炎性因子的合成分泌有所增加,而明显的全身性炎性反应能对机体尤其是神经细胞造成损伤,导致病情加重、预后变差[13]。本研究对比发现B组的IL-6、IL-8、TNF-α、CRP水平均显著较A组降低,说明其对炎性因子的抑制作用更佳明显。分析其中的原因可能是芬戈莫德可以激活小胶质细胞、调控受损后的髓鞘形成,调控神经前体细胞的增殖并迁移至受损区域,加强生长因子以调节神经元存活、分化、外延扩展,从而有效清除中枢神经系统中的损坏神经、斑块、感染物质,起到抗凋亡及抗炎作用[14]。本研究神经功能缺损及预后情况评估显示,B组MESSS、MRS评分均显著低于A组,说明前者的神经功能缺损优于后者,预后情况也更良好,印证了炎症反应的有效抑制对于神经功能的保护具有正向作用。
两组患者消化道出血、心悸、恶心呕吐、畏冷寒战、高热等不良反应发生率无显著差异,说明联用芬戈莫德后不会增加药物不良反应,安全性较高。
综上,对AIS患者应用芬戈莫德联合阿替普酶静脉溶栓治疗,可有效改善患者脑血流动力学指标,缓解炎症反应,减小神经功能缺损,疗效显著,安全可靠,值得推广应用。
