两种不同方法制备达卡巴嗪脂质体的比较研究
2020-09-16王丽,何林
王 丽,何 林
(1.四川省南充市中心医院药学部,四川 南充 637000;2.四川省医学科学院·四川省人民医院药学部,药物临床试验中心,四川 成都 610072)
达卡巴嗪是转移性黑色素瘤的一线化疗药物[1~3],在临床上广泛用于恶性黑色素瘤的治疗。达卡巴嗪临床使用中也存在一些显著缺陷,包括剂型单一,稳定性差,患者顺应性低,不良反应严重,对脑转移无效等[4~7]。脂质体(Liposome,LP)是由磷脂分散在水中经自组装形成的双层或多层封闭囊泡。将脂质体用作药物载体在肿瘤诊疗方面受到广泛关注,用脂质体包封抗肿瘤药物,与游离药物相比,疗效增强,毒副作用减弱[8~10]。因此,针对达卡巴嗪临床使用中的问题,我们设想将达卡巴嗪用脂质体进行包封,以期提高达卡巴嗪的疗效,降低其不良反应。本研究于2016年7月至2017年7月,以大豆卵磷脂和胆固醇作为原料,依据实验室条件和预实验结果,分别选择了逆向蒸发法和硫酸铵梯度法制备达卡巴嗪脂质体,以包封率为评价指标进行了单因素实验和正交实验,以筛选达卡巴嗪脂质体的最佳制备处方和工艺。
1 材料与方法
1.1 仪器N-1200 A旋转蒸发仪(东京理化器械株式会社);SB-1200恒温水浴锅(东京理化器械株式会社);JY92-IIDN超声波细胞破碎机(宁波新芝生物科技股份有限公司);磁力搅拌器(上海司乐仪器厂);Universal 320R台式离心机(德国Hettich科学仪器公司);UV-1700紫外分光光度仪(日本岛津制作所);BP211D电子天平(德国赛多利斯公司);动态光散射纳米激光粒度仪(Malvern Zetasizer Nano ZS90);透射电子显微镜(美国FEI公司)。
1.2 试药及材料达卡巴嗪(批号:c02-20161209,苏州立新制药有限公司);大豆卵磷脂(批号:2016012001,成都市科龙化工试剂厂);胆固醇(批号:2014071401,成都市科龙化工试剂厂);乙醚(分析纯,批号:2016100901,成都市科龙化工试剂厂);甲醇(色谱纯,批号:R141293,规格:4L,成都市科龙化工试剂厂);硫酸铵(批号:2017010101,成都市科龙化工试剂厂);MW3500透析袋(中国Bioshap公司);Amicon© Ultra-0.5 10K 超滤管(默克密理博公司)。
1.3 方法
1.3.1紫外分光光度法测定达卡巴嗪含量 紫外吸收波长的选择:精密称取达卡巴嗪2.5 mg,用甲醇于25 ml棕色容量瓶定容,得0.1 mg/ml的达卡巴嗪甲醇溶液,作为储备液。定量吸取达卡巴嗪储备液1.6 m于10 m棕色容量瓶,用甲醇定容,得16 μg/ml达卡巴嗪甲醇溶液,在紫外光区200~400 nm作全波长扫描,确定最大吸收波长为324 nm,作为测定波长。
标准曲线的建立:分别取相应体积达卡巴嗪储备液,于10 ml容量瓶用甲醇定容,配制成浓度为20、16、10、5、2.5、1.25 μg/ml的系列标准溶液。以甲醇溶液为空白,在324 nm波长下测定各浓度的紫外吸收光度值。以达卡巴嗪浓度(μg/mL)为横坐标,吸光度值为纵坐标建立达卡巴嗪标准曲线,进行线性回归,回归方程为y=0.0529x+0.0052,R2=0.9975。
1.3.2脂质体包封率的测定 采用超滤离心法分离脂质体混悬液中的脂质体和游离药物溶液。取400 μl脂质体混悬液于超滤离心管(滤膜孔径为10K)中,以6000 r/min离心10 min,外管中超滤液即为未被脂质体包封的游离药物溶液。取30 μl超滤液,用3 ml甲醇溶解稀释,用紫外分光光度法测定其达卡巴嗪浓度,即为脂质体混悬液中的游离药物浓度;取等体积(30 μl)脂质体溶液,3 ml甲醇溶解破乳,同法测定药物浓度,即为脂质体混悬液中的药物总浓度。按公式1计算包封率,按公式2计算载药量。

(公式1)

(公式2)
1.3.3逆向蒸发法制备工艺 精密称取大豆卵磷脂和胆固醇于圆底烧瓶中,用乙醚溶解,加入达卡巴嗪水溶液,用细胞破碎仪超声5 min使其乳化,然后减压旋转蒸发20 min除去乙醚,逐渐形成凝胶,加入适量磷酸盐缓冲溶液(PBS),继续旋蒸20 min,使器壁上的凝胶完全脱落,形成浓度适宜的脂质体混悬液,再次用细胞破碎仪超声,即制得得粒径均匀的达卡巴嗪脂质体混悬液。
1.3.4单因素实验 以脂质体包封率为指标,用逆向蒸发法制备达卡巴嗪脂质体,固定其他因素不变,分别考察药物与磷脂质量比、磷脂与胆固醇质量比、内水相体积、有机相内水相体积比,以及磷脂浓度等处方因素比对包封率的影响,找出影响包封率的主要因素。
1.3.5正交实验 根据单因素实验结果,设计正交实验。以包封率为指标,对实验结果进行极差分析,所得最佳因素水平组合,即为逆向蒸发法制备达卡巴嗪脂质体的最佳处方。
1.3.6硫酸铵梯度法制备工艺 精密称取大豆卵磷脂30 mg,胆固醇5.1 mg,加入3 ml乙醚溶解,47 ℃旋转减压蒸发成膜后,加入4 ml 0.2 mol/L硫酸铵溶液,47 ℃旋蒸将脂质膜水化成脂质体混悬液,将混悬液用细胞破碎仪探头超声(2 s,2 s,5 %,5 min),即得空白脂质体。将空白脂质体置于透析袋(MW3500)中于400 ml超纯水中透析,形成硫酸按梯度。向空白脂质体中加入处方量达卡巴嗪,47 ℃水浴条件下孵育20 min,即得达卡巴嗪脂质体混悬液。
1.3.7实验筛选处方工艺 本部分实验每组实验数据均是平行条件下同时制备3份样品所测得的平均值。①磷脂胆固醇比的影响:固定其他因素不变,研究磷脂胆固醇摩尔比分别为1∶1,2:1,3∶1时脂质体包封率的变化。②药脂比及硫酸铵浓度的影响:固定其他因素不变,研究硫酸铵浓度分别为0.1、0.2、0.3、0.4 mol/L和药物磷脂质量比分别为1∶30、1∶15、1∶10、1∶7.5时脂质体包封率的变化。③透析液种类的影响:保持其他条件不变,分别研究以纯化水,10%蔗糖溶液,磷酸盐缓冲液(PBS7.4),0.9% NaCl溶液,5%葡萄糖溶液作为透析液时脂质体包封率的变化。④透析时间的影响:以5%葡萄糖溶液为透析液,固定其他条件不变,研究透析时间长短对脂质体包封率的影响。⑤孵育温度和时间的影响:保持其他实验条件不变,在温度分别为37 ℃、47 ℃、57 ℃水浴条件下孵育10、20、30、40 min进行载药,测定包封率,确定最佳孵育温度和时间。
1.3.8达卡巴嗪脂质体的性质表征 采用负染法处理样品,用透射电子显微镜观察达卡巴嗪脂质体的微观形态。应用马尔文动态光散射纳米激光粒度仪测定卡巴嗪脂质体的粒径、分布及Zeta电位值。
2 结果
2.1 逆向蒸发法制备达卡巴嗪脂质体
2.1.1单因素实验 实验结果显示影响包封率的主要因素有药物磷脂质量比,药物胆固醇比,有机相与内水相比以及磷脂浓度等4个因素。
2.1.2正交实验 4个因素分别设置三个水平,见表1。采用L9(34)正交表设计正交实验,见表2,逆向蒸发法制备达卡巴嗪脂质体的最佳处方见表3。经三次重复验证实验,测得该处方制得的脂质体包封率为(28.02±3.11)%,载药量为(2.71±0.32)%。

表1 正交设计的因素和水平表
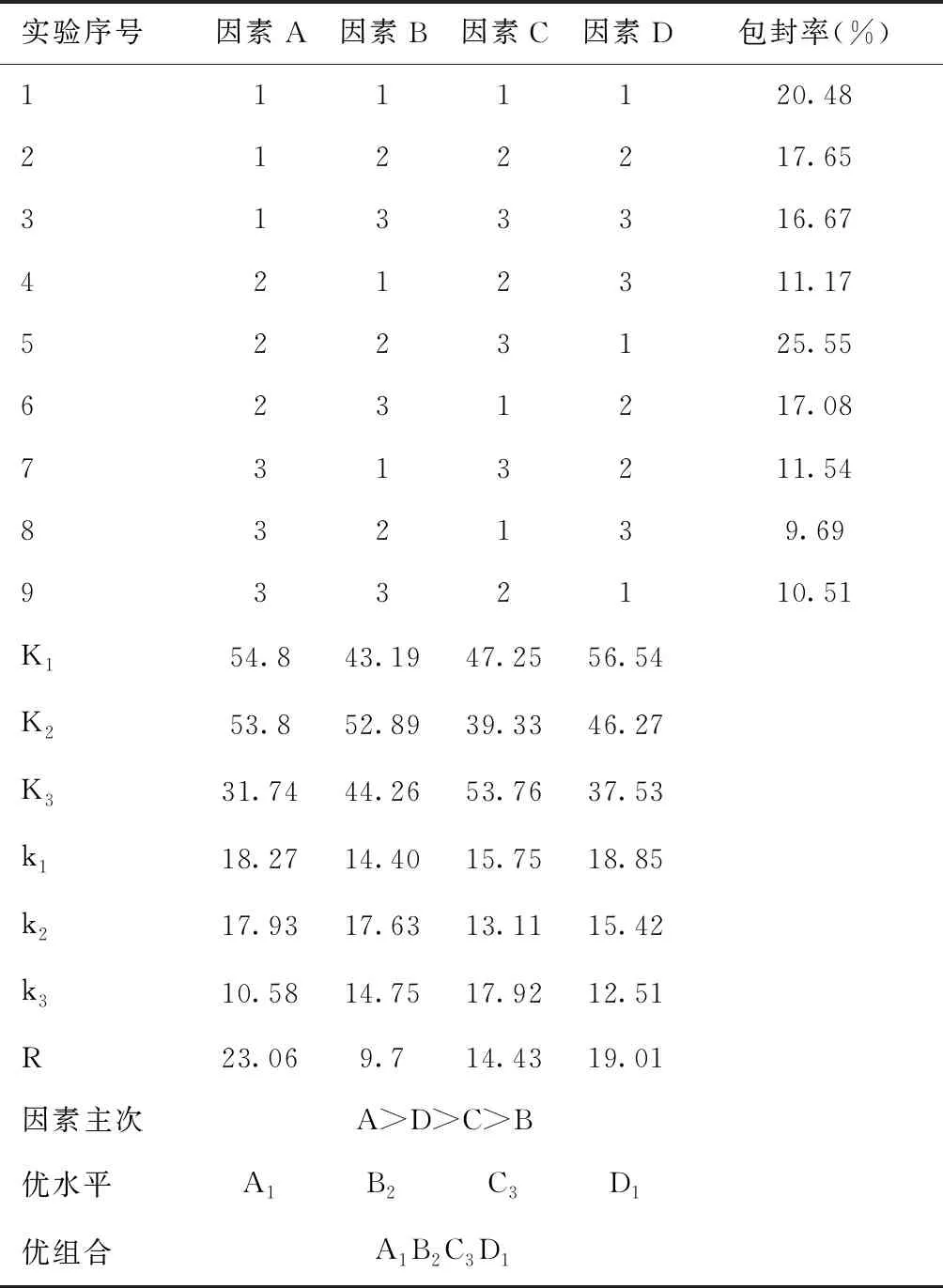
表2 正交设计实验结果

表3 逆向蒸发法最佳处方(n=3)
2.2 硫酸铵梯度法制备达卡巴嗪脂质体
2.2.1磷脂胆固醇比的影响 磷脂胆固醇摩尔比由1∶1增大到3∶1,包封率由35.50%增加到42.90%。若继续增大磷脂胆固醇摩尔比,考虑到胆固醇比例过低可能会影响脂质体的结构稳定性,故确定硫酸铵梯度法制备脂质体的最终磷脂胆固醇摩尔比为3:1。见图1。
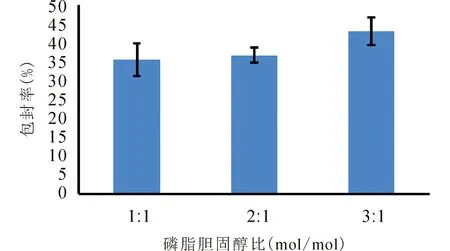
图1 磷脂胆固醇摩尔比对包封率的影响
2.2.2药脂比及硫酸铵浓度的影响 随着硫酸铵浓度由0.1 mol/L逐渐增加到0.3 mol/L,脂质体包封率呈增大趋势,当硫酸铵浓度增加为0.4 mol/L,包封率下降,因此确定0.3 mol/L作为硫酸铵梯度法的最佳硫酸铵浓度。在药物磷脂比的各个水平,随着药脂比增大,包封率逐渐下降,在药脂比为1:10时,包封率最低,药脂比继续增大为1:7.5时,包封率开始回升,但继续增大药脂比,包封率并未继续增大。综合考虑载药量因素后,选择药脂比1∶7.5作为最终药脂比。见图2。

图2 硫酸铵浓度及药物磷脂质量比对包封率的影响
2.2.3透析液种类的影响 10%蔗糖溶液与5%葡萄糖溶液作透析液的脂质体包封率较高,两者效果相当。考虑到配制的容易性,选择了5%葡萄糖溶液作为透析溶液。见图3。
2.2.4透析时间的影响 随着透析时间延长,脂质体包封率逐渐增大,透析时间为8小时时,包封率最高,当透析时间增加为10小时,包封率反而降低。故确定透析时间为8 h。见图4。

图3 透析液种类对包封率的影响

图4 透析时间对包封率的影响
2.2.5孵育温度和时间的影响 在37、47或57 ℃水浴条件下孵育10、20、30或40 min,脂质体包封率无明显差异。综合考虑到达卡巴嗪对热的不稳定性,最终选择40 ℃作为孵育温度,20 min作为孵育时间。见图5。

图5 孵育时间和温度对包封率的影响
根据实验结果确定硫酸铵梯度法制备达卡巴嗪脂质体的最终处方工艺见表4,经三次重复验证实验,测得其包封率为(63.67±2.04)%,载药量为(7.25±0.23)%。综上,硫酸铵梯度法处方工艺制备的达卡巴嗪脂质体包封率和载药量均显著优于逆向蒸发法的最佳处方,故将其作为达卡巴嗪脂质体的最终处方工艺。
2.3 达卡巴嗪脂质体的性质表征外观及形态:制得的达卡巴嗪脂质体混悬液质地均匀,呈半透明乳白色混悬液,有蓝色乳光,无分层,无沉淀。透射电子显微镜下脂质体形态如图6,单个达卡巴嗪脂质体呈规则的球形,外观圆整,大小均匀。粒径分布及Zeta电位:脂质体粒径呈近似正态分布,平均粒径142.2 nm,多分散指数(polydispersity index,PDI)为0.214,测得其Zeta电位值为-50.4 mV。见图7。

表4 硫酸铵梯度法的最终处方工艺(n=3)

图6 透射电镜下脂质体形态

图7 达卡巴嗪脂质体粒径分布
3 讨论
有文献报道达卡巴嗪是脂溶性化合物[11,12],但实验显示其不溶于氯仿、二氯甲烷,乙醚等有机溶剂,达卡巴嗪为亲水性化合物。亲水性化合物不易被脂质体包封,制得的脂质体包封率普遍偏低,包封率是其处方工艺难点,因此本实验选取包封率为考察指标。
达卡巴嗪脂质体制备预实验中,首先尝试使用薄膜分散法,其包封率始终在10%左右。有文献报道,逆向蒸发法适用于包裹水溶性药物和大分子生物活性物质如各种抗生素、胰岛素、免疫球蛋白、核酸等[13],因此尝试了逆相蒸发法制备达卡巴嗪脂质体,逆向蒸发法是将含药水溶液(水相)加入到溶有脂材的有机相中进行混合、超声,形成稳定的 W/O 型乳剂,然后减压旋蒸除去有机相,形成脂质体混悬液。对逆向蒸发法进行单因素考察,设计正交实验,获得最高包封率为(28.02±3.11)%,包封率依然偏低。分析原因可能是在进行减压旋蒸发形成脂质体混悬液的过程中,含药水相部分分成了脂质体外水相和内水相两部分,外水相中的药物占绝大部分,被脂质体包封于内水相中的药物只占小部分,所以包封率低。
达卡巴嗪难溶于纯水,易溶于酸性水溶液,为弱碱性化合物。将制备方法更换为pH梯度法,结果显示pH梯度法各处方工艺下制备的脂质体包封率均在10%~30%。硫酸铵梯度法是pH梯度法的衍生方法,适用于弱碱性药物[14~16],它是利用硫酸铵水溶液作为水相,然后通过透析使脂质体内水相中的硫酸铵浓度远大于外水相中硫酸铵浓度。由于 NH4 +解离成 H+和 NH3,NH3跨膜外溢速度远大于 H+,造成内水相 H+浓度增加,pH 值下降,形成 pH 梯度,产生药物主动装载驱动力,使弱碱性药物主动进入脂质体内水相中,使脂质体包封率较高。将pH梯度法更换为硫酸铵梯度法,包封率有显著增加,达到了(63.67±2.04)%。
制备高包封率的达卡巴嗪脂质体是课题后续实验的前提和基础,找到硫酸铵梯度法后,通过逐步单因素优化使包封率明显提高,鉴于时间关系,为了不影响后续实验部分的开展而没有对硫酸铵梯度法进行正交实验,这是本实验的一个缺失和遗憾,正交实验的开展可能使达卡巴嗪脂质体包封率进一步提高。
对达卡巴嗪脂质体的稳定性也进行了简单考察,在 4 ℃冰箱冷藏条件下脂质体放置一周后,混悬液外观无明显改变,包封率由63.67%下降为52.14%,放置两周后混悬液的光泽度和通透性下降,包封率进一步下降为46.95%。
综上,本文以包封率为指标,对比研究逆向蒸发法和硫酸铵梯度法两种方法制备达卡巴嗪脂质体,最终确定硫酸铵梯度法为达卡巴嗪脂质体的制备方法,筛选出最佳制备工艺,制得的达卡巴嗪脂质体包封率为(63.67±2.04)%,载药量为(7.25±0.23)%,为后续制备达卡巴嗪长循环脂质体及进一步的药动学和药效学研究创造了前提。
