多层螺旋计算机断层扫描及胃肠道肿瘤标志物对进展期胃癌和原发性胃淋巴瘤的鉴别诊断价值
2020-09-14王勇崔红领林运智崔庆周
王勇,崔红领,林运智,崔庆周
漯河医学高等专科学校第一附属医院(漯河市中心医院)影像科,河南 漯河462000
进展期胃癌(advanced gastric cancer,AGC)是指胃癌侵犯固有肌层及以下的胃癌,原发性胃淋巴瘤(primary gastric lymphoma,PGL)是原发于胃黏膜固有层和黏膜下层淋巴组织的恶性肿瘤,AGC和PGL影像表现相似,但是两者的治疗方式和预后存在很大差异[1-2],因此准确诊断非常重要。既往研究常常单纯从影像征象区分两者[3-5],易受诊断医师个人经验的影响且未结合临床资料。胃肠道肿瘤标志物对于胃肠道肿瘤的鉴别也具有重要的意义,因此本研究拟对比AGC和PGL的影像学征象及胃肠道肿瘤标志物的差异并评价影像学征象、胃肠道肿瘤标志物及二者联合的诊断效能,以探讨更好鉴别AGC和PGL的方法,现报道如下。
1 资料与方法
1.1 一般资料
收集2016年7月至2019年4月在漯河市中心医院经病理证实为AGC及PGL患者的病历资料。纳入标准:①符合诊断标准[6-7]且由病理证实;②确诊前有三期增强扫描图像,图像符合诊断要求,有完整胃肠道肿瘤标志物数据;③计算机断层扫描(CT)检查、实验室检查前未进行手术及放化疗。排除标准:①既往有胃肠道手术史;②既往有胃外淋巴瘤病史。根据纳入、排除标准,共纳入AGC 24例及PGL 15例。24例AGC患者中,男性10例,女性14例;年龄33~85岁,平均(66.00±13.07)岁。15例PGL患者中,男性7例,女性8例;年龄34~79岁,平均(58.40±10.96)岁。两组患者年龄、性别比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 检查方法
CT检查前所有患者均禁食6~8 h,检查前15 min饮水800~1000 ml。所有患者均使用Philips Brilliance 64排CT机扫描,采用仰卧位三期增强扫描,扫描范围自膈顶至耻骨联合,对比剂为碘佛醇(320 mgI/100 ml),剂量为1.5 ml/kg,注射速度3 ml/s,分别延迟30、60、120 s行动脉期、门脉期、延迟期扫描,扫描参数为管电压120 kV,管电流250 mA,层厚5 mm,螺距5 mm,薄层重建1 mm。
1.3 图像分析
病灶强化程度测量:由于相关研究表明AGC和PGL平扫与静脉期CT值有差异[5],因此本研究分别测量病变显示最佳层面平扫及静脉期CT值,测量时感兴趣区域(region of interest,ROI)置于病灶中央,避开坏死、囊变及血管结构,测量3次取均值,病灶强化程度为静脉期CT值与平扫CT值之差。
主观征象评估:由2名经验丰富的主治医师在不知道病理结果的情况下独立进行影像征象评估,意见不一致时,经过协商一致后记录主观评估结果。评估的内容主要包括:①胃周脂肪浸润,如果病变部位的浆膜层不光滑,周围脂肪间隙不清晰,可见软组织密度灶,则为胃周脂肪浸润,否则为阴性;②黏膜白线征,如果动脉期或门静脉期病灶近胃腔表面出现了增粗、带状、中断样,结节状明显强化[8],则为黏膜白线征阳性,否则为阴性;③腹腔淋巴结转移,如果发现腹腔淋巴结最小径大于10 mm,则为存在淋巴结转移,否则为阴性。
1.4 胃肠道肿瘤标志物检测
血清癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原 19-9(carbohydrate antigen 19-9,CA19-9)、糖类抗原 724(carbohydrate antigen 724,CA724)肿瘤标志物检测方法:患者空腹6 h以上,采集肘静脉血约4 ml,离心后取上清液,置于-20℃冰箱保存。采用美国贝克曼公司Access 2全自动电化学发光免疫分析仪,按试剂盒说明书严格执行操作,各项肿瘤标志物正常值参照说明书。正常参考值:CEA为0~4.7 ng/ml,CA19-9为0~39 U/ml,CA724为0~6.9 U/ml。统计患者术前胃肠道肿瘤标志物含量,超过正常参考值即为阳性。
1.5 统计学方法
采用SPSS 20.0和Med Calc 18.2-.1软件进行统计分析,计量资料以均数±标准差(x±s)表示,组间比较采用两独立样本t检验;计数资料以例数及率(%)表示,组间比较采用χ2检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线及曲线下面积(area under curve,AUC)评价诊断效能,并采用Delong检验比较诊断效能差异。以P<0.05为差异有统计学意义。
2 结果
2.1 AGC和PGL患者CT表现和胃肠道肿瘤标志物的比较
AGC和PGL患者CT表现中黏膜白线征、病灶强化程度比较,差异均有统计学意义(P<0.05),而胃周脂肪浸润、腹腔淋巴结转移情况比较,差异均无统计学意义(P>0.05)。AGC和PGL患者胃肠道肿瘤标志物中CEA比较,差异有统计学意义(P<0.01),而CA19-9、CA724比较,差异均无统计学意义(P>0.05)。(表1、图1)
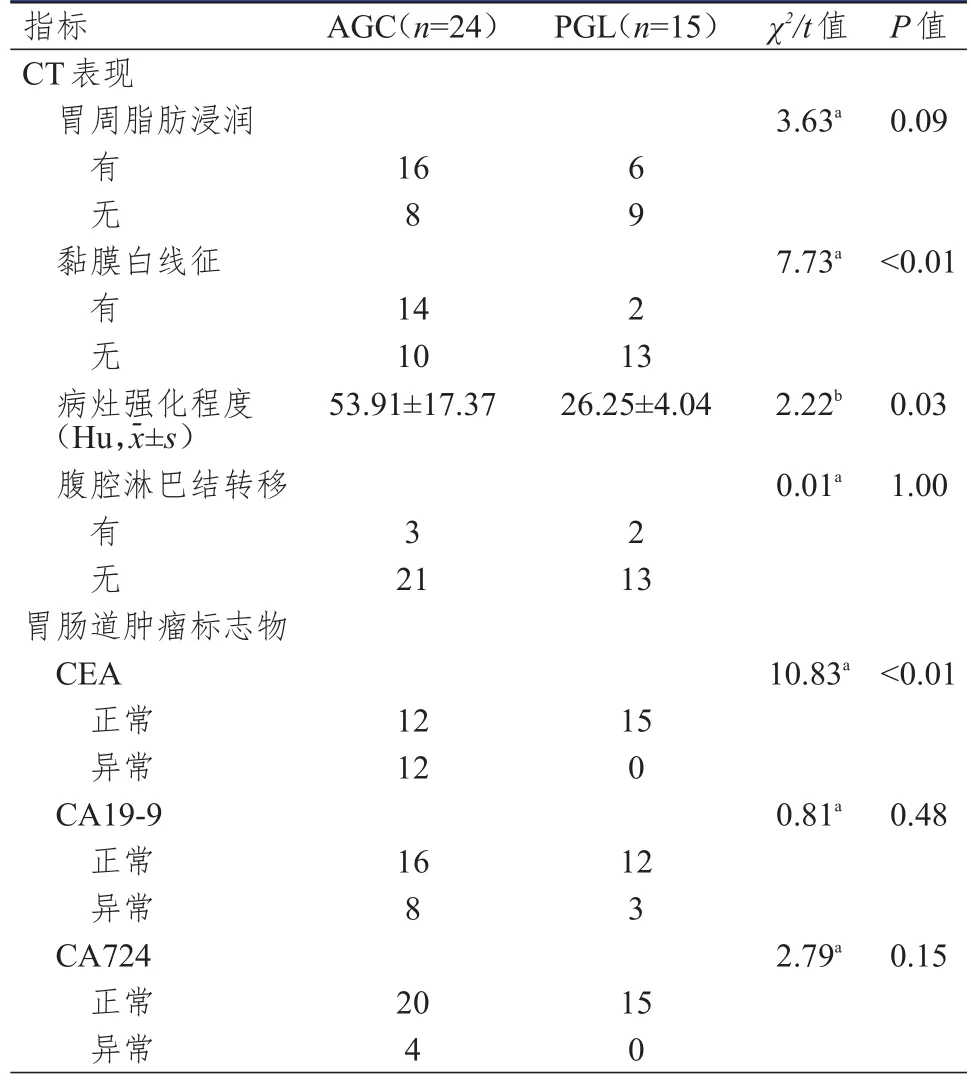
表1 AGC和PGL患者CT表现和胃肠道肿瘤标志物的比较
2.2 CT表现、胃肠道肿瘤标志物及联合应用的诊断效能
CT表现、胃肠道肿瘤标志物和联合应用的AUC 值分别为 0.88(0.73~0.96)、0.75(0.58~0.87)、0.97(0.86~0.99),两两比较,CT表现与胃肠道肿瘤标志物的AUC值比较,差异无统计学意义(P>0.05),联合应用AUC值分别高于CT表现及胃肠道肿瘤标志物,差异均有统计学意义(P<0.05)。联合应用时灵敏度、准确度最高。(表2、图2)

表2 CT表现、胃肠道肿瘤标志物及联合应用的诊断效能

图2 CT表现、胃肠道肿瘤标志物及联合应用鉴别诊断AGC和PGL的ROC曲线
3 讨论
本研究通过对比AGC和PGL的CT表现及胃肠道肿瘤标志物的差异,发现黏膜白线征、病灶强化程度、CEA可用于鉴别AGC和PGL,而AGC和PGL在胃周脂肪浸润和腹腔淋巴结转移方面无差异,CT表现和胃肠道肿瘤标志物联合应用较单一方法具有更好的诊断效能。
多层螺旋CT在鉴别AGC和PGL中具有重要的价值,可以通过各种影像表现对两者进行鉴别。本研究表明AGC患者中黏膜白线征多见,黏膜白线征主要表现在动脉期及静脉期出现的黏膜表面斑片状或条索状的强化,由于AGC较PGL有较多新生血管,而且主要集中在肿瘤表面[4,9],因此更容易出现黏膜白线征,这与既往研究一致[3]。本研究还表明AGC的病灶强化程度高于PGL,主要是由于AGC能产生大量的血管内皮生长因子促进肿瘤血管生成,且生成血管多为不成熟的毛细血管,而PGL起源于胃黏膜固有层和黏膜下层淋巴滤泡细胞,细胞排列紧密,血供不丰富,所以AGC的病灶强化程度高于PGL[5]。本研究中AGC和PGL患者胃周脂肪浸润情况无差异,有研究表明PGL出现胃周脂肪浸润的概率低于AGC[10-11],但也有文献表明二者差异无统计学意义[3,12],可能与CT成像对该征象显示欠佳及主观因素影响有关,从而判断过度[13]。AGC和PGL均可出现胃周淋巴结肿大及腹膜后淋巴结肿大,这与既往研究的结果[12]是一致的,但是也有一些鉴别点可以进行区分,如PGL淋巴结多出现在肾门下,AGC淋巴结多出现坏死等[3]。
胃肠道肿瘤标志物是胃肠道肿瘤的重要检查方法,具有方便快捷、检测费用低的优点,但存在灵敏度、特异度低的问题,可以用于胃肿瘤的早期诊断,为临床提供鉴别诊断信息[14]。本研究中发现AGC和PGL患者中CEA阳性情况存在差异,而CT征象与胃肠道肿瘤标志物联合应用较单一方法能够提高诊断效能。相关研究表明CEA在不同肿瘤中阳性率存在差异,如大肠癌CEA阳性率高于胃癌[15-16],继往文献也表明肿瘤标志物联合影像检查可以提高肺周围型病灶、卵巢上皮肿瘤、睾丸生殖细胞肿瘤的诊断效能[17-20]。
既往有研究对比了影像组学模型及CT征象模型对AGC和PGL的鉴别诊断价值[10,12],CT征象模型与本研究中CT表现模型诊断效能类似,本研究的CT表现与胃肠道肿瘤标志物模型诊断效能稍高于影像组学模型。虽然影像组学模型对于CT表现的分析更为客观,但由于其计算复杂、特征可靠性有待研究等不足尚未应用于临床,本研究中CT表现及肿瘤标志物数据更易获得和分析,因此更适合应用于临床。
本研究不足之处:①PGL组样本量偏少,可能会产生误差,需要纳入更多样本进一步研究;②可用于鉴别的CT征象较多,但本研究中只采用了较常用的指标进行研究,可能会对诊断效能产生影响,需要后期进一步研究;③本研究仅采用了常用的胃肠道肿瘤标志物CEA、CA19-9、CA724,除此外还有CA125、CA242等,另外相关研究表明中性粒细胞/淋巴细胞比值与消化系统肿瘤的严重程度及预后状况等存在相关性[21],它们是否可用于AGC和PGL的鉴别诊断均有待于进一步研究。
综上所述,AGC和PGL在CT征象、肿瘤标志物上存在差异,应用多层螺旋CT增强扫描并结合胃肠道肿瘤标志物具有更高的诊断效能,有利于两种疾病的鉴别。
