表柔比星与丝裂霉素灌注治疗对浅表性膀胱癌患者术后复发的疗效对比分析
2020-09-14连乐林黄志雄张育周
连乐林,黄志雄,张育周
普宁华侨医院泌尿外科,广东 普宁515300
膀胱癌是常见的泌尿系统恶性肿瘤,浅表性膀胱癌所占比例较高[1]。经尿道膀胱肿瘤电切术(transurethral resection of bladder tumor,TURBT)是目前临床治疗浅表性膀胱癌的主要方法,可有效改善临床症状,但术中易残留微小病灶,提高复发率[2]。因此,对于浅表性膀胱癌患者,为了预防复发,术后常联合膀胱内灌注化疗药物进行治疗。丝裂霉素是常见的恶性肿瘤化疗药物,对预防膀胱癌术后复发有确切效果[3]。表柔比星属于蒽环类药物,具有广谱抗肿瘤活性,相比于丝裂霉素,具有不良反应小、肿瘤靶向性强等优点,成为TURBT术后膀胱灌注治疗新的选择[4-5]。为了探讨TURBT术联合表柔比星膀胱灌注对浅表性膀胱癌患者肿瘤活力和复发情况的影响,本研究对80例浅表性膀胱癌患者的临床资料进行回顾性分析,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年1月至2017年12月普宁华侨医院收治的初发浅表性膀胱癌患者。纳入标准:①均经手术病理检查确诊;②肿瘤未转移;③年龄≥18岁;④临床资料完整。排除标准:①合并心、肝、肾等重要脏器功能障碍;②合并严重的呼吸系统疾病;③合并免疫系统疾病;④合并其他类型恶性肿瘤;⑤入院前有放化疗史。根据纳入和排除标准,本研究共纳入80例初发浅表性膀胱癌患者,根据术后处理方法的不同将其分为观察组(n=42)和对照组(n=38)。两组患者的性别、年龄等一般资料比较,差异均无统计学意义(P>0.05)(表1),具有可比性。

表1 两组患者的临床特征
1.2 治疗方法
两组患者均由同一组手术医师完成TURBT术,采取腰硬联合麻醉,麻醉成功后,取截石位,常规消毒铺巾,经尿道置入电切镜,明确病灶的数目、大小和部位等,采用生理盐水循环灌洗,由肿瘤表面到基底部逐层切除肿瘤,周围切至距肿瘤周围约1.5 cm的正常黏膜,深度达到深肌层,电凝止血,确认病灶切除完全,止血退镜,留置导尿管,术后5~7 d根据患者的恢复情况拔除尿管。
观察组患者于术后予以注射用盐酸表柔比星膀胱灌注治疗,患者取截石位,自然平放双手于两侧,严格无菌操作导尿,经膀胱灌注50 mg表柔比星+40 ml生理盐水,保留药物30 min后,改变体位,每个体位持续10 min。治疗总时间为60 min。对照组患者于术后予以丝裂霉素50 mg灌注治疗,方式与观察组相同。两组患者均持续治疗12个月,前2个月每周治疗1次,共治疗8次,之后每个月治疗1次。
1.3 观察指标
比较两组患者术后1、2年的复发情况。采用世界卫生组织(WHO)生存质量测定量表简表(quality of life-brief,QOL-BREF)[6]比较两组患者术前及术后6个月的生存质量评分,评分越高表示生存质量越好。采用酶联免疫吸附法检测并比较两组患者治疗前与治疗12个月后的血清炎症因子水平、治疗前后的血清肿瘤标志物水平,其中,炎症因子包括可溶性细胞间黏附分子1(soluble intercellular adhesion molecule-1,sICAM-1)、可溶性血管细胞黏附分子1(soluble vascular cell adhesion molecule-1,sVCAM-1)和 C反应蛋白(C-reaction protein,CRP),肿瘤标志物包括血清重组人Dickkopf蛋白1(Dickkopf 1,DKK1)、细胞角质蛋白19片段抗原21-1(cytokeratin 19 fragment antigen 21-1,CYFRA21-1)、血管内皮生长因子(vascular endothelial growth factor,VEGF)。观察并比较两组患者的不良反应发生情况。
1.4 统计学方法
采用SPSS 20.0软件对数据进行统计分-析。符合正态分布的计量资料以均数±标准差(x±s)表示,组内比较采用配对t检验,组间比较采用独立样本t检验;计数资料以例和率(%)表示,组间比较采用χ2检验或Fisher确切概率法;以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者复发情况的比较
观察组患者术后1、2年的复发率及2年总复发率均低于对照组患者,差异均有统计学意义(P<0.05)。(表2)
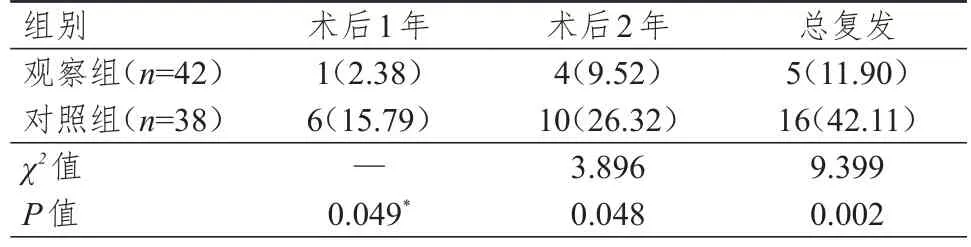
表2 两组患者复发情况的比较[n(%)]
2.2 两组患者生存质量评分的比较
术前,观察组和对照组患者的生存质量评分分别为(52.75±8.12)、(53.36±9.32)分,两组比较,差异无统计学意义(P>0.05)。术后6个月,观察组和对照组患者的生存质量评分分别为(70.84±7.49)、(64.32±7.24)分,均明显高于本组术前,差异均有统计学意义(t=15.021、8.160,P<0.01);术后6个月,观察组患者的生存质量评分明显高于对照组患者,差异均有统计学意义(t=3.950,P<0.01)。
2.3 两组患者炎症因子水平的比较
治疗前,两组患者的血清sICAM-1、sVCAM-1、CRP水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者的上述血清炎症因子水平均低于本组治疗前,且观察组患者的上述血清炎症因子水平均低于对照组患者,差异均有统计学意义(P<0.05)。(表3)
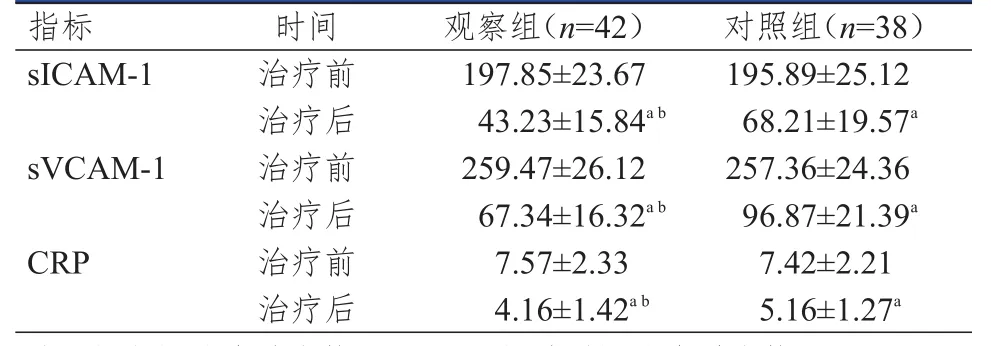
表3 两组患者血清炎症因子水平的比较(pg/ml,x-±s)
2.4 两组患者肿瘤标志物水平的比较
治疗前,两组患者的血清DKK1、CYFRA21-1、VEGF水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者的上述血清肿瘤标志物水平均低于本组治疗前,且观察组患者的的上述血清肿瘤标志物水平均低于对照组患者,差异均有统计学意义(P<0.05)。(表4)
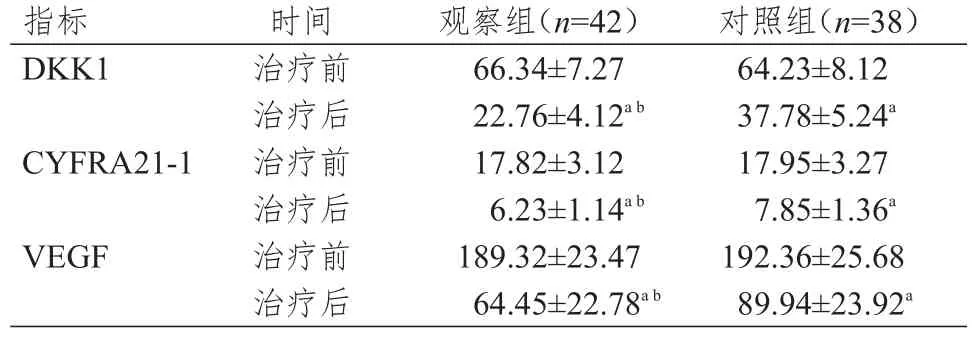
表4 两组患者血清肿瘤标志物水平的比较( μg/ml,x-±s)
2.5 两组患者不良反应发生情况的比较
两组患者均发生了不良反应,包括尿痛、尿频尿急、排尿困难和血尿。观察组患者的不良反应总发生率为30.95%(13/42),低于对照组患者的55.26%(21/38),差异有统计学意义(χ2=4.825,P<0.05)。(表5)

表5 两组患者的不良反应发生情况[n(%)]
3 讨论
浅表性膀胱癌是泌尿外科常见的恶性肿瘤,随着病情的进展,可侵袭肝、肾、直肠等脏器,严重威胁患者的健康与生命[7-8]。目前,TURBT是浅表性膀胱癌的主要治疗手段,能够有效缓解患者临床症状,疗效确切。但浅表性膀胱癌的病灶较复杂,单纯手术难以彻底清除深部病灶,术后残存病灶易在多种因子的刺激下出现继发性增殖而致疾病复发[9]。研究证实,术后辅助膀胱化疗药物灌注治疗能够明显改善患者的预后。采用膀胱灌注化疗药物进行治疗旨在消除术后残留病灶,抑制肿瘤进一步恶化、浸润,从而预防疾病复发[10-11]。
丝裂霉素是治疗恶性肿瘤的常见化疗药物,能够有效促进肿瘤细胞凋亡,对预防恶性肿瘤术后复发疗效确切[12]。表柔比星作为一种广谱的抗肿瘤药物,以其不良反应小、肿瘤靶向性强等特点成为TURBT术后膀胱灌注治疗的选择之一。表柔比星能够通过嵌入脱氧核糖核酸(deoxyribonucleic acid,DNA)碱基对之间,阻断转录过程,干扰mRNA合成,进而对核酸合成产生抑制作用,发挥抗肿瘤作用。另外,表柔比星具有渗透性好、亲脂性强等优点,易在膀胱局部发挥效应,抗肿瘤作用强大且迅速[13-14]。研究表明,膀胱癌患者TURBT术后予以表柔比星膀胱灌注效果显著,能够有效降低复发率[15]。本研究结果显示,观察组患者的术后1、2年复发率均低于对照组,表明表柔比星膀胱灌注能够有效减少浅表性膀胱癌患者TURBT术后的复发率,与姚跃等[16]报道相符。表柔比星对各生长周期的肿瘤细胞均可发挥杀灭作用,清除患者术后残留肿瘤细胞;此外,其还可改善机体的免疫力,促进抗肿瘤作用的发挥,从而预防肿瘤复发[17]。此外,观察组患者的生存质量评分明显高于对照组,不良反应发生率低于对照组,原因可能在于表柔比星与膀胱癌细胞有着良好的亲和力,可迅速弥散于局部病灶,快速杀灭肿瘤细胞,同时入血少,从而导致不良反应少,提高生存质量。
膀胱癌患者因机体代谢的长期紊乱和毒性代谢产物的堆积,炎性反应明显。sICAM-1、sVCAM-1均是新型的黏附分子免疫球蛋白,调控着细胞正常的生理功能,参与机体炎症反应的发生,并在肿瘤的生长和转移中发挥着至关重要的作用。有研究发现,sICAM-1、sVCAM-1作为重要的肿瘤细胞膜表面抗原,参与着肿瘤免疫应答[18]。研究显示,与健康人群相比,恶性肿瘤患者的sICAM-1、sVCAM-1水平明显提高。CRP是典型的炎症反应蛋白,能够反映机体的炎性应激程度[19]。本研究结果显示,治疗后,观察组患者的血清sICAM-1、sVCAM-1、CRP水平均低于对照组,提示术后表柔比星膀胱灌注能够有效改善患者的炎症状态,进而抑制肿瘤转移,减少复发。DKK1、CYFRA21-1是与膀胱癌恶性程度密切相关的肿瘤标志物,其检测对于肿瘤活力的评价有着重要意义[20]。VEGF能够促进血管内皮细胞分化,在瘤体血管新生中发挥着重要作用。研究发现,膀胱癌患者的病理分期越晚,浸润程度越深,血清VEGF水平越高,这提示VEGF与膀胱癌的侵袭、转移关系密切,可能是复发及预后不良的关键因素[21]。本研究结果显示,治疗后,观察组患者的血清DKK1、CYFRA21-1、VEGF水平均低于对照组,提示表柔比星膀胱灌注能够有效抑制肿瘤进展,降低肿瘤活力。
综上所述,TURBT术后辅助表柔比星膀胱灌注治疗能够有效降低浅表性膀胱癌患者的血清炎症因子水平,抑制肿瘤活力,减少术后复发,改善患者的生存质量,疗效及安全性均较好。然而,本研究属于小样本量的回顾性研究,其所得的研究结果仍需大样本量的前瞻性对照试验加以验证。
