1387例门诊50岁及以上女性宫颈癌机会性筛查结果分析
2020-09-14周扬帆杨晓扬李艳
周扬帆,杨晓扬,李艳
1广东省第二人民医院/广东省应急医院病理科,广州510317
2陆军第74集团军医院疾病预防控制科,广州510318
3南方医科大学附属何贤纪念医院病理科,广州511400
中国是宫颈癌高发国家,宫颈癌好发年龄为45~55岁[1]。世界卫生组织提出发展中国家年龄≥60岁的人为老年人。随着中国人口老龄化的发展,老年宫颈癌患者的比例逐年增加,因此,针对中老年宫颈癌的防治压力也逐年增加。有效的宫颈癌筛查可以降低宫颈癌的发病率,与欧美国家相比,中国宫颈癌普查实施较晚,覆盖范围有限,部分老年女性未行宫颈癌筛查。宫颈癌机会性筛查是指患者就医过程中的被动性筛查,是宫颈癌普查的重要补充[2]。目前,中国宫颈癌筛查主要参考欧美国家的筛查策略,尚无基于国内临床数据的筛查方案,尤其无针对中老年女性的宫颈癌筛查方案[3]。基于上述情况,本研究分析了广东省第二人民医院门诊50岁及以上女性的宫颈癌机会性筛查结果,旨在了解参与机会性筛查的50岁及以上女性的宫颈细胞学检查结果和高危型人乳头瘤病毒(high-risk human papillomavirus,HR-HPV)感染情况,为探索适合中国50岁及以上女性群体的宫颈癌筛查方案提供循证依据,现报道如下。
1 资料与方法
1.1 一般资料
2018年1月1日至2019年6月30日于广东省第二人民医院门诊进行宫颈癌机会性筛查者共132 00例,其中年龄≥50岁1387例,作为观察组;年龄<50岁11 813例,作为对照组。所有受检者均行宫颈液基细胞学检查,其中7106例受检者同期行HR-HPV检测,受检者均有性生活史。
1.2 方法
1.2.1 临床取样 先行细胞取样,再行病毒取样。消毒会阴部,使用窥阴器暴露宫颈,将专用细胞取样刷伸入宫颈鳞柱交界处,刷头紧贴宫颈口黏膜,稍用力转动5圈,将刷头置于取样瓶中,采集的细胞用于宫颈液基细胞学检查;随后将病毒取样刷伸入宫颈鳞柱交界处,逆时针旋转3圈,将刷头置于保存瓶中,采集的样本用于HR-HPV检测。
1.2.2 制片方法及试剂 宫颈液基细胞制片:采用安必平液基细胞沉降式制片染色系统,严格按照操作说明进行操作。将保存液离心,去除血液和黏液,收集沉渣,沉降点样,染色。HR-HPV检测方法:采用杂交捕获-化学发光法检测14种HR-HPV,包括HPV16、18、31、33、35、39、45、51、52、56、58、59、66、68。试剂及检测系统均购自杭州德同生物技术有限公司。
1.3 阅片及诊断标准
1.3.1 宫颈液基细胞学检查结果评估依据《子宫颈细胞学Bethesda报告系统》[4]中的标准进行TBS诊断,可分为:①无上皮内病变或恶性病变(negative for intraepithelial lesion or malignancy,NILM);②鳞状细胞异常,包括意义不明确的非典型鳞状细胞(atypical squamous cells of undetermined significance,ASC-US)、非典型鳞状细胞不除外高级别鳞状上皮内病变(atypical squamous cell,cannot exclude high-grade squamous intraepithelial lesion;ASC-H)、低级别鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL)、高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)及鳞状细胞癌(squamous cell carcinoma,SCC);③腺细胞病变,包括非典型腺细胞(atypical glandular cell,AGC)和腺癌(adenocarcinoma,ADC);④其他恶性病变,除去SCC和ADC以外的恶性肿瘤,包括子宫原发的罕见类型的恶性肿瘤及继发或转移的恶性肿瘤。细胞学诊断ASC-US及以上为阳性。由两名高年资主治医师进行双盲阅片,意见一致为最终诊断结果;若不一致,由第三名主治医师进行阅片。
1.3.2 HR-HPV检测结果 检测值>1.0 pg/ml为阳性;反之,则为阴性。
1.4 统计学分析
采用SPSS 22.0软件对数据进行统计分析。计数资料以例数和率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 宫颈液基细胞学检查结果
门诊机会性筛查者共13 200例,均行宫颈液基细胞学检查。观察组年龄≥50岁,共1387例,其中最大年龄为83岁,中位年龄为54岁,平均年龄为55.59岁。阴性结果为NILM,共1038例(74.84%)。阳性结果为ASC-US及以上,共349例(25.16%),其中ASC-US 201例(14.49%),ASC-H 6例(0.43%),LSIL 72例(5.19%),HSIL 28例(2.02%),SCC 4例(0.29%),腺细胞病变30例(2.16%),其他恶性病变8例(0.58%);其中腺细胞病变来源于子宫颈或子宫内膜,包括子宫颈或内膜腺癌12例和AGC 18例。对照组的年龄<50岁,共11 813例,阳性结果共1481例,阳性率为12.54%。观察组的细胞学筛查阳性率(25.16%)明显高于对照组(12.54%),差异有统计学意义(χ2=165.682,P<0.01)。各年龄阶段受检者的细胞学筛查阳性率比较,差异有统计学意义(χ2=188.20,P<0.01)。观察组中60~64岁受检者的细胞学筛查阳性率最高(达31.41%),≥65岁受检者的细胞学筛查阳性率最低(18.70%)。(表1、表2)
2.2 HR-HPV检测结果
13200例受检者中,7106例同期行HR-HPV检测。观察组共927例,阳性160例,HR-HPV感染率为17.26%。对照组共6179例,阳性836例,HR-HPV感染率为13.53%。观察组的HR-HPV感染率明显高于对照组,差异有统计学意义(χ2=9.307,P<0.01)。不同年龄阶段受检者的HR-HPV感染情况比较,差异有统计学意义(χ2=18.109,P<0.01)。观察组中,细胞学筛查阳性患者的HRHPV感染率达60.47%(130/215),明显高于细胞学筛查阴性患者的4.21%(30/712),差异有统计学意义(χ2=365.892,P<0.01)。(表3、表4)
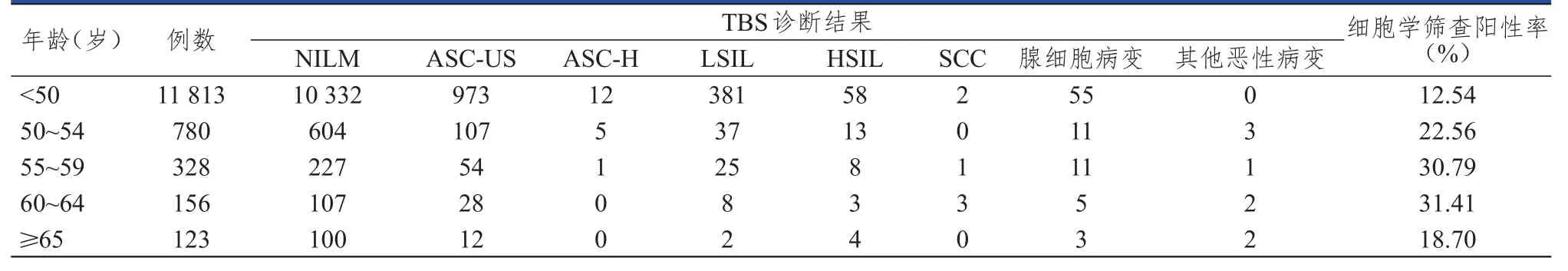
表1 不同年龄阶段受检者的宫颈液基细胞学检查结果(n=13 200)
3 讨论
宫颈癌是最常见的女性生殖系统恶性肿瘤。2015年中国新增宫颈癌病例约10万例,中老年女性新增病例数占总新增病例数的69.2%[5]。随着中国人口老龄化速度的加快,老年女性群体日益增多,老年女性人群的宫颈癌防治压力进一步加重[6]。宫颈癌筛查可以早期发现宫颈病变,有利于及时采取干预措施,使患者获得较满意的治疗效果。西方发达国家宫颈癌筛查实施早、推行广,宫颈癌的发病率和病死率明显下降。英国宫颈癌的普查始于20世纪80年代,随后1990—2003年间,宫颈癌的病死率下降了近2/3[7]。澳大利亚在实施宫颈癌筛查计划后,宫颈癌的发病率显著下降,2012年的发病率较1996年的发病率下降了54.7%[8]。欧美国家宫颈癌筛查覆盖面广,普及率达72%~83%[9]。而目前中国宫颈癌筛查的现状是城市女性多为门诊机会性筛查,而农村女性多数没有筛查。自2009年起,中国启动了“两癌(乳腺癌和宫颈癌)”筛查项目,对35~64岁农村妇女实行免费宫颈癌筛查。但筛查难以覆盖全部范围,部分区域及部分65岁以上的女性未接受筛查[10]。

表2 观察组受检者的宫颈液基细胞学检查结果(n=1387)
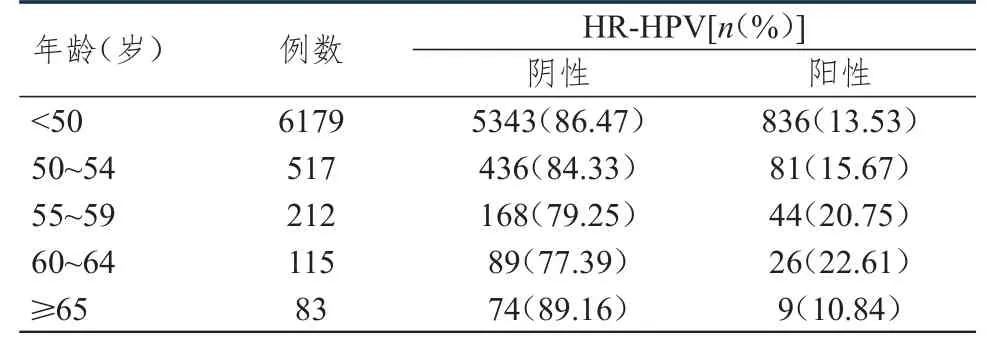
表3 不同年龄阶段受检者的HR-HPV感染情况(n=7106)
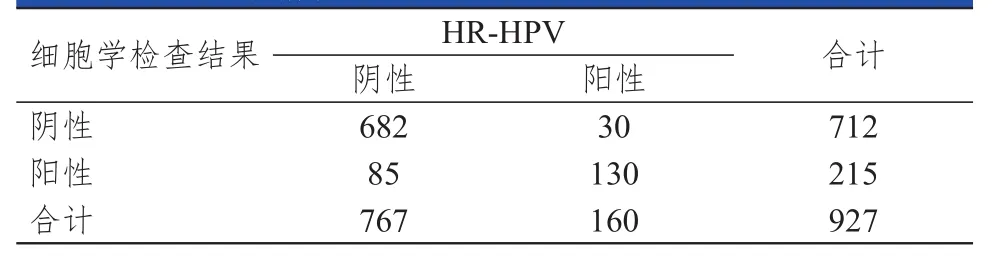
表4 观察组受检者的宫颈液基细胞学检查结果和HR-HPV感染情况
关于宫颈癌筛查终止年龄的建议颇受争议。美国阴道镜和宫颈病理学会(American Society for Colposcopy and Cervical Pathology,ASCCP)于2012年颁布的宫颈癌筛查指南指出:≥65岁的女性患者既往有足够的阴性筛查结果,且没有宫颈上皮内瘤变2级(cervical intraepithelial neoplasia grade 2,CIN2)或以上病变的病史,可以终止筛查。足够的阴性结果是指过去10年内,连续3次细胞学检查结果阴性或连续2次细胞学和HPV联合筛查阴性,且最后一次筛查的时间在5年以内[11]。但国外有研究显示,70岁之前宫颈癌的发病率随着年龄增长而增加[12]。55~69岁女性宫颈癌筛查的阴性结果具有更长时间的保护作用[13]。这说明中老年女性仍需要接受宫颈癌筛查。中国尚无基于中国人群循证医学数据支持的筛查方案,目前国内的宫颈癌防控指南主要借鉴及参考欧美的宫颈癌筛查策略[14]。随着中国人口老龄化速度的加快,需要更加重视老年女性的宫颈癌筛查。本研究的观察组中,各年龄阶段女性的细胞学筛查阳性率均较高,65岁及以上者的细胞学筛查阳性率为18.7%,较其他年龄阶段女性的阳性率低。但如果放弃对这部分人群的宫颈癌筛查,势必加重中国老年女性宫颈癌防治的负担并造成部分宫颈病变或宫颈癌患者漏诊。因此,既要借鉴欧美国家的宫颈癌筛查经验,又要结合国情及国内临床大数据制定中国的筛查策略。
目前常用的宫颈癌筛查方法主要包括宫颈液基细胞学检查和HPV-DNA检测[如二代杂交捕获法(hybird captureⅡ,HC-Ⅱ)、HR-HPV 分型等]。宫颈液基细胞学检查于1996年获得美国食品药物管理局(Food and Drug Administration,FDA)批准应用于临床,随后引入中国。宫颈液基细胞学检查可以富集宫颈脱落细胞,在制片中去除血液、黏液及炎症细胞,使用超薄型涂片,提高异常细胞检出率[15]。目前,各实验室的异常细胞检出率为1.2%~11.7%[16]。本研究中,观察组细胞学筛查的阳性率(25.16%)及各个年龄阶段的阳性率均高于其他实验室水平,这可能主要与抽样人群不同有关:①抽样人群大部分为妇科门诊患者,多数因各种妇科症状来院检查;②抽样人群为中老年女性,这类患者生殖器官功能下降、雌激素水平分泌降低、免疫力下降,是宫颈病变的高发人群[17]。除此之外,也不能排除地域因素、不同实验室间制片技术和诊断技术等的差异。中老年女性激素水平下降,宫颈移行带上移,移行区的细胞采样困难。此外,宫颈上皮细胞萎缩,细胞核质比增高、核深染,细胞膜脆弱易破裂,出现裸核,这些形态也可能被误诊为肿瘤细胞[18]。中老年女性宫颈脱落细胞的这些特殊性给宫颈细胞学诊断增加了难度。总体来说,宫颈液基细胞学检查特异度较高,但灵敏度较低,对诊断医师的能力要求高,有一定的主观性。
HR-HPV感染是宫颈上皮内病变及宫颈癌的高危因素,尤其是HPV16和HPV18感染,占所有宫颈癌患者的70%以上[19]。中老年女性随着免疫力和雌激素水平的下降,HR-HPV易感性增加,更容易发展为HR-HPV持续感染的状态[20]。HPV感染的年龄分布呈“V”字形,年轻女性和老年女性都具有较高的HPV感染率[21]。目前报道的普通女性的HR-HPV感染率为10.7%~20.0%[22-23]。本研究中,观察组的HR-HPV感染率为17.26%,与上述报道结果一致,不同年龄阶段受检者的HR-HPV感染情况比较,差异有统计学意义(P<0.01)。观察组各年龄阶段的HR-HPV感染率呈倒“V”字形,60~64岁受检者的HR-HPV感染率最高,达22.61%。观察组中,细胞学筛查阳性患者的HR-HPV感染率达60.47%,明显高于细胞学筛查阴性患者的4.21%,差异有统计学意义(P<0.01)。HR-HPV检测用于筛查宫颈癌的灵敏度及特异度均较高,且客观性好,单独HR-HPV筛查方案适用于细胞病理医师不足的国家[14]。但HR-HPV筛查的假阳性率及假阴性率也较高,尤其是在老年患者中。60岁以上的老年患者HPV筛查的假阴性率达33.3%,且随着年龄的增加,假阴性的比例也会增加[24]。
本研究中,受检者具有较高的细胞学筛查阳性率和HR-HPV感染率,特别是细胞学筛查阳性率高于其他实验室水平,说明应重视门诊50岁及以上女性的宫颈癌机会性筛查工作;同时也表明,有效的门诊机会性筛查是对中国50岁及以上女性宫颈癌普查工作的重要补充。观察组细胞学筛查阳性的患者中,39.53%(85/215)为HR-HPV阴性,说明单独的HR-HPV检测存在漏诊的风险。此外,观察组细胞学筛查除了发现宫颈病变外,还发现了少数来源于子宫内膜或子宫以外的病变,这些病变与HR-HPV感染无关,而通过细胞学筛查,可以早期发现并及时进行干预治疗。另一方面,HR-HPV阳性反映机体存在病毒感染,而早期的HPV感染不一定有宫颈细胞的病理学变化。本研究中,细胞学筛查阴性的患者中,4.21%(30/712)为HRHPV阳性。如果对这部分患者单独进行细胞学筛查,则患者可能处于HR-HPV持续感染状态,宫颈癌的罹患风险将明显增加。此外,门诊机会性筛查患者来自全国各地,随诊次数增加也会加重患者的经济负担,甚至出现失访的情况。没有任何检查技术是完美的,HR-HPV检测联合宫颈液基细胞学检查虽然增加了患者的单次检查费用,但提高了筛查的灵敏度、特异度和准确度,也间接减少了患者重复检查的费用[25]。一方面,HR-HPV检测可以弥补中老年女性宫颈液基细胞学检查取样难、灵敏度低的不足,降低筛查的假阴性率;另一方面,宫颈液基细胞学检查通过镜下直接观察细胞形态,可以减少HR-HPV检测出现的假阳性和假阴性。因此,对于门诊50岁及以上女性来说,宫颈液基细胞学检查联合HR-HPV检测能够减少宫颈病变筛查的假阳性和假阴性结果,提高筛查的灵敏度和特异度。尽管本研究对50岁及以上女性宫颈病变的筛查手段和方案进行了初步研究和探讨,但由于门诊患者来自全国各地,随访难度大,对于筛查结果为阳性的患者,很难追踪到可靠的组织病理结果进行对照研究。因此,门诊50岁及以上女性的具体筛查策略、筛查间隔时间及终止筛查年龄等问题,还需要长时间大样本的深入研究。
综上所述,50岁及以上女性具有较高的宫颈细胞学筛查阳性率和HR-HPV感染率,有效的门诊机会性筛查能够尽早发现宫颈病变,降低宫颈癌的发生风险,而宫颈液基细胞学检查联合HR-HPV检测能够提高筛查的灵敏度和特异度,是50岁及以上女性宫颈癌筛查的重要手段。
